修回日期: 2007-09-25
接受日期: 2007-09-28
在线出版日期: 2007-10-18
过去20年小肠移植取得了显著进展, 现在小肠移植不再是一项被认为成实验性的技术, 而是治疗不可逆肠衰竭的可行选择. 国际小肠移植登记处(international intestinal transplant registry, ⅡTR)数据显示开展的移植手术持续增加, 已达每年180例, 移植肠和移植患者的一年存活率均达到80%. 但感染和排斥反应仍然是术后治疗过程中遇到的最棘手问题. 我们简要概括了小肠移植领域的最新进展, 包括适应症、受体的评价、 外科技术、免疫抑制、排斥和感染.
引文著录: 朱亮, 李幼生, 黎介寿. 小肠移植的研究进展. 世界华人消化杂志 2007; 15(29): 3107-3114
Revised: September 25, 2007
Accepted: September 28, 2007
Published online: October 18, 2007
Great progress has been achieved in of small bowel transplantation (SBT) over the past 20 years, SBT is now no longer considered an experimental procedure and has become a lifesaving therapy in patients with irreversible loss of intestinal function. The Transplant Registry has shown that 180 SBTs are performed each year. Current 1-yr patient and graft survival rates are 80%. Infection and acute rejection of the small bowel are still the most disturbing complications in patients undergoing SBT. This article summarizes recent advances its indications, evaluation of intestinal transplant candidates, surgical techniques, immunosuppressive therapy, rejection, and infection.
- Citation: Zhu L, Li YS, Li JS. Advances in small intestinal transplantation. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3107-3114
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3107
小肠移植是治疗终末期小肠功能衰竭(end-stage of intestinal failure)的理想方法[1]. 小肠是体内最大的淋巴库和细菌库, 其移植免疫反应较其他脏器移植更为剧烈和复杂, 在排斥移植物的同时肠源性感染时有发生, 从而使小肠移植的应用落后于肾脏、肝脏和心脏等其他器官移植[2-3]. 近年来随着免疫抑制、抗感染和外科技术的进步, 小肠移植取得了显著进展[4-8]. 虽然以前小肠移植术被视为是治疗小肠衰竭的最后手段, 但目前认为他不仅能用来救生, 还能提高患者的生活质量[9-10].
1964年美国Deterling首次试行人小肠移植2例, 但植入小肠分别于术后12 h和2 d坏死, 予以切除. 20世纪80年代以前共行小肠移植7例, 存活超过1 mo的仅Fortner于1970年施行的1例同胞姐妹间的移植, 存活76 d后死于败血症. 至此临床小肠移植处于停滞状态, 直到80年代中期随环孢素A(CsA)的问世才开始有了根本性突破[11]. 1988年德国Deltz et al[12]施行亲姐妹间单纯小肠移植存活达61 mo, 这是世界上首例成功的单独小肠移植. 1990年始用更为强效的免疫抑制药FK506(他莫克司, Tacrolimus)之后, 小肠移植的效果明显提高, 1995年移植病例总数超过200例, 2001年超过700例[13-14], 2003年超过1000
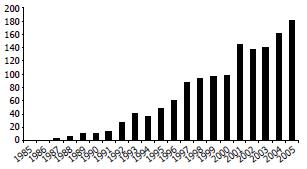
例[15-16]. 2005年在布鲁塞尔召开的第九届国际小肠移植研讨会上, 报告了国际小肠移植登记处(International Intestinal Transplant Registry, ⅡTR)的最新结果, 移植病例总数超过1300例(60%为儿童), 2003-2005年共有29个小肠移植中心进行了323例小肠移植, 移植肠和移植患者的1年存活率均达到80%[9], 有的小肠移植中心达到91.7%, 5年存活率接近肺移植患者, 最长的移植肠功能存活为14.2年[15]. 每年开展的移植手术持续增加, 已达每年180例(图1), 其中大部分在美国开展, 那里拥有最多的家庭胃肠外营养(PN)患者(平均每1 000 000中就有40人, 共有约10 000人)[17]. 在欧洲每百万人口的年小肠移植率成人为0.3-0.8, 儿童0.29-2.0[18-19]. 我国小肠移植的动物实验研究工作开展于80年代中期. 在1994-03-12, 由南京军区总医院施行了亚洲首例临床异体小肠移植并获得成功[20], 患者存活了310 d, 死于霉菌感染. 该院于2003-04-04又成功施行了国内首例肝小肠联合移植[21]. 至今国内共实施小肠移植20余例.
无法以全胃肠外营养(TPN)治疗的肠衰竭是小肠移植的绝对适应症, 而可依赖TPN的小肠功能全丧失的治疗方法有两种, 即TPN和同种异体小肠移植[22-23]. 从人口统计学调查来看, 只有2%-5%的成年患者和5%-15%的儿童患者在大型的胃肠外营养计划中将出现危及生命的并发症[24]. 从ⅡTR的分析来看, 患者在家庭胃肠外营养中病情一开始恶化就进行肠移植(存活率80%-100%)和已经确诊为肝脏疾病并伴有明显黄疸时再进行肠移植(存活率40%-60%), 前者效果明显好于后者[9]. 因此, 患者在家庭胃肠外营养中一旦出现并发症尽快进行小肠移植手术是至关重要的, 这也是第九界国际小肠移植会议的重要结论. 肝小肠联合移植适用于不可逆肠衰竭合并终末期肝损害[25-26]. 多器官联合移植适用于全胃肠道神经或肌肉发育异常造成的整个消化道功能障碍, 只能通过切除腹腔大部分脏器予以清除的腹部肿瘤[27-29].
小肠移植的适应症可归纳为: (1)短肠综合征: 肠闭锁、肠扭转、坏死性小肠结肠炎、外伤、血栓症、缺血导致的小肠梗死及Crohn's病肠大部切除术后所致的短肠; (2)肠吸收功能不良: 微绒毛包涵病、分泌性腹泻、自身免疫性肠炎、放射性肠炎; (3)肠运动功能不良: 全小肠粘连致长期慢性梗阻、假性肠梗阻、小肠肌细胞及神经细胞病变; (4)系膜根部肿瘤或癌及家族性息肉病. 造成小肠功能丧失的原发病在儿童与成人有很大不同, 在儿童中排前3位的为腹裂畸形、肠扭转和坏死性小肠炎, 在成人排前3位的为肠缺血、Crohn's病和外伤[30](表1).
| 成人 | 儿童 | ||
| 适应症 | % | 适应症 | % |
| 缺血(Ischemia) | 25 | 腹裂畸形(Gastroschisis) | 22 |
| 克隆氏病(Crohn disease) | 13 | 肠扭转(Volvulus) | 17 |
| 外伤(Trauma) | 9 | 坏死性小肠炎(Necrotizing enterocolitis) | 12 |
| 其他短肠(Other short gut) | 9 | 假性肠梗阻(Pseudoobstruction) | 9 |
| 肠扭转(Volvulus) | 8 | 肠闭锁(Intestinal atresia) | 8 |
| 运动(Motility) | 8 | 神经节细胞缺乏病(Hirschsprung) | 7 |
| 硬纤维瘤(Desmoids) | 8 | 再移植(Retransplant) | 7 |
| 再移植(Retransplant) | 6 | 微绒毛包含病(Microvillous inclusion) | 6 |
| 其他(Miscellaneous) | 6 | 其他(Other causes) | 4 |
| 其他肿瘤(Other tumor) | 5 | 吸收障碍(Malabsorption) | 3 |
| 家族性息肉病(Gardner's syndrome) | 3 | 其他短肠(Other short gut) | 3 |
| 肿瘤(Tumor) | 1 | ||
| 其他运动障碍(Other motility) | 1 | ||
受体的评价包括证实适应症, 计算风险和排除禁忌症一系列检测[4,18,31](表2). ABO血型必须一致否则会增加移植物抗宿主反应的危险, 凝血因子和抗凝因子的检测有利于防止术后血栓的发生, 静脉的核磁共振(magnetic resonance imaging, MRI)检测能帮助中心静脉通路丧失和置管并发症反复发作病例确定静脉吻合部位, 肝活检能评价肝肠移植患者的肝纤维化程度.
| 评价步骤 | |
| 第一步 | 第1次医疗谈话, 病史, 体格检查 |
| 第二步 | 生化检查: 血常规, 尿常规, 凝血4项, 抗凝血酶Ⅲ, 血离子, 肝功, 肾功, 血糖, 血脂, 血乳酸, 血氨, C反应蛋 |
| 白, TSH, T3, T4, 血瓜氨酸, AFP, CEA, CA199, CA125, 血气分析, 内生肌酐清除率 | |
| 血清学检查: HAV(anti-HAV), HBV(HBsAg, HBeAg, HBcAg, anti-HBs), HCV(anti-HCV), HIV(anti- | |
| HIV), HSV(anti-HSV), CMV(anti-CMV), EBV(anti-EBV), 念珠菌抗原(Candida-Ag), 霉菌抗原(Aspergillus-Ag) | |
| 免疫学检查: ABO抗原, HLA(human leukocyte antigen), anti-HLA antibodies, PRA(panel-reactive antibodies) | |
| 辅助检查: 心电图, 超声心动图, 胸片, 肺功能检测, 脑彩超, 腹部彩超, 腹部MRI, 骨密度检测 | |
| 第三步 | 有创检查: 应激心电图, 冠脉造影, 腹主动脉-肠系膜上动脉造影, 胃十二指肠镜, 结肠镜, 肝、肾活检 |
| 会诊: 麻醉科, 胃肠科, 循环科, 肾脏科, 泌尿科, 神经科, 妇科, 耳鼻喉科, 牙科, 心理科, 皮肤科 | |
| 第四步 | 多学科讨论会, 最后的医疗谈话, 排队等待 |
1989年美国Starzl et al[32]为一例3岁的小肠衰竭患儿成功地施行多器官移植(十二指肠、小肠、肝和胰), 术后存活192 d, 死于淋巴瘤, 这是首例小肠移植功能性长期存活的病例. 1988年加拿大Grant et al[33]施行首例肝肠联合移植, 2 mo后完全停用TPN, 存活58 mo. 1988年德国Deltz et al[12]施行亲姐妹间单纯小肠移植(60 cm空、回肠)治疗短肠综合征, 存活3年后发生淋巴瘤, 通过营养支持存活了61 mo, 这是世界上首例成功的单独小肠移植. 上述3种小肠移植模式(腹部多器官移植、肝肠联合移植和单纯小肠移植)的成功, 确立了临床小肠移植的3种类型并沿用至今[34-36].
供肠动脉吻合至受体的任何部位都不会影响移植效果. 静脉回流途径采取门静脉回流最符合解剖和生理要求, 经肝滤过易位的细菌及毒素, 会减少机体出现菌血症的危险[37-38]. 但是小肠移植受体大多有多次腹部手术史, 广泛的腹腔粘连使得移植手术难度加大, 门静脉回流在技术上有困难, 采用腔静脉回流在技术上则显得较为简便、安全. 当然, 回流途径的选择主要还是根据术中情况而定, 首选门静脉, 其次是肠系膜上静脉、脾静脉和下腔静脉, 这样的观点一直为大家所接受[39]. 静脉吻合口要足够大, 流出道梗阻会造成严重的移植肠失功. 大多数小肠移植中心手术后采用末端回肠造口作为术后排斥反应的观察窗, 因为腹腔容积和移植物大小不匹配, 使得小肠移植术后的关腹变得较为困难. 补片、皮肤拉链、皮肤移植等技术的应用能使这一问题得到解决[40-43].
肝肠联合移植有两种方法: 肝、肠和部分或全部的胰腺整块移植, 肝脏和小肠分别进行移植[44-46]. 整块移植最初是由内布拉斯加州大学的Alan Langnas博士和他的同事提出的, 其优点是手术简单, 不必将胰十二指肠复合物从肝肠联合移植物上移开, 减少供应肝脏血管损伤的危险, 同时不需要进行胆汁引流操作, 该技术已被大多数移植中心所接受[47]. 肝脏和小肠分别移植指移植肝、肠作为各自独立的二个移植物被同时移植[48], 其有3个优点: 在不改变其他部分的情况下移植物的任一部分都可更换; 移植物的两个部分均可减少更多, 只利用肝脏的左外侧部分和局部小肠进行移植, 能在更大范围内调节供体和受体之间的尺寸差异; 移植物可以来自活体捐赠移植[49-51]. 但其主要缺点是手术时间要比整块移植术长, 技术难度大.
1989年匹兹堡大学研究小组引进FK506, 这种强免疫抑制剂的使用显著提高了小肠移植的成功率. 目前小肠移植患者接受以FK506为基本药物的免疫抑制治疗[9,15], 但在术后早期单用FK506和类固醇仍不能令人满意, 而且过高剂量的FK506有潜在的肾毒性[52]. 10年来出现了各种新型的免疫抑制剂同FK506联合应用[4,7,53](表3).
| 名称[作用方式] | 剂量[监测指标] | 副作用 |
| Alemtuzumab (Campath1H) [anti-CD52 mAb] | 0.3 mg/(kg•d) iv[淋巴细胞数] | 淋巴细胞减少, 感染 |
| ATG (Thymoglobulin) [T-cell pAb] | 1.25-5 mg/kg iv 5-10 d[淋巴细胞数] | 淋巴细胞减少, 感染 |
| Basiliximab (Simulect) [anti-CD25 mAb] | 20 mg iv d 0 and 4[无] | 过敏反应 |
| Daclizumab (Zenapax) [humanized anti-CD25 mAb] | 1-2 mg/kg d 0 and 10[无] | 过敏反应 |
| OKT3 (Orthoclone) [murine anti-CD3 mAb] | 5 mg/d iv 5-10 d[ICU, 淋巴细胞数] | 过敏反应, 感染 |
| Infliximab (Remicade) [anti-TNF-alpha mAb] | 3 mg/(kg•d) iv[无] | 感染 |
| Tacrolimus (Prograf) [calcineurin inhibitor] | 首次量2×0.05-0.075 mg/(kg•d) po此后维持血药浓度谷值10-20 μg/L(<3 mo), 5-15 μg/L(>3 mo) | 神经和肾毒性, 糖尿病, 高血压 |
| Sirolimus (Rapamune) [mTOR inhibitor] | 首次负荷量6 mg po 此后2 mg/d po维持血药浓度谷值5-10 μg/L(<3 mo), 3-8 μg/L(>3 mo) | 伤口延迟愈合, 高脂血症, 贫血, 白细胞减少, 血小板减少, 感染 |
| MMF (Cell cept) [IMPDHinhibitor] | 250-2000 mg/d po | 胃肠道反应, 贫血, 白细胞减少, 血小板减少, 感染 |
| Prednisolone (Decortin H) [unspecific anti-inflammatory] | 灌注前500 mg iv , 急性排斥反应500 mg/d iv 3-5 d[无] | 感染, 青光眼, 骨质疏松, 高脂血症, 糖尿病,Cushing综合症 |
现在美国3个最大的小肠移植中心(匹兹堡、内布拉斯加州、迈阿密)全都使用白细胞介素-2受体阻断剂(Daclizumab, Basiliximab人源化的抗CD25 mAb通过阻断白细胞介素-2受体抑制细胞毒性T细胞的克隆增殖), 但在减少淋巴细胞的诱导方案中使用了3种截然不同的方法: 人单克隆抗胸腺细胞免疫球蛋白, 用Campath 1H(Alemtuzumab, 人源化的抗CD52 mAb造成T淋巴细胞严重持久的耗损)预处理移植受体,用抗淋巴细胞免疫球蛋白预处理移植小肠. 这些新方法的主要成果是减少FK506和类固醇的接触. 3个中心均报告存活率有所提高, 匹兹堡研究小组将FK506使用量减少到隔天使用, 停止使用类固醇, 共试验6 mo, 在过去两年中记录到100%的存活率[9]. Fishbein et al[54]研究显示, FK506和Sirolimus(雷帕霉素)联合应用显著提高移植患者和移植肠的存活率(91.7%, 91.7%), 单用FK506为79.0%和57.9%. 用白细胞介素-2受体阻断剂代替0KT3(抗CD3 mAb)减少了急性排斥反应的发生率, 使移植患者的3年存活率从50%提高到92%[55]. 应用Campath 1H取代白细胞介素-2受体阻断剂可进一步减少急性排斥反应的发生率, 从177.3%降为96.2%, 并可减少FK506剂量, 机会感染也没有增加[56].
同种异体排斥反应仍是小肠移植所面临的主要问题, 在一组儿童小肠移植的报道中, 共发生345次排斥反应, 平均每例病儿发生4次排斥反应, 其中有90%在术后第1个月内首次发作[57]. 另一组研究显示, 急性排斥反应导致439个患者中49人死亡, 56.3%的移植肠被切除[15]. 急性排斥的临床表现为腹胀、腹泻、发热等, 均为非特异性的, 也可无症状. 一般情况下, 凡有不明原因的造瘘口流出液量或大便量增多, 都要考虑是否有排斥反应发生. 严重的急性排斥反应可以导致供肠肠梗阻、黏膜脱落而出血以及菌群易位甚至感染性休克. 早期诊断排斥反应, 予以治疗或防止其发生是保证小肠移植成功的重要因素. 活检标本的组织学检查仍是诊断急性排斥反应的金标准[58-59](表4), 但因其病理变化本身已是排斥反应的结果, 所以单一病理检查无法对排斥反应做出早期诊断. 目前应用免疫组化方法测定IL-2R、IL-8, TNF-α等细胞因子有助于排斥反应的早期诊断[60]. 血清中瓜氨酸、次级胆汁酸、脂肪酸结合蛋白浓度在排斥反应发展过程中也有显著差异[61-63]. D-木糖吸收试验也可早期反映小肠是否发生排斥反应[64].
| 分级 | 组织学特征 |
| 不确定性(Borderline) | 局限、极微的炎性浸润, 极微的隐窝上皮损伤, 凋亡小体数量增加(<6个凋亡小体/10个隐窝), 无绒毛结构破坏, 无黏膜溃疡 |
| 轻度(Mild) | 轻度、局限的炎性浸润, 主要集中在固有层的小静脉周围. 轻度隐窝上皮损伤, (>6个凋亡小 体/10个隐窝), 轻度绒毛结构破坏, 无黏膜溃疡 |
| 中度(Moderate) | 炎症浸润在固有层扩展散布, 中度隐窝损伤, 凋亡小体增多, 常见局部的"融合凋亡"现象, 可 见轻至中度的动脉内膜炎, 中度绒毛结构破坏, 无黏膜溃疡 |
| 重度(Severe) | 中度急性排斥反应基础上有黏膜溃疡, 严重的动脉内膜炎, 甚至透壁动脉炎 |
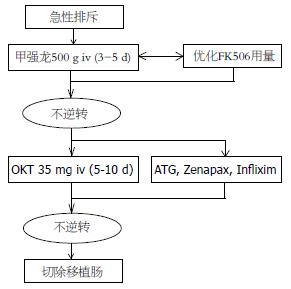
急性排斥确诊后, 应立即给予一线抗排斥药, iv甲基强的松龙0.5-1.0 g/d(3-5 d)治疗, 同时调整FK506的用量. 对激素难以逆转的排斥反应, 应使用ATG(Thymoglobuline, 抗人胸腺细胞免疫球蛋白)和OKT3(Orthoclone, 抗CD52 mAb)治疗[65]. 最近的研究发现, Infliximab(anti-TNF-alpha mAb, 抗肿瘤坏死因子单克隆抗体)治疗急性排斥效果较好[66]. 如上述治疗仍难以控制排斥反应, 应切除移植小肠(图2).
感染是小肠移植的另一严重问题, 既可为受体免疫功能受抑制所致的全身感染, 亦可为移植肠被排斥而通透性增加细菌毒素易位所引起的肠源性感染. 小肠移植术后感染的预防控制与免疫抑制治疗处于相互矛盾和牵制的关系之中, 免疫抑制治疗的剂量范围较狭窄, 因此排斥和感染处理上的矛盾比其他移植器官更为复杂. 根据临床监测结果精确地调整免疫抑制药物的用量是预防术后感染的一个重要原则. ⅡTR报告小肠移植439例中202例(46%)死于感染[9].
巨细胞病毒(CMV), EB病毒(EBV), 念珠菌, 霉菌等机会性感染是造成严重并发症和死亡的主要原因[4]. CMV感染是细胞免疫功能缺陷程度的测量标志, 与排斥反应和GVHD关系密切, 严重影响移植小肠的功能, 也是移植后受体死亡的主要原因之一. 在使用FK506的各种器官移植中CMV感染的发生率都很高, 其中小肠移植术后CMV感染的发生率更为突出. CMV诊断依靠PCR(聚合酶链反应), 其防治可用Ganciclovir(更昔洛韦)及CMV特异性免疫球蛋白. 对高危患者(CMV血清学阳性的供体移植给CMV阴性受体)和可疑CMV感染患者应给予Ganciclovir预防. EBV感染及EBV相关的PTLD(Post Transplant Lymphoproliferative Disease, 移植后淋巴增殖性疾病)是导致小肠移植失败的另一个重要原因, EBV感染发病率为20%-29%, 致死率可高达45%, 儿童的发病率明显高于成人. EBV早期诊断运用定量PCR[67]. 临床感染EBV应用高剂量Ganciclovir 2×10 mg/kg治疗直到PCR滴度下降. EBV感染可致PTLD, 进而发展为淋巴瘤. PTLD一直是小肠移植的一个严重的并发症, 发病率为6%至8%(儿童稍高). PTLD一般在移植后25 mo高发, 低龄、多器官联合移植、0KT3治疗、Campath 1H治疗是发生PTLD的高危因素[68]. PTLD诊断运用病理学方法, 组织学检查可见肠道病损区黏膜、黏膜下、系膜淋巴结T细胞区免疫母细胞浸润、增生及有丝分裂象, 细胞分析呈单克隆. 治疗PTLD包括减用免疫抑制剂、加大Ganciclovir用量、化疗等, 但效果均较差. 最近应用rituximab(抗CD20 mAb)治疗PTLD效果明显, 显著降低致死率[69-70]. 真菌感染是小肠移植后感染的又一棘手问题. Cicalese et al[71]报告一组小肠移植患者50例术后发生真菌感染5%, CMV感染37.5%, EB病毒感染18.7%. 我国首例小肠移植, 受体即死于霉菌感染, 尸检无排斥反应的病理发现. 抗真菌治疗可选用Fluconazole(氟康唑), 肾功能不全者可选用二性霉素B治疗. 抗真菌治疗的指征是: 严重的细菌感染或病毒感染, 抗生素治疗不能逆转的感染,长期抗生素治疗, 严重反复发作的排斥反应, 激素难治性排斥反应和0KT3治疗, 再移植[4].
总之, 过去20年小肠移植进步迅速并取得了显著成功, 随着技术的进步和新型免疫抑制剂的应用, 小肠移植的例数逐年增加, 其临床处理方法和经验日益成熟并已进入实用阶段, 逐步发展成为除TPN之外治疗肠功能衰竭的另一选择.
小肠移植是治疗终末期小肠功能衰竭的理想方法, 过去20年小肠移植取得了显著的发展, 每年开展的移植手术持续增加, 已达每年180例, 移植肠和移植患者的一年存活率均达到80%, 现在小肠移植不再被认为是一项实验性的技术, 而是治疗不可逆肠衰竭可行的选择.
同种异体排斥反应仍是小肠移植所面临的主要问题, 目前小肠移植患者接受以他莫克司(FK506, Tacrolimus)为基本药物的免疫抑制治疗, 现有各种免疫抑制剂同FK506联合应用方案的选择仍然是排斥领域的难点和热点, 感染是小肠移植的另一严重问题, 小肠移植术后感染的预防控制, 排斥和感染处理上的矛盾是研究的热点及亟待研究的问题.
Beath(Trans-plant Proc. 2006; 38(6): 1657-8.)总结了2005年在布鲁塞尔召开的第九届国际小肠移植研讨会, Ruiz(Trans-plantation. 2007 15; 83(1): 1-6)论述了小肠移植的外科技术, Braun (Langenbecks Arch Surg. 2007; 392: 227-238)讨论了小肠移植当前使用的免疫抑制剂, 均同本文观点一致.
本文章的创新点是总结了最近20年小肠移植的发展, 概括了小肠移植领域的最新进展, 尤其在排斥和感染方面作了大篇幅的论述.
本文论述的小肠移植的最新研究进展, 对小肠移植的临床和基础研究有一定的指导意义.
白细胞介素-2受体阻断剂(Daclizumab, Ba-siliximab): 是一种人源化单克隆IgG1抗CD25抗体, 与白介素-2受体上的链式又称Tac亚单位特异性地结合, 从而抑制后者与白介素-2的结合, 阻断激活状态下T淋巴细胞的扩增, 可减少免疫应答致急性排异反应的发生, 但对其他免疫活性细胞无影响, 优点在于具有特异性.
本文实用性强, 对国内小肠移植临床和科研工作的开展有一定的指导意义.
编辑: 李军亮 电编:郭海丽
| 1. | Ruiz P, Kato T, Tzakis A. Current status of trans-plantation of the small intestine. Transplantation. 2007;83:1-6. [PubMed] |
| 2. | Li Y, Zhu L, Li J. Absorption of orthotopically transplanted intestine in rats: evaluation of amino acid absorption. Transplant Proc. 2006;38:1827-1829. [PubMed] |
| 3. | Yandza T, Schneider SM, Canioni D, Saint-Paul MC, Gugenheim J, Chevalier P, Goubaux B, Benchimol D, Hebuterne X. Intestinal transplantation. Gastroenterol Clin Biol. 2007;31:469-479. [PubMed] |
| 4. | Braun F, Broering D, Faendrich F. Small intestine transplantation today. Langenbecks Arch Surg. 2007;392:227-238. [PubMed] |
| 5. | Li Y, Zhu L, Li J. Two-step procedure of whole orthotopic intestinal transplantation in rats: considerations of techniques and graft functional adaptation. Microsurgery. 2006;26:399-403. [PubMed] |
| 6. | Wales PW. Surgical therapy for short bowel syndrome. Pediatr Surg Int. 2004;20:647-657. [PubMed] |
| 7. | Platz KP, Braun F, Fandrich F, Kremer B, Mueller AR. IL-2 antagonists: the European perspective. Transplant Proc. 2005;37:1783-1784. [PubMed] |
| 9. | Beath SV. Closure and summary of Ninth International Small Bowel Transplantation Symposium. Transplant Proc. 2006;38:1657-1658. [PubMed] |
| 10. | Fryer JP. Intestinal transplantation: an update. Curr Opin Gastroenterol. 2005;21:162-168. [PubMed] |
| 12. | Deltz E, Schroeder P, Gundlach M, Hansmann ML, Leimenstoll G. Successful clinical small-bowel transplantation. Transplant Proc. 1990;22:2501. [PubMed] |
| 13. | Farmer DG, McDiarmid SV, Yersiz H, Cortina G, Amersi F, Vargas J, Gershman G, Ament M, Busuttil RW. Outcome after intestinal transplantation: results from one center's 9-year experience; discussion 1031-1032. Arch Surg. 2001;136:1027-1031. [PubMed] |
| 14. | Abu-Elmagd K, Bond G. The current status and future outlook of intestinal transplantation. Minerva Chir. 2002;57:543-560. [PubMed] |
| 15. | Grant D, Abu-Elmagd K, Reyes J, Tzakis A, Langnas A, Fishbein T, Goulet O, Farmer D. 2003 report of the intestine transplant registry: a new era has dawned. Ann Surg. 2005;241:607-613. [PubMed] |
| 16. | Ruiz P, Bagni A, Brown R, Cortina G, Harpaz N, Magid MS, Reyes J. Histological criteria for the identification of acute cellular rejection in human small bowel allografts: results of the pathology workshop at the VIII International Small Bowel Transplant Symposium. Transplant Proc. 2004;36:335-337. [PubMed] |
| 17. | Pomfret EA, Fryer JP, Sima CS, Lake JR, Merion RM. Liver and intestine transplantation in the United States, 1996-2005. Am J Transplant. 2007;7:1376-1389. [PubMed] |
| 18. | Pironi L, Hebuterne X, Van Gossum A, Messing B, Lyszkowska M, Colomb V, Forbes A, Micklewright A, Villares JM, Thul P. Candidates for intestinal transplantation: a multicenter survey in Europe. Am J Gastroenterol. 2006;101:1633-1643. [PubMed] |
| 21. | 李 幼生, 李 宁, 李 元新, 倪 小冬, 朱 亮, 曹 斌, 李 为苏, 罗 开, 黎 介寿. 非整块肝脏和小肠联合移植的外科技术(附一例报告). 中华器官移植杂志. 2005;26:108-110. |
| 22. | Schalamon J, Mayr JM, Hollwarth ME. Mortality and economics in short bowel syndrome. Best Pract Res Clin Gastroenterol. 2003;17:931-942. [PubMed] |
| 23. | Buchman AL. The medical and surgical mana-gement of short bowel syndrome. MedGenMed. 2004;6:12. [PubMed] |
| 24. | Cohen-Solal M, Baudoin C, Joly F, Vahedi K, D'Aoust L, De Vernejoul MC, Messing B. Osteoporosis in patients on long-term home parenteral nutrition: a longitudinal study. J Bone Miner Res. 2003;18:1989-1994. [PubMed] |
| 25. | Horslen S. Organ allocation for liver-intestine candidates. Liver Transpl. 2004;10:S86-89. [PubMed] |
| 26. | 朱 亮, 李 宁, 李 幼生, 李 元新, 李 维勤, 朱 维铭, 刘 放南, 倪 小东, 曹 斌, 李 为苏. 肝肠移植术后的代谢调控治疗. 肠外与肠内营养. 2004;11:143-146. |
| 27. | Selvaggi G, Tzakis AG. Intestinal and multivisceral transplantation: future perspectives. Front Biosci. 2007;12:4742-4754. [PubMed] |
| 28. | Tryphonopoulos P, Weppler D, Levi DM, Nishida S, Madariaga JR, Kato T, Mittal N, Moon J, Selvaggi G, Esquenazi V. Transplantation for the treatment of intra-abdominal fibromatosis. Transplant Proc. 2005;37:1379-1380. [PubMed] |
| 29. | Tzakis AG, Kato T, Levi DM, Defaria W, Selvaggi G, Weppler D, Nishida S, Moon J, Madariaga JR, David AI. 100 multivisceral transplants at a single center. Ann Surg. 2005;242:480-490; discussion 491-493. [PubMed] |
| 30. | Garfia Castillo C. Intestinal transplantation. Rev Esp Enferm Dig. 2006;98:713-722. [PubMed] |
| 31. | Pirenne J, Hoffman I, Miserez M, Coosemans W, Aerts R, Monbaliu D, Ferdinande P, Hiele M, Van Assche G, Rutgeerts P. Selection criteria and outcome of patients referred to intestinal transplantation: an European center experience. Transplant Proc. 2006;38:1671-1672. [PubMed] |
| 32. | Starzl TE, Rowe MI, Todo S, Jaffe R, Tzakis A, Hoffman AL, Esquivel C, Porter KA, Venkataramanan R, Makowka L. Transplantation of multiple abdominal viscera. JAMA. 1989;261:1449-1457. [PubMed] |
| 33. | Grant D, Wall W, Mimeault R, Zhong R, Ghent C, Garcia B, Stiller C, Duff J. Successful small-bowel/liver transplantation. Lancet. 1990;335:181-184. [PubMed] |
| 34. | Carlson GL. Surgical management of intestinal failure. Proc Nutr Soc. 2003;62:711-718. [PubMed] |
| 35. | Di Benedetto F, Lauro A, Masetti M, Cautero N, De Ruvo N, Quintini C, Sassi S, Di Francesco F, Diago Uso T, Romano A. Outcome of isolated small bowel transplantation in adults: experience from a single Italian center. Minerva Chir. 2005;60:1-9. [PubMed] |
| 36. | Matsumoto CS, Fishbein TM. Modified multivisceral transplantation with splenopancreatic preservation. Transplantation. 2007;83:234-236. [PubMed] |
| 37. | Braun F, Platz KP, Faendrich F, Kremer B, Mueller AR. Management of venous access problems before and after intestinal transplantation: case reports. Transplant Proc. 2004;36:392-393. [PubMed] |
| 38. | Berney T, Kato T, Nishida S, Tector AJ, Mittal NK, Madariaga J, Nery JR, Cantwell GP, Ruiz P, Tzakis AG. Portal versus systemic drainage of small bowel allografts: comparative assessment of survival, function, rejection, and bacterial translocation. J Am Coll Surg. 2002;195:804-813. [PubMed] |
| 39. | Kato T, Tzakis AG, Selvaggi G, Gaynor JJ, David AI, Bussotti A, Moon JI, Ueno T, DeFaria W, Santiago S. Intestinal and multivisceral transplantation in children. Ann Surg. 2006;243:756-764; discussion 764-766. [PubMed] |
| 40. | Buchman AL, Scolapio J, Fryer J. AGA technical review on short bowel syndrome and intestinal transplantation. Gastroenterology. 2003;124:1111-1134. [PubMed] |
| 41. | Levi DM, Tzakis AG, Kato T, Madariaga J, Mittal NK, Nery J, Nishida S, Ruiz P. Transplantation of the abdominal wall. Lancet. 2003;361:2173-2176. [PubMed] |
| 42. | Kobayashi S, Kato T, Nishida S, Buttrago E, Maldini G, Mittal N, Thompson J, Tzakis AG. Necrotizing fasciitis following liver and small intestine transplantation. Pediatr Transplant. 2002;6:344-347. [PubMed] |
| 43. | Kato T, Mittal N, Nishida S, Levi D, Yamashiki N, Miller B, Gonzalez M, Ruiz P, Madariaga J, Nery J. The role of intestinal transplantation in the management of babies with extensive gut resections. J Pediatr Surg. 2003;38:145-149. [PubMed] |
| 44. | Kato T, Romero R, Verzaro R, Misiakos E, Khan FA, Pinna AD, Nery JR, Ruiz P, Tzakis AG. Inclusion of entire pancreas in the composite liver and intestinal graft in pediatric intestinal transplantation. Pediatr Transplant. 1999;3:210-214. [PubMed] |
| 45. | Bueno J, Abu-Elmagd K, Mazariegos G, Madariaga J, Fung J, Reyes J. Composite liver--small bowel allografts with preservation of donor duodenum and hepatic biliary system in children. J Pediatr Surg. 2000;35:291-295; discussion 295-296. [PubMed] |
| 46. | Yin ZY, Ni XD, Jiang F, Li N, Li YS, Li JS. Modified technique for combined liver-small bowel transplantation in pigs. World J Gastroenterol. 2003;9:1625-1628. [PubMed] |
| 47. | Sudan DL, Iyer KR, Deroover A, Chinnakotla S, Fox IJ Jr, Shaw BW Jr, Langnas AN. A new technique for combined liver/small intestinal transplantation. Transplantation. 2001;72:1846-1848. [PubMed] |
| 48. | Kato T, Tzakis AG. Noncomposite simultaneous liver and intestinal transplantation. Transplantation. 2004;78:485; author reply 485-486. [PubMed] |
| 49. | Testa G, Holterman M, John E, Kecskes S, Abcarian H, Benedetti E. Combined living donor liver/small bowel transplantation. Transplantation. 2005;79:1401-1404. [PubMed] |
| 50. | Testa G, Panaro F, Schena S, Holterman M, Abcarian H, Benedetti E. Living related small bowel transplantation: donor surgical technique. Ann Surg. 2004;240:779-784. [PubMed] |
| 51. | Benedetti E, Holterman M, Asolati M, Di Domenico S, Oberholzer J, Sankary H, Abcarian H, Testa G. Living related segmental bowel transplantation: from experimental to standardized procedure. Ann Surg. 2006;244:694-699. [PubMed] |
| 52. | Ueno T, Kato T, Gaynor J, Velasco M, Selvaggi G, Nishida S, Moon J, Levi D, Madariaga J, Tzakis A. Renal dysfunction following adult intestinal transplant under tacrolimus-based immun-osuppression. Transplant Proc. 2006;38:1762-1764. [PubMed] |
| 53. | Bond GJ, Mazariegos GV, Sindhi R, Abu-Elmagd KM, Reyes J. Evolutionary experience with immunosuppression in pediatric intestinal transplantation. J Pediatr Surg. 2005;40:274-279; discussion 279-280. [PubMed] |
| 54. | Fishbein TM, Florman S, Gondolesi G, Schiano T, LeLeiko N, Tschernia A, Kaufman S. Intestinal transplantation before and after the introduction of sirolimus. Transplantation. 2002;73:1538-1542. [PubMed] |
| 55. | Sudan DL, Chinnakotla S, Horslen S, Iyer K, Fox I, Shaw B, Langnas AN. Basiliximab decreases the incidence of acute rejection after intestinal transplantation. Transplant Proc. 2002;34:940-941. [PubMed] |
| 56. | Garcia M, Weppler D, Mittal N, Nishida S, Kato T, Tzakis A, Ruiz P. Campath-1H immunosuppressive therapy reduces incidence and intensity of acute rejection in intestinal and multivisceral transplantation. Transplant Proc. 2004;36:323-324. [PubMed] |
| 57. | Kato T, Gaynor JJ, Selvaggi G, Mittal N, Thompson J, McLaughlin GE, Nishida S, Moon J, Levi D, Madariaga J. Intestinal transplantation in children: a summary of clinical outcomes and prognostic factors in 108 patients from a single center. J Gastrointest Surg. 2005;9:75-89; discussion 89. [PubMed] |
| 58. | Wu T, Abu-Elmagd K, Bond G, Nalesnik MA, Randhawa P, Demetris AJ. A schema for histologic grading of small intestine allograft acute rejection. Transplantation. 2003;75:1241-1248. [PubMed] |
| 59. | Ruiz P, Weppler D, Nishida S, Kato T, Selvaggi G, Levi D, Bejarano P, Khaled A, Tryphonopoulos P, Tuteja S. International grading scheme for acute rejection in small bowel transplantation: implementation and experience at the University of Miami. Transplant Proc. 2006;38:1683-1684. [PubMed] |
| 60. | Kato T, Mizutani K, Terasaki P, Quintini C, Selvaggi G, Thompson J, Ruiz P, Tzakis A. Association of emergence of HLA antibody and acute rejection in intestinal transplant recipients: a possible evidence of acute humoral sensitization. Transplant Proc. 2006;38:1735-1737. [PubMed] |
| 61. | Pappas PA, G Tzakis A, Gaynor JJ, Carreno MR, Ruiz P, Huijing F, Kleiner G, Rabier D, Kato T, Levi DM. An analysis of the association between serum citrulline and acute rejection among 26 recipients of intestinal transplant. Am J Transplant. 2004;4:1124-1132. [PubMed] |
| 62. | Pappas PA, Saudubray JM, Tzakis AG, Rabier D, Carreno MR, Gomez-Marin O, Huijing F, Gelman B, Levi DM, Nery JR. Serum citrulline and rejection in small bowel transplantation: a preliminary report. Transplantation. 2001;72:1212-1216. [PubMed] |
| 63. | Pappas PA, Tzakis AG, Saudubray JM, Gaynor JJ, Carreno MR, Huijing F, Kleiner G, Rabier D, Kato T, Levi DM. Trends in serum citrulline and acute rejection among recipients of small bowel transplants. Transplant Proc. 2004;36:345-347. [PubMed] |
| 64. | Beiler HA, Steinorth J, Witt A, Aulmann M, Zachariou Z. Absorption of D(+)-xylose, cobalamin, and folic acid after autologic-allotopic ileum mucosa transplantation in beagles. J Pediatr Surg. 2004;39:1362-1367. [PubMed] |
| 65. | Mueller AR, Pascher A, Platz KP, Braun F, Fandrich F, Rayes N, Seehofer D, Radtke C, Neuhaus P, Kremer B. Immunosuppression following intestinal transplantation. Transplant Proc. 2004;36:325-328. [PubMed] |
| 66. | Pascher A, Radke C, Dignass A, Schulz RJ, Veltzke-Schlieker W, Adler A, Sauer IM, Platz K, Klupp J, Volk HD. Successful infliximab treatment of steroid and OKT3 refractory acute cellular rejection in two patients after intestinal transplantation. Transplantation. 2003;76:615-618. [PubMed] |
| 67. | Green M, Reyes J, Jabbour N, Yunis E, Putnam P, Todo S, Rowe D. Use of quantitative PCR to predict onset of Epstein-Barr viral infection and post-transplant lymphoproliferative disease after intestinal transplantation in children. Transplant Proc. 1996;28:2759-2760. [PubMed] |
| 68. | Ruiz P, Soares MF, Garcia M, Nicolas M, Kato T, Mittal N, Nishida S, Levi D, Selvaggi G, Madariaga J. Lymphoplasmacytic hyperplasia (possibly pre-PTLD) has varied expression and appearance in intestinal transplant recipients receiving Campath immunosuppression. Transplant Proc. 2004;36:386-387. [PubMed] |
| 69. | Oertel SH, Verschuuren E, Reinke P, Zeidler K, Papp-Vary M, Babel N, Trappe RU, Jonas S, Hummel M, Anagnostopoulos I. Effect of anti-CD 20 antibody rituximab in patients with post-transplant lymphoproliferative disorder (PTLD). Am J Transplant. 2005;5:2901-2906. [PubMed] |
| 70. | Berney T, Delis S, Kato T, Nishida S, Mittal NK, Madariaga J, Levi D, Nery JR, Cirocco RE, Gelman B. Successful treatment of posttransplant lymphoproliferative disease with prolonged rituximab treatment in intestinal transplant recipients. Transplantation. 2002;74:1000-1006. [PubMed] |
| 71. | Cicalese L, Sileri P, Green M, Abu-Elmagd K, Kocoshis S, Reyes J. Bacterial translocation in clinical intestinal transplantation. Transplantation. 2001;71:1414-1417. [PubMed] |