修回日期: 2007-10-03
接受日期: 2007-10-28
在线出版日期: 2007-10-18
目的: 探讨环氧化酶-2(COX-2)和血管生成因子(VEGF)在贲门癌组织中的表达及其与肿瘤血管生成的关系.
方法: 免疫组化法检测贲门癌手术切除标本46例和癌旁正常黏膜标本21例中COX-2, VEGF表达. 采用抗CD34抗体标记微血管内皮细胞, 计算微血管密度(MVD). 分析COX-2, VEGF表达与MVD和贲门癌主要临床病理特征的相关性.
结果: 贲门癌组织COX-2, VEGF阳性表达率、 MVD值显著高于癌旁正常黏膜的(80.4% vs 14.3%, χ2 = 26.22, P<0.01; 76.1% vs 19.1%, χ2 = 19.28, P<0.01; 31.95±3.87 vs 16.28±1.55, t = 17.76, P<0.01). COX-2, VEGF表达、MVD值与肿瘤临床TNM分期和淋巴结转移密切相关, TNM分期中Ⅲ+Ⅳ期的贲门癌组织中COX-2, VEGF表达率、MVD值显著高于Ⅰ+Ⅱ期的(90.3% vs 60.0%, χ2 = 5.91, P<0.05; 96.8% vs 46.7%, χ2 = 16.13, P<0.01; 33.43±3.34 vs 28.90±3.08, t = 4.42, P<0.01). 伴有淋巴结转移的贲门癌组织中COX-2, VEGF表达率, MVD值显著高于无淋巴结转移的(94.1% vs 41.7%, χ2 = 15.51, P<0.01; 91.2% vs 50.0%, χ2 = 9.56, P<0.01; 33.53±3.21 vs 27.48±1.03, t = 6.38, P<0.01). Spearman等级相关分析表明, COX-2, VEGF表达与MVD呈显著正相关(r = 0.823; r = 0.892, P<0.01).
结论: COX-2, VEGF异常表达及其诱导的血管生成在贲门癌的侵袭和淋巴结转移中起重要作用.
引文著录: 产松苗, 欧希龙, 孙为豪, 陈国胜, 颜芳. 贲门癌组织环氧化酶-2和血管生成因子的表达及其与血管生成的关系. 世界华人消化杂志 2007; 15(29): 3097-3103
Revised: October 3, 2007
Accepted: October 28, 2007
Published online: October 18, 2007
AIM: To investigate the expression of cycloo-xygenase (COX)-2 and vascular endothelial growth factor (VEGF) in carcinoma of the gastric cardia, and to evaluate the relationship between COX-2, VEGF expression and angiogenesis, and clinicopathological features of carcinoma of the gastric cardia.
METHODS: Forty-six resected tumor specimens were obtained from patients with carcinoma of the gastric cardia, and 21 corresponding paracancerous normal tissues were randomly selected as a control group. Immunohistochemical staining was used for detecting the expression of COX-2 and VEGF. Monoclonal antibody against CD34 was used for visualizing vascular endothelial cells, and microvascular density (MVD) was determined by counting the number of CD34-positive vascular endothelial cells. The correlation between COX-2, VEGF expression and MVD and clinicopathological features of the patients was analyzed.
RESULTS: The positive expression rate for COX-2, VEGF and MVD in the cancerous tissue was 80.4%, 76.1% and 31.95 ± 3.87 respectively, which was significantly higher than that in the controls (14.3%, 19.1% and 16.28 ± 1.55, respectively; P < 0.01). The mean positive expression rate for COX-2, VEGF and MVD was associated with clinical TNM classification (90.3% vs 60.0%, χ2 = 5.91, P < 0.05; 96.8% vs 46.7%, χ2 = 16.13, P < 0.01; 33.43 ± 3.34 vs 28.90 ± 3.08, t = 4.42, P < 0.01) and lymph node metastasis (94. 1% vs 41.7%, χ2 = 15.51, P < 0.01; 91.2% vs 50.0%, χ2 = 9.56, P < 0.01; 33.53 ± 3.21 vs 27.48 ± 1.03, t = 6.38, P < 0.01). The Spearman rank correlation test showed that tumor MVD was closely associated with COX-2 (r = 0.823, P < 0.01) and VEGF (r = 0.892, P < 0.01) expression.
CONCLUSION: Overexpression of COX-2 and VEGF is related to tumor invasion and lymph node metastasis in carcinoma of the gastric cardia. COX-2 contributes to development of carcinoma of the gastric cardia by promoting VEGF expression and angiogenesis.
- Citation: Chan SM, Ou XL, Sun WH, Chen GS, Yan F. Expression of cyclooxygenase-2 and vascular endothelial growth factor in carcinoma of the gastric cardia and its correlation with angiogenesis. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3097-3103
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3097
环氧化酶(cyclooxygenase, COX)是前列腺素合成的限速酶, 已知COX至少有两种亚型, 即COX-1和COX-2. 血管生成是指从已有的毛细血管或毛细血管后静脉发展而成的新生血管的过程. 微血管密度(microvascular density, MVD)是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标[1-2]. 体外研究结果表明, COX-2刺激癌细胞分泌促血管生成因子而诱导血管形成[3]. 然而, 贲门癌组织中COX-2, VEGF的表达和血管生成的关系尚不清楚. 因此, 我们采用免疫组化方法, 检测贲门癌组织和癌旁正常黏膜中COX-2, VEGF的表达, 旨在探讨COX-2, VEGF的表达与贲门癌主要临床病理特征和血管生成的关系.
收集2001-07/2005-07上海梅山医院(南京)及东南大学临床医学院附属中大医院手术切除并经病理证实为贲门癌46例, 男33例, 女13例, 年龄35-74(中位59)岁; 管状腺癌20例, 乳头状腺癌16例, 黏液腺癌5例, 印戒细胞癌5例. 根据国际抗癌联盟(UICC)美国抗癌联合会(AJCC)的TNM分期标准[4]分为: Ⅰ+Ⅱ期15例, Ⅲ+Ⅳ期31例, 有淋巴结转移者34例, 无淋巴结转移12例. 所有患者手术前均无非甾体类抗炎药治疗及化、放疗或其他针对肿瘤的治疗, 且有完整的临床和病理资料. 所有标本均经40 g/L中性甲醛固定24 h后取肿瘤中心部分制成蜡块, 同时收集同期入院手术贲门癌患者癌旁组织21例, 经病理证实为正常贲门黏膜的组织作为对照.
免疫组化染色 采用链霉素-生物素过氧化物酶(SP)染色法, 具体操作步骤按SP免疫组化试剂盒说明书进行. 石蜡包埋的标本层厚4 mm连续切片, 常规脱蜡至水. 切片置10 mmol/L柠檬酸缓冲液(pH6.1)中, 微波加热(95℃, 10 min)修复抗原, 3 mL/L过氧化氢甲醇溶液室温孵育30 min阻断内源性过氧化物酶活性. 一抗为山羊抗人COX-2多克隆抗体(Santa Cruz, 美国, 工作浓度为1:200)或鼠抗人VEGFmAb(Santa Cruz, 美国, 工作浓度为1:100)或鼠抗人CD34 mAb(Neo Markers, 美国, 工作浓度为1:100), 4℃过夜孵育; PBS淋洗3次, 每次5 min, 滴加生物素化二抗, 37℃孵育60 min; PBS淋洗3次, 每次5 min, 滴加链霉素抗生物素-过氧化物酶溶液, 37℃孵育20 min; PBS淋洗3次, 每次5 min, DAB显色. 细胞核用苏木素复染1 min, 中性树脂封片. 用已知COX-2, VEGF表达强阳性的乳腺癌组织切片作为阳性对照, 以PBS替代一抗作阴性对照. COX-2蛋白阳性染色为细胞浆和细胞核中出现棕黄色颗粒, VEGF蛋白阳性染色为肿瘤细胞或血管内皮细胞细胞质中含有棕褐色颗粒, 两者均根据阳性染色细胞百分率和阳性细胞着色强度进行半定量分析, 阳性细胞率≤4%为0分, 5%-29%为1分, 30%-59%为2分, ≥60%为3分. 未着色或染色强度与背景相似者为0分, 着色浅略高于背景色为1分, 中等着色明显高于背景而呈棕黄色为2分, 强染呈深棕黄色者为3分. 根据两项积分将COX-2表达分为4级: 0-1分为阴性(-), 2分为弱阳性(+), 3-4分为中等强度阳性(++), ≥5分者为强阳性(+++). 阳性表达率以表达阳性的病例(包括弱阳性、中等阳性和强阳性之和)占总病例数的百分比表示. 按Weider[5]推荐的方法在低倍镜下(×100)选择癌灶周围间质血管密集区即"热点"(hot spot), 然后在高倍镜下(×400)随机计数5个不同视野内微血管数, 再求其平均值为MVD. 计数时管腔直径≤50 μm者判为微血管, 直径>50 μm或管壁含有肌层者不作为微血管计数, 另外单个染色细胞或成群无管腔的染色细胞也作独立微血管计数.
统计学处理 MVD以mean±SD表示. 计数资料采用χ2检验与秩和检验; 计量资料采用t检验与方差分析; 等级相关性采用Spearman等级相关分析. 所有数据均采用SPSS13.0统计软件进行分析, P<0.05表示差异有显著意义.
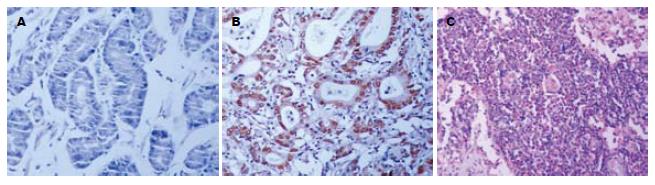
COX-2在正常贲门黏膜中表达微弱(图1A), 阳性表达率为14.3%. 而贲门癌组织中COX-2表达率为80.4%, 其表达率和表达强度均显著高于癌旁正常黏膜(χ2 = 26.22, P<0.01, 表1). 阳性染色主要位于肿瘤细胞的胞质中, 棕黄色颗粒状呈弥漫性分布于整个胞质或沿核膜周边呈线状分布(图1B). 此外, 癌周的炎性细胞、纤维母细胞和血管内皮细胞可见少量COX-2表达, 浸润至淋巴结的癌细胞亦可见阳性染色(图1C). COX-2表达与贲门癌患者的年龄、性别、细胞分化程度、肿瘤的部位及病理形态无关(P>0.05), 而与肿瘤的TNM分期和淋巴结转移密切相关(表2). TNM分期中Ⅲ+Ⅳ期的贲门癌组织中COX-2表达率为90.3%, 显著高于Ⅰ+Ⅱ期的60.0%(χ2 = 5.91, P<0.05). 伴有淋巴结转移的贲门癌组织中COX-2表达率为94.1%, 显著高于无淋巴结转移的41.7%(χ2 = 15.51, P<0.01).
| 临床病理特征 | n | COX-2表达 | VEGF表达 | MVD值 | ||||||||
| - | + | ++ | +++ | 表达率(%) | - | + | ++ | +++ | 表达率(%) | |||
| 年龄(岁) | ||||||||||||
| <60 | 17 | 3 | 3 | 6 | 5 | 82.4 | 4 | 4 | 5 | 4 | 76.5 | 31.59±4.64 |
| ≥60 | 29 | 6 | 7 | 6 | 10 | 79.3 | 5 | 6 | 7 | 11 | 82.8 | 32.17±3.42 |
| 性别 | ||||||||||||
| 男 | 33 | 6 | 8 | 7 | 12 | 81.8 | 7 | 5 | 8 | 13 | 78.8 | 31.64±3.15 |
| 女 | 13 | 3 | 2 | 5 | 3 | 76.9 | 2 | 5 | 4 | 2 | 84.6 | 32.75±5.37 |
| TNM分期 | ||||||||||||
| Ⅰ + Ⅱ | 15 | 6 | 3 | 3 | 3 | 60.0 | 8 | 3 | 2 | 2 | 46.7 | 28.90±3.08 |
| Ⅲ + Ⅳ | 31 | 3 | 7 | 9 | 12 | 90.3b | 1 | 7 | 10 | 13 | 96.8b | 33.43±3.34b |
| 病理类型 | ||||||||||||
| 管状腺癌 | 20 | 4 | 5 | 5 | 6 | 80.0 | 5 | 3 | 6 | 6 | 75.0 | 32.08±3.01 |
| 乳头状腺癌 | 16 | 3 | 2 | 4 | 7 | 81.3 | 2 | 3 | 5 | 6 | 87.5 | 31.16±4.75 |
| 黏液腺癌 | 5 | 1 | 2 | 1 | 1 | 80.0 | 1 | 2 | 0 | 2 | 80.0 | 32.86±3.77 |
| 印戒细胞癌 | 5 | 1 | 1 | 2 | 1 | 80.0 | 1 | 2 | 1 | 1 | 80.0 | 33.10±4.64 |
| 分化程度 | ||||||||||||
| 高、中 | 30 | 6 | 5 | 8 | 11 | 80.0 | 5 | 4 | 9 | 12 | 83.3 | 32.72±3.24 |
| 低 | 16 | 3 | 5 | 4 | 4 | 81.3 | 4 | 6 | 3 | 3 | 75.0 | 30.51±4.62 |
| 淋巴结转移 | ||||||||||||
| 有 | 34 | 2 | 8 | 10 | 14 | 94.1b | 3 | 8 | 10 | 13 | 91.2b | 33.53±3.21b |
| 无 | 12 | 7 | 2 | 2 | 1 | 41.7 | 6 | 2 | 2 | 2 | 50.0 | 27.48±1.03 |
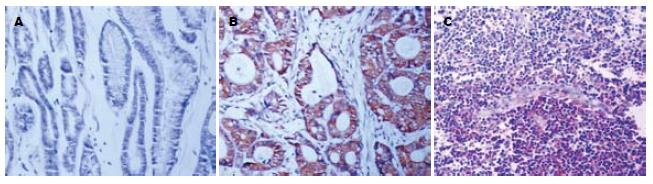
VEGF在正常贲门黏膜中表达微弱(图2A), 阳性表达率为19.1%. 而贲门癌组织中VEGF表达率为76.1%, 其表达率和表达强度均显著高于癌旁正常黏膜(χ2 = 19.28, P<0.01, 表1). VEGF蛋白在肿瘤组织中阳性染色主要见于癌细胞, 成纤维细胞、血管内皮细胞可见少量表达. 其特点是细胞浆内有棕褐色颗粒, 胞核不着色(图2B). 此外, 浸润至淋巴结的癌细胞亦可见阳性染色(图2C). VEGF表达与贲门癌患者的年龄、性别、细胞分化程度、肿瘤的部位及病理形态无关(P>0.05), 而与肿瘤的TNM分期和淋巴结转移密切相关. TNM分期中Ⅲ+Ⅳ期的贲门癌组织中VEGF表达率为96.8%, 显著高于Ⅰ+Ⅱ期的46.7%(χ2 = 16.13, P<0.01). 伴有淋巴结转移的贲门癌组织中VEGF表达率为91.2%, 显著高于无淋巴结转移的50.0%(χ2 = 9.56, P<0.01)(表2).
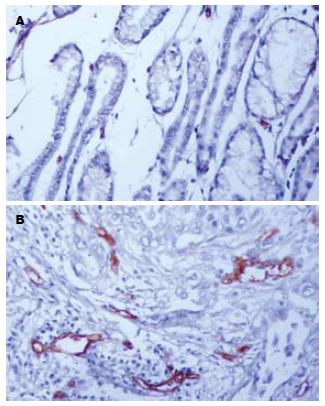
CD34抗体使大部分毛细微血管和单个内皮细胞染色后, 正常贲门黏膜和癌组织中微血管均得到很好的显示(图3). 癌组织中微血管形态不规则, 分布不均, 肿瘤与周围组织交界的浸润缘微血管最密集, 呈棕褐色深染, 逗点状、小管状或条索状, 肌间血管也清晰可辨. 贲门癌组织MVD范围在25.0-41.0之间, 均数为(31.95±3.87), 与正常贲门黏膜(16.28±1.55)相比, 差异有显著性(t = 17.76, P<0.01).MVD与肿瘤的TNM分期和淋巴结转移密切相关(表2), TNM分期中Ⅲ+Ⅳ 期的贲门癌组织中MVD值为33.43±3.34, 显著高于Ⅰ+Ⅱ期的28.90±3.08(t = 4.42, P<0.01). 伴有淋巴结转移的贲门癌组织中MVD为33.53±3.21, 显著高于无淋巴结转移的27.48±1.03(t = 6.38, P<0.01). COX-2表达阴性(-)、弱阳性(+)、中等强度阳性(++)和强阳性(+++)贲门癌标本的MVD分别为(27.36±1.08), (30.01±1.21), (32.28±2.89)和(35.75±2.88). 经方差分析, 组间MVD差异有统计学意义(F = 27.05, P<0.01).经Spearman等级相关分析, COX-2表达与MVD呈显著正相关(r = 0.823, P<0.01). VEGF表达(-)组MVD为27.39±1.02, (+)组为29.56±0.85, (++)组为33.17±1.77, (+++)组为36.21±3.05, 经方差分析, 组间MVD差异有统计学意义(F = 44.652, P<0.01). 经Spearman等级相关分析, VEGF表达与MVD呈显著正相关(r = 0.892, P<0.01).
贲门癌组织中VEGF表达与COX-2表达均为阳性为占所有病例的56.5%, VEGF表达阴性组COX-2的阳性率为72.7%, VEGF表达阳性组COX-2的阳性率为82.9%, COX-2表达阴性组VEGF的阳性率为66.7%, COX-2表达阳性组VEGF的阳性率为78.4%, Spearman等级相关分析显示二者表达强度呈正相关(γ = 0.896, P<0.01)(表3). 联合表达阳性组在淋巴结转移、肿瘤的TNM分期方面与联合表达阴性组相比, 差异有显著性(P<0.01); 在肿瘤的分化程度方面, 两组的P = 0.049. VEGF, COX-2联合表达(+)组MVD为34.26±2.89, 联合表达(-)组MVD为28.02±1.22, 组间MVD差异有统计学意义(F = 6.335, P<0.05).
| VEGF表达 | COX-2表达 | 合计 | |||
| - | + | ++ | +++ | ||
| - | 3 | 2 | 3 | 3 | 11 |
| + | 2 | 2 | 1 | 3 | 8 |
| ++ | 2 | 2 | 3 | 8 | 15 |
| +++ | 2 | 4 | 5 | 1 | 12 |
| 合计 | 9 | 10 | 12 | 15 | 46 |
已知COX-2是前列腺素合成的关键酶, 前列腺素是一类具有多重生物学作用的分子. 近年来研究发现, COX-2除了在炎症中发挥重要作用外, 还与肿瘤发生、发展有关. COX-2在多种肿瘤尤其是消化系统肿瘤组织及相应的肿瘤细胞株中表达上调[6-8].
胃癌是最常见的恶性肿瘤之一, 居消化系统恶性肿瘤首位. 侵袭和转移是恶性肿瘤的主要生物学行为, 也是影响治疗效果和预后的重要因素. 因此, 研究胃癌侵袭和转移的机制并采取有效的措施进行干预, 对防治胃癌降低癌症死亡率具有重要意义. 近年来国外大量研究表明, COX-2在胃癌组织中表达上调[9]. 此外, 多项研究发现, 胃癌癌前病变中存在COX-2过度表达, 支持COX-2过度表达是胃癌发生过程中的早期事件[10]. 最近Chen et al[11]研究发现, 胃癌组织中COX-2表达同肿瘤的血管生成、肿瘤的分期以及病人的生存期有关. 我们的研究发现, 贲门癌中COX-2的阳性表达率高达80.4%, 且贲门癌伴有淋巴结转移者COX-2表达率显著高于无淋巴结转移者, 浸润至淋巴结的肿瘤细胞亦可见染色阳性, 且COX-2过度表达与TNM分期密切相关, 推测COX-2参与胃癌浸润和淋巴结转移, 这与文献[12-13]报道一致. 动物实验发现, COX-2表达增加前列腺素E2(PGE2)的合成, PGE2可诱导细胞增殖并刺激Bcl-2蛋白表达, 后者可抑制细胞凋亡, 使细胞增殖和凋亡失去平衡而促进肿瘤的发生[14]. 我们的研究还发现, 贲门癌中VEGF的阳性表达率高于正常黏膜, 且与淋巴结转移和肿瘤的TNM分期密切相关. Spearman等级相关分析表明, COX-2表达和VEGF之间呈显著正相关, 提示COX-2在促进肿瘤的发生发展过程中可能是通过表达VEGF而实现的. Zhang et al[15]也认为COX-2促进淋巴结转移是通过高表达血管内皮生长因子-C(VEGF-C)的途径介导的. 肿瘤细胞分泌多种蛋白酶降解细胞外基质, 是肿瘤侵袭和转移的首要步骤和分子基础. COX-2的过度表达直接上调使细胞外基质降解的基质金属蛋白酶-9(MMP-9)而降解细胞外基质, 促进肿瘤的侵袭和转移, 在肿瘤转移中发挥重要的作用[12,16].
实体肿瘤的生长分为无血管的缓慢生长阶段和有血管的快速增殖阶段, 如果没有血管生成, 原发肿瘤的生长不会超过1-2 mm3. 恶性肿瘤的生长、浸润和转移必须依赖肿瘤血管生成, MVD是反映恶性肿瘤侵袭和转移等生物学行为的一个重要指标. CD34是存在于血管内皮细胞上的一种抗原, 其分子已被纯化和克隆, 是一种不同于Ⅷ因子相关抗原的蛋白质. 用CD34进行免疫组化染色来显示血管内皮细胞比Ⅷ因子相关抗原更加敏感, 特异性也更强[17]. 近年来国内外有关MVD与肿瘤浸润、转移及预后关系的研究逐渐增多, 内容涉及多系统肿瘤, 结果进一步证实MVD与多数实体性肿瘤侵袭、转移有关[18-19]. MVD可作为肿瘤转移和预后判定的独立指标[18]. 多项研究表明, MVD在早期胃癌中的评估意义较大[20]. Ichinoe et al[21]发现, MVD在早期胃癌凹陷型中表达升高, 而在浅表型中表达低. 我们的研究结果显示, 贲门癌组织中MVD和VEGF的表达显著高于正常贲门黏膜, 贲门癌组织中MVD, VEGF与肿瘤的TNM分期和淋巴结转移密切相关. 此外, MVD随COX-2表达增强而增加. Spearman等级相关分析表明, COX-2表达和MVD呈显著正相关, 与文献报道结果一致[22]. 因此, COX-2过度表达不但促进细胞增殖、抑制细胞凋亡、降解细胞外基质, 而且可能通过介导高表达VEGF途径而促进肿瘤新生血管形成的机制, 参与贲门癌的发生和发展过程.
近年来研究表明, COX-2的高表达同胃癌患者的预后及生存期成负相关[23-25], 而且特异性COX-2抑制剂如JTE-522[26], celecoxib[27], rofecoxib[28], SC236[29], L-748706[30], NS-398[31]等在胃癌的化学预防作用方面的研究逐渐增多并取得了一定的成果. 因此, 我们的研究也可为特异性COX-2抑制剂的治疗作用提供一些理论依据.
近年来, COX-2, VEGF与肿瘤的关系日益受到人们的重视, 肿瘤血管形成方面的研究也比较热门. COX-2, VEGF在胃癌发生、发展及预后中的作用研究较多, 本文旨在探讨COX-2, VEGF表达与贲门癌主要临床病理特征和血管生成的关系.
最近Chen et al研究发现, 胃癌组织中COX-2表达同肿瘤的血管生成、肿瘤的分期以及患者的生存期有关.Ichinoe et al发现, MVD在早期胃癌凹陷型中表达升高, 而在浅表型中表达低.Zhang et al也认为, COX-2促进淋巴结转移是通过高表达血管内皮生长因子-C(VEGF-C)的途径介导的.
本文发现COX-2, VEGF表达与贲门癌TNM分期和淋巴结转移密切相关, 并且COX-2表达和VEGF之间呈显著正相关, 提示COX-2可能是通过介导高表达VEGF途径而促进肿瘤新生血管形成的机制, 参与贲门癌的发生和发展过程.
COX-2, VEGF异常表达及其诱导的血管生成在贲门癌的侵袭和淋巴结转移中起重要作用, 为研究特异性COX-2抑制剂在贲门癌预防和治疗中的作用提供理论依据.
1 环氧化酶: 是花生四烯酸合成前列腺素的限速酶.目前已知COX至少有两种, 即 COX-1和COX-2. COX-2是一种诱导酶, 他参与合成的PGs与炎症、细胞增殖等病理生理作用有关. 近年来COX-2与肿瘤的关系日益受到人们的重视.
2 血管生成: 是指从已有的毛细血管或毛细血管后静脉发展而成的新生血管. 血管生成因子家族有6个成员, 即VEGF-A(通常所称的VEGF), VEGF-B, VEGF-C, VEGF-D, VEGF-E和placenta growth factor, VEGF-C, VEGF-D在胃癌组织中的表达率比较高.
本文选题较好, 设计合理, 方法科学, 对临床研究具有很强的指导意义.
编辑: 李军亮 电编:马文华
| 1. | Neri D, Bicknell R. Tumour vascular targeting. Nat Rev Cancer. 2005;5:436-446. [PubMed] |
| 2. | Folkman J, Browder T, Palmblad J. Angiogenesis research: guidelines for translation to clinical application. Thromb Haemost. 2001;86:23-33. [PubMed] |
| 3. | Leung WK, To KF, Go MY, Chan KK, Chan FK, Ng EK, Chung SC, Sung JJ. Cyclooxygenase-2 upregulates vascular endothelial growth factor expression and angiogenesis in human gastric carcinoma. Int J Oncol. 2003;23:1317-1322. [PubMed] |
| 4. | Sobin LH, Fleming ID. TNM Classification of Malignant Tumors, fifth edition (1997). Union Internationale Contre le Cancer and the American Joint Committee on Cancer. Cancer. 1997;80:1803-1804. [PubMed] |
| 5. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] |
| 6. | van Rees BP, Saukkonen K, Ristimaki A, Polkowski W, Tytgat GN, Drillenburg P, Offerhaus GJ. Cyclooxygenase-2 expression during carcinogenesis in the human stomach. J Pathol. 2002;196:171-179. [PubMed] |
| 8. | 产 松苗, 欧 希龙, 孙 为豪, 陈 国胜, 颜 芳, 邵 耘, 许 海尘, 薛 绮萍. 食管癌组织环氧化酶-2的表达与血管生成的关系. 世界华人消化杂志. 2006;14:1388-1393. [DOI] |
| 9. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] |
| 10. | Konturek PC, Rembiasz K, Konturek SJ, Stachura J, Bielanski W, Galuschka K, Karcz D, Hahn EG. Gene expression of ornithine decarboxylase, cyclooxygenase-2, and gastrin in atrophic gastric mucosa infected with Helicobacter pylori before and after eradication therapy. Dig Dis Sci. 2003;48:36-46. [PubMed] |
| 11. | Chen CN, Hsieh FJ, Cheng YM, Chang KJ, Lee PH. Expression of inducible nitric oxide synthase and cyclooxygenase-2 in angiogenesis and clinical outcome of human gastric cancer. J Surg Oncol. 2006;94:226-233. [PubMed] |
| 12. | Sun WH, Sun YL, Fang RN, Shao Y, Xu HC, Xue QP, Ding GX, Cheng YL. Expression of cyclooxygenase-2 and matrix metalloproteinase-9 in gastric carcinoma and its correlation with angiogenesis. Jpn J Clin Oncol. 2005;35:707-713. [PubMed] |
| 13. | Xue YW, Zhang QF, Zhu ZB, Wang Q, Fu SB. Expression of cyclooxygenase-2 and clinicopathologic features in human gastric adeno-carcinoma. World J Gastroenterol. 2003;9:250-253. [PubMed] |
| 14. | Fosslien E. Molecular pathology of cyclooxygenase-2 in neoplasia. Ann Clin Lab Sci. 2000;30:3-21. [PubMed] |
| 15. | Zhang J, Ji J, Yuan F, Zhu L, Yan C, Yu YY, Liu BY, Zhu ZG, Lin YZ. Cyclooxygenase-2 expression is associated with VEGF-C and lymph node metastases in gastric cancer patients. Biomed Pharmacother. 2005;59 Suppl 2:S285-288. [PubMed] |
| 16. | Dicken BJ, Graham K, Hamilton SM, Andrews S, Lai R, Listgarten J, Jhangri GS, Saunders LD, Damaraju S, Cass C. Lymphovascular invasion is associated with poor survival in gastric cancer: an application of gene-expression and tissue array techniques. Ann Surg. 2006;243:64-73. [PubMed] |
| 17. | Anthony PP, Ramani P. Endothelial markers in malignant vascular tumours of the liver: superiority of QB-END/10 over von Willebrand factor and Ulex europaeus agglutinin 1. J Clin Pathol. 1991;44:29-32. [PubMed] |
| 18. | Goddard JC, Sutton CD, Furness PN, O'Byrne KJ, Kockelbergh RC. Microvessel density at presentation predicts subsequent muscle invasion in superficial bladder cancer. Clin Cancer Res. 2003;9:2583-2586. [PubMed] |
| 19. | Sun WH, Sun YL, Fang RN, Ou XL, Xue QP, Shao Y, Xu HC, Cheng YL. Relationship between cyclooxygenase- 2 expression and angiogenesis in patients with gastric cancer. Zhonghua Weichang Waike Zazhi. 2005;8:343-347. [PubMed] |
| 20. | Erenoglu C, Akin ML, Uluutku H, Tezcan L, Yildirim S, Batkin A. Angiogenesis predicts poor prognosis in gastric carcinoma. Dig Surg. 2000;17:581-586. [PubMed] |
| 21. | Ichinoe M, Mikami T, Shiraishi H, Okayasu I. High microvascular density is correlated with high VEGF, iNOS and COX-2 expression in penetrating growth-type early gastric carcinomas. Histopathology. 2004;45:612-618. [PubMed] |
| 22. | Joo YE, Rew JS, Seo YH, Choi SK, Kim YJ, Park CS, Kim SJ. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer. J Clin Gastroenterol. 2003;37:28-33. [PubMed] |
| 23. | Mrena J, Wiksten JP, Nordling S, Kokkola A, Ristimaki A, Haglund C. MMP-2 but not MMP-9 associated with COX-2 and survival in gastric cancer. J Clin Pathol. 2006;59:618-623. [PubMed] |
| 24. | Mrena J, Wiksten JP, Thiel A, Kokkola A, Pohjola L, Lundin J, Nordling S, Ristimaki A, Haglund C. Cyclooxygenase-2 is an independent prognostic factor in gastric cancer and its expression is regulated by the messenger RNA stability factor HuR. Clin Cancer Res. 2005;11:7362-7368. [PubMed] |
| 25. | Honjo S, Kase S, Osaki M, Ardyanto TD, Kaibara N, Ito H. COX-2 correlates with F-box protein, Skp2 expression and prognosis in human gastric carcinoma. Int J Oncol. 2005;26:353-360. [PubMed] |
| 26. | Yashiro M, Nakazawa K, Tendo M, Kosaka K, Shinto O, Hirakawa K. Selective cyclooxygenase-2 inhibitor downregulates the paracrine epithelial-mesenchymal interactions of growth in scirrhous gastric carcinoma. Int J Cancer. 2007;120:686-693. [PubMed] |
| 27. | Huang MT, Chen ZX, Wei B, Zhang B, Wang CH, Huang MH, Tang CW. The inhibitive effects of celecoxib combined with octreotide on the metastasis of human gastric cancer in vivo. Zhonghua Yixue Zazhi. 2006;86:3255-3259. [PubMed] |
| 28. | Fei SJ, Xiao SD, Peng YS, Chen XY, Shi Y. Chemopreventive effects of rofecoxib and folic acid on gastric carcinogenesis induced by N-methyl-N'-nitro-N-nitrosoguanidine in rats. Chin J Dig Dis. 2006;7:134-140. [PubMed] |
| 29. | Fan XM, Jiang XH, Gu Q, Ching YP, He H, Xia HH, Lin MC, Chan AO, Yuen MF, Kung HF. Inhibition of Akt/PKB by a COX-2 inhibitor induces apoptosis in gastric cancer cells. Digestion. 2006;73:75-83. [PubMed] |
| 30. | Stoner GD, Qin H, Chen T, Carlton PS, Rose ME, Aziz RM, Dixit R. The effects of L-748706, a selective cyclooxygenase-2 inhibitor, on N-nitroso-methylbenzylamine-induced rat esophageal tumorigenesis. Carcinogenesis. 2005;26:1590-1595. [PubMed] |
| 31. | Honjo S, Osaki M, Ardyanto TD, Hiramatsu T, Maeta N, Ito H. COX-2 inhibitor, NS398, enhances Fas-mediated apoptosis via modulation of the PTEN-Akt pathway in human gastric carcinoma cell lines. DNA Cell Biol. 2005;24:141-147. [PubMed] |