修回日期: 2007-09-30
接受日期: 2007-09-28
在线出版日期: 2007-10-08
目的: 探讨leptin在急性炎症反应中的作用.
方法: 采集正常大鼠下丘脑、肺、肝、脾、胃、十二指肠、肾、附睾脂肪垫、睾丸等重要脏器标本, 以RT-PCR法检测leptin mRNA表达的组织分布; 并建立大鼠盲肠结扎穿孔模型, 设立假手术组(A)和脂肪乳组(B)、单纯损伤组(C)、雌二醇组(D)、胰岛素组(E)等实验组, 采用RT-PCR检测脂肪、肝及肺内leptin mRNA表达的变化.
结果: 正常大鼠的上述9种重要脏器内均有leptin mRNA表达, 肾脏内含量最高而睾丸内含量最低. 大鼠盲肠结扎穿孔12 h后, 与A组leptin mRNA表达水平相比, 其在B组脂肪内表达显著增高而在肝、肺内表达显著降低, 在C组肝内表达无显著差异而在脂肪、肺内表达显著降低, 在D组肺内表达显著增高而在脂肪、肝内表达显著降低, 在E组肺内表达无显著差异而在脂肪、肝内表达显著降低. 脂肪乳对leptin mRNA表达的影响具有中枢分泌组织(脂肪)内诱导而外周脏器内抑制的双向模式.
结论: Leptin mRNA表达水平在干预急性肠道损伤后能量代谢和神经-内分泌功能时发生敏感变化, 提示leptin可能作为一种核心保护因子促进内环境的稳定.
引文著录: 林季, 颜光涛, 高晓宁, 廖杰, 王录焕, 郝秀华. Leptin mRNA表达的组织分布及在大鼠急性肠道损伤中的变化. 世界华人消化杂志 2007; 15(28): 2995-3000
Revised: September 30, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
AIM: To explore the role that leptin plays in acute inflammation.
METHODS: Vital organ samples, including hypothalamus, lung, liver, spleen, stomach, duodenum, kidney, epididymal fat pad and testis, were collected from normal rats, and the levels of leptin mRNA expression in those samples were determined by reverse transcriptase-polymerase chain reaction (PCR). A cecal ligation and perforation model was established in rats. The rats were divided into sham-operation (A), intralipid injection (B), injury (C), estradiol injection (D) and insulin injection (E) groups to assess energy metabolism and neuroendocrine function. Reverse transcriptase-PCR was also used to detect leptin mRNA expression in adipose tissue, liver and lung.
RESULTS: Leptin mRNA expressions were confirmed in all nine vital organs examined, with the highest seen in kidney and the lowest levels seen in testis. By twelve hours after cecal ligation and perforation, compared with the level of leptin mRNA expression in the sham-operation group, that in the intralipid injection group was increased significantly in adipose tissue but decreased significantly in liver and lung; that in the injury group showed no difference in liver but was decreased significantly in adipose tissue and lung; that in the estradiol group was increased significantly in lung but decreased significantly in adipose tissue and liver; and that in the insulin group showed no difference in lung but was decreased significantly in adipose tissue and liver. The effect of intralipid injection on leptin mRNA expression was found to be a dual-direction pattern, as intralipid injection induced leptin mRNA expression in central secretory tissue (adipose tissue), but inhibited it in peripheral organs.
CONCLUSION: Leptin mRNA expression shows a sensitive change when intervening energy metabolism and neuroendocrine function after acute intestinal injury, which suggests that leptin may be a key protective factor promoting homeostasis.
- Citation: Lin J, Yan GT, Gao XN, Liao J, Wang LH, Hao XH. Tissue distribution of leptin mRNA expression and its variation in acute intestinal injury in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 2995-3000
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/2995.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.2995
瘦素(leptin)是一种由ob基因表达, 含167个氨基酸, 分子质量为16 kDa的活性因子, 通过下丘脑内的特异受体而发挥抑制摄食、促进能量消耗的主要作用[1-3]. 自1994年成功克隆leptin以来, 大量事实已证明他参与能量代谢、神经-内分泌、血管新生及生殖的调控[4-6]. 此外, leptin能够加速糖和脂肪的氧化以提供足量ATP代偿细胞损伤, 并增强特异及非特异免疫系统功能和促进内皮细胞的增殖[7-9], 提示leptin可能参与创伤后内环境稳乱的恢复过程, 但是目前国内外尚无定论, 而且未见leptin mRNA表达组织分布的报道. 我们假设leptin mRNA广泛表达并在急性肠道损伤时发生一定的变化, 而且这种变化与其发挥保护效应相关. 我们通过采集正常大鼠的重要脏器样本, 以逆转录-PCR法检测leptin mRNA表达的组织分布; 并建立大鼠盲肠结扎穿孔(CLP)模型, 观察损伤时leptin mRNA表达的变化, 探讨干预急性肠道损伤后能量代谢和神经-内分泌功能对leptin基因表达水平的影响.
实验用清洁级♂SD大鼠60只, 体质量250 g, 由解放军总医院实验动物中心提供. β-雌二醇购自Sigma®公司; 胰岛素注射剂购自Novo Nordisk®公司; AMV逆转录酶、Oligo(dT)15购自Promega®公司; 脂肪乳注射液购自华瑞®制药; TRIzol, Taq DNA聚合酶及β-actin引物购自北京鼎国®公司; Leptin引物由上海生工®公司合成; 其他试剂均为国产分析纯级. 取10只大鼠按10 g/L戊巴比妥钠60 mg/kg ip麻醉, 无菌条件下迅速取出其下丘脑、肺、肝、脾、胃、十二指肠、肾、左侧附睾体部脂肪垫(属白色脂肪组织)、睾丸等重要脏器, 立即投入液氮速冻, 然后转移到-80℃冻存.
大鼠随机分成5组, 每组10只. 第1组设为假手术组, 第2组为脂肪乳组(2 mL, ip), 第3组为单纯损伤组, 第4组为雌二醇组[12.5 mg/L(2 mL), ip], 第5组为胰岛素组[0.5 U(2 mL), sc], 雌二醇、胰岛素以生理盐水配制. 实验前12 h禁食、不限水, 实验时按10 g/L戊巴比妥钠60 mg/kg ip麻醉, 无菌条件下开腹, 分离盲肠末端以3-0号丝线结扎, 再用5号针头随机穿孔2处, 将盲肠放回腹腔后逐层关腹[10-11]. 假手术组于分离盲肠末端时, 不进行结扎、穿孔. 假手术组与单纯损伤组于术后关腹时, 2 mL生理盐水注射; 其他3组则注射上述剂量的药物. CLP后12 h于麻醉条件下迅速取出大鼠左侧附睾体部脂肪垫、肝及肺组织, 立即投入液氮速冻, 然后转存于-80℃. 采用TRIzol试剂提取组织样品的总RNA, 操作步骤按说明书进行. 提取总RNA后, 以三蒸水为空白对照, 测量样品260 nm处的紫外吸光度A值并计算总RNA浓度.
逆转录体系(20 μL)包括: 总RNA 2.5 μg, AMV逆转录酶667 nkat, Oligo(dT)15 1 μg, 5×逆转录缓冲液4 μL, 10 mmol/L dNTPs 2 μL, RNA酶抑制剂20 U及焦碳酸二乙酯处理的水6.5 μL. 将逆转录样品置于37℃水浴2 h, 然后95℃水浴5 min灭活AMV酶, 快速冰镇后按4℃, 10 000 g离心5 min, 保存cDNA样品于-20℃.
PCR反应以β-actin的mRNA表达作为cDNA合成及PCR反应的内源性参照. Leptin和β-actin PCR体系(50 μL)包括: cDNA 4 μL, 25 μmol/L上游及下游引物1 μL, 10 mmol/L dNTPs 4 μL, Taq酶33 nkat, 10×PCR缓冲液(含20 mmol/L MgCl2)5 μL及灭菌去离子水34 μL. PCR所用的引物序列及反应条件如表1所示. 于15 g/L琼脂糖凝胶(含0.5 mg/L溴乙啡啶)电泳检测PCR产物, 并用Gel-Pro®凝胶分析仪拍摄和分析电泳图像.
| 引物名 | 核酸序列及PCR反应条件 | 产物大小 | GenBank编号 |
| leptin | 上游引物: 5'-CCTGTGGCTTTGGTCCTATCGG-3' | 290 bp | RATOBESE |
| 下游引物: 5'-CTGCTCAAAGTCACCACCTCGG-3' | |||
| 变性: 94℃ 45 s, 退火: 60℃ 45 s, 延伸: 72℃ 60 s, 循环: 35 | |||
| β-actin | 上游引物: 5'-CATCTCTTGCTCGAAGTCCA-3' | 318 bp | BC063166 |
| 下游引物: 5'-ATCATGTTTGAGACCTTCAACA-3' | |||
| 变性: 94℃ 45 s, 退火: 55℃ 45 s, 延伸: 72℃ 45 s, 循环: 30 |
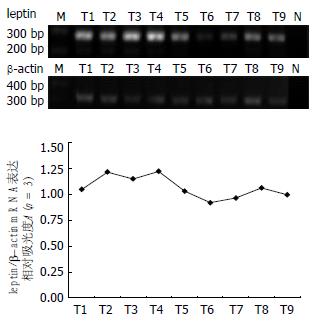
正常♂大鼠的下丘脑、肺、肝、脾、胃、十二指肠、肾、附睾脂肪垫、睾丸等重要脏器组织均有leptin mRNA表达, 但是表达量不同, 以肾脏内含量为最高, 而睾丸内含量最低. 该结果表明, leptin mRNA不仅仅存在于脂肪组织, 还广泛存在于机体中枢神经系统和外周重要脏器(图1).
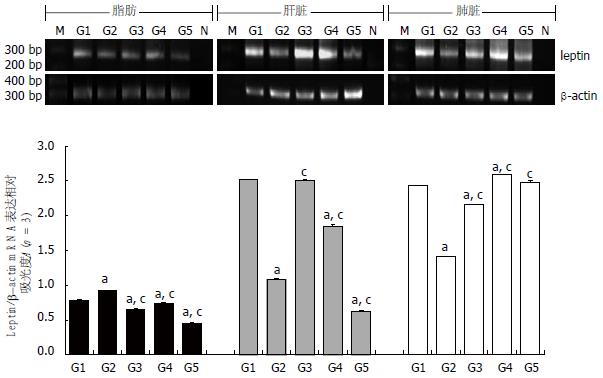
在脂肪组织中, 与损伤后假手术组相比, 脂肪乳组leptin mRNA表达显著增高(t = 0.1384, P<0.001), 其他3组均显著降低, 而且按雌二醇组、单纯损伤组和胰岛素组依次递减(t = -0.0526, -0.1292, -0.332, P<0.001). 在肝组织中, 与损伤后假手术组相比, 单纯损伤组leptin mRNA表达无显著差异(t = -0.0277, P = 0.067), 其他3组均显著降低, 而且按雌二醇组, 脂肪乳组和胰岛素组依次递减(t = -0.6826, -1.4506, -1.9057, P<0.001). 与脂肪乳组相比, 单纯损伤组和雌二醇组leptin mRNA表达显著增高(t = 1.4229, 0.76 792, P<0.001), 而胰岛素组显著降低(t = -0.4551, P<0.001). 在肺组织中, 与损伤后假手术组相比, 胰岛素组leptin mRNA表达无显著差异(t = 0.0363, P = 0.125), 雌二醇组显著增高(t = 0.1549, P<0.001), 脂肪乳组和单纯损伤组均显著降低(t = -1.0191, -0.2725, 均P<0.001). 与脂肪乳组相比, 其他3个药物组leptin mRNA表达均显著升高, 而且按单纯损伤组, 胰岛素组和雌二醇组依次递增(t = 0.7466, 1.0554, 1.1741, P<0.001), 如图2.
Leptin是一种主要由哺乳动物脂肪细胞分泌的中分子活性蛋白, 不同物种间的同源性高达80%[12-13]. 由于急性炎症反应诱发机体的高代谢状态, 而leptin是调控代谢的重要因子, 因此他在炎症反应后的内环境失调中发挥特殊作用, 成为联系能量代谢、免疫调控和神经-内分泌3大功能系统的枢纽. leptin要发挥这些重要的功能, 必然要通过与其特异性受体结合. leptin受体(OB-R)属于Ⅰ型细胞因子受体家族, 包含6种亚型(OB-Ra, b, c, d, e及f), 主要通过Janus激酶-酪氨酸激酶途径转导信号[14-16]. 除了皮下、心旁、肾周、肠系膜4种脂肪组织以外, 还发现OB-R存在于肝、脾、肠系膜淋巴结、小肠、肾上腺皮质、肾、主动脉等外周脏器和下丘脑、垂体、大脑皮质、小脑皮质、松果体等中枢神经组织[17-19]. 根据OB-R的广泛存在, 我们推测leptin基因也应该在各组织内有表达. 但目前国内外仅见leptin mRNA表达于胰腺、胃、结肠、角质和内皮细胞的零散报道[20-22], 未有其详细组织分布的论述.
我们选择了中枢神经系统(下丘脑)、呼吸系统(肺)、消化系统实质器官(肝)、消化系统空腔器官(胃和十二指肠)、血液系统(脾)、泌尿系统(肾)、内分泌系统(附睾脂肪垫)和生殖系统(睾丸)等脏器系统内具有代表性的器官, 进行leptin mRNA组织分布的考察. 结果发现, leptin mRNA并非只存在于脂肪细胞内, 他在上述其他8种重要脏器内均有表达, 只是表达量有所不同. Leptin mRNA在肾、胃、肺和下丘脑内表达丰度不亚于脂肪细胞, 提示leptin在应激时能通过外周脏器和中枢神经系统的协调作用来代偿其表达水平的变化, 因为肾、胃、肺是机体维持电解质、水和CO2代谢平衡的最重要脏器, 而下丘脑是神经-内分泌调控网络的高端脏器. 我们前期已证实, 肠缺血/再灌注损伤后, leptin对机体发挥迟缓而持续的保护效应[1,23]. 既然leptin mRNA在上述多种重要组织内有表达, 而且leptin是联系能量代谢、免疫调控和神经-内分泌3大功能系统的枢纽, 我们推测干预急性炎症反应后的能量代谢和神经-内分泌功能可能会对leptin mRNA表达产生一定的影响, 其表达水平的增高可能与改善内环境紊乱有关. CLP是一种经典的创伤、感染模型, 能够引发动物盲肠出血、坏死及大量内毒素和氧自由基进入血循环, 同时激活单核-巨噬细胞、中性粒细胞及交感神经系统, 导致严重的系统性炎症反应和能量代谢障碍[24-26]. 我们采用脂肪乳、胰岛素及雌二醇等干预能量代谢和下丘脑-垂体轴功能的药物, 来探讨leptin在创伤炎症反应中的作用在国内外尚属首次, 对于揭示leptin在急性肠道损伤后恢复内环境稳定中的确切作用有重要的意义.
各组leptin mRNA在脂肪、肝、肺内表达的水平不一, 其原因我们考虑有以下几点: (1)脂肪乳注射后体内脂肪酸含量升高, 增加了机体的能量储备. 而leptin的主要作用是促进能量消耗, 此时能量储备的增加就会反馈诱导leptin表达水平的升高. 与假手术组相比, 脂肪乳组leptin mRNA在脂肪内表达水平的显著升高, 以及在肺和肝内表达水平的显著降低, 提示脂肪乳主要通过诱导leptin的中枢分泌器官-脂肪组织来表达更多的leptin, 以代偿CLP对外周脏器leptin表达的抑制; (2)急性腹腔内感染发生后早期, 机体处于一种类似于饥饿的高代谢状态, 会通过神经-内分泌调节抑制leptin的释放[27], 导致单纯损伤组leptin表达被抑制. 与假手术组相比, 单纯损伤组leptin mRNA在脂肪和肺内显著降低, 在肝内虽无显著差异但已接近显著降低的边界(P = 0.067), 提示CLP后12 h leptin基因表达被显著抑制, 可能是损伤后高代谢状态及自由基对leptin表达的破坏所致; (3)与假手术组相比, 雌二醇组leptin mRNA在脂肪和肝内显著降低, 可能是由于外源性雌二醇反馈抑制下丘脑-垂体-性腺轴, 使下丘脑-垂体-肾上腺皮质轴功能也受到抑制, 导致糖皮质激素刺激脂肪细胞分泌leptin的作用[4]减弱. 雌二醇组leptin mRNA在肺内的显著增高, 目前尚无明确机制可解释其原因, 我们推测与雌二醇扩张气道平滑肌、加速肺通气而改善损伤后的肺组织酸中毒有关, 因为酸中毒会抑制leptin的表达[28]; (4)与假手术组相比, 胰岛素组leptin mRNA在脂肪和肝内表达显著降低, 提示由于胰岛素降低血糖水平, 导致机体能量储备减低, 反馈抑制leptin的表达以减少能量消耗. 胰岛素组leptin mRNA之所以在肺内表达无显著差异, 可能是由于胰岛素刺激肺内NO释放而扩张气道平滑肌和血管内皮细胞[29], 改善损伤后肺组织酸中毒而恢复leptin mRNA的表达.
以往的研究发现, 脂肪乳能减轻再灌注后静脉内皮细胞的损伤[30]和烧伤患者血浆白蛋白的消耗[31], 我们预期脂肪乳应用于CLP大鼠会增高leptin mRNA的表达. 结果与预期不尽相同, 脂肪乳注射后仅脂肪内leptin mRNA表达增高, 外周器官(肝和肺)内的表达量均低于单纯损伤组和雌二醇组. 我们认为脂肪乳对leptin mRNA的作用存在中枢分泌组织内诱导和外周脏器内抑制的双向模式, 即在急性损伤应激状态下, 首先诱导中枢分泌组织(脂肪)表达更多的leptin, 以外分泌方式输送至各脏器; 在外周脏器内, 其自身表达leptin mRNA受到脂肪分泌信号增高的负反馈以及高代谢状态的双重抑制, 所以脂肪乳引发的能量储备升高时无法诱导外周器官的leptin基因表达. 与胰岛素组相比, 脂肪乳毕竟是增高能量储备, 而且肝脏又是代谢最旺盛的器官, 因此脂肪乳组在肝内leptin mRNA的表达高于胰岛素组; 另一方面, 由于前述的胰岛素能改善损伤后肺组织酸中毒程度, 因此脂肪乳组在肺内leptin mRNA的表达低于胰岛素组.
总之, leptin是一种广泛表达于机体多种重要脏器的活性蛋白, 他对于急性肠道损伤引发的能量代谢紊乱和神经-内分泌失调有敏感的应答性, 在脂肪组织和外周脏器内leptin基因表达模式的双向性提示他可能作为一种保护因子促进机体内环境的稳定. 若能充分利用以leptin为核心的代谢、免疫及神经-内分泌网络进行内源性和外源性的干预, 对于开拓早期、便捷地救治消化系统脏器创伤、感染等危重症患者的新技术有积极的意义.
薛辉、张凯和卢荷丹老师对本研究的技术操作给予了支持.
研究表明瘦素(leptin)参与能量代谢、神经-内分泌、血管新生、生殖、免疫应答等的调节, 能够促进细胞损伤的修复, 有助于内环境紊乱的恢复. 探讨 leptin表达的组织分布及在急性肠道损伤中的变化,为利用以leptin为核心的代谢、免疫及神经-内分泌网络进行损伤后干预提供了理论依据.
自从发现leptin存在于胰腺、胃、结肠、角质和内皮细胞以来, 国内外尚未见leptin mRNA表达组织分布的详细报道.同时, 由于leptin可能参与创伤后内环境紊乱的恢复过程,研究 leptin mRNA表达在急性肠道损伤时重要脏器内的变化, 成为证明这种变化是否与 leptin发挥保护效应相关的一个主要环节.
目前认为leptin受体包含6 种亚型(OB-Ra, b, c, d, e及f), 广泛存在于脂肪、肝、脾、肠系膜淋巴结、小肠、肾上腺皮质、肾、主动脉等外周脏器和下丘脑、垂体、大脑皮质、小脑皮质、松果体等中枢神经组织, 提示leptin有对应的广泛表达. 前期研究也证实leptin在损伤后发挥迟缓而持续的保护效应.
本文研究发现 leptin是一种广泛表达于机体多种重要脏器的活性蛋白, 他对于急性肠道损伤引发的能量代谢紊乱和神经-内分泌失调有敏感的应答性.在脂肪组织和外周脏器内leptin基因表达具有双向性的模式, 提示他可能作为一种保护因子促进机体内环境的稳定.
本文探讨了leptinmRNA表达的组织分布及其在急性肠道损伤中的变化, 为充分利用以leptin为核心的调控网络进行损伤后的内源性和外源性干预, 开拓早期、便捷地救治消化系统脏器创伤、感染等危重症患者的新技术有积极的意义.
瘦素(leptin): 也称为消脂素, 是一种由ob基因表达的16 kDa蛋白激素,分为脂肪型和血清型. 他通过与特异性受体结合, 活化Janus激酶/信号传导及转录活化子、丝裂原活化的蛋白激酶和磷脂酰肌醇-3-激酶通路等主要信号途径, 参与能量代谢、体质量平衡、神经-内分泌、创伤修复等多种功能的调控.
本文内容新颖, 设计合理, 讨论客观, 对基础研究和临床研究有一定的参考意义.
编辑: 程剑侠 电编:郭海丽
| 1. | Lin J, Yan GT, Hao XH, Wang LH, Zhang K, Xue H. Effect of intestinal ischemia-reperfusion injury on protein levels of leptin and orexin-A in peripheral blood and central secretory tissues. World J Gastroenterol. 2005;11:1000-1004. [PubMed] |
| 2. | Krol E, Speakman JR. Regulation of body mass and adiposity in the field vole, Microtus agrestis: a model of leptin resistance. J Endocrinol. 2007;192:271-278. [PubMed] |
| 3. | Buyukberber M, Koruk M, Savas MC, Gulsen MT, Pehlivan Y, Deveci R, Sevinc A, Gergerlioglu S. Leptin levels in the differential diagnosis between benign and malignant ascites. World J Gastroenterol. 2007;13:398-402. [PubMed] |
| 4. | Fruhbeck G. Intracellular signalling pathways activated by leptin. Biochem J. 2006;393:7-20. [PubMed] |
| 5. | Rolland YM, Perry HM 3rd, Patrick P, Banks WA, Morley JE. Leptin and adiponectin levels in middle-aged postmenopausal women: associations with lifestyle habits, hormones, and inflammatory markers--a cross-sectional study. Metabolism. 2006;55:1630-1636. [PubMed] |
| 6. | Hausman GJ, Richardson RL. Adipose tissue angiogenesis. J Anim Sci. 2004;82:925-934. [PubMed] |
| 7. | Waelput W, Brouckaert P, Broekaert D, Tavernier J. A role for leptin in the systemic inflammatory response syndrome (SIRS) and in immune response, an update. Curr Med Chem. 2006;13:465-475. [PubMed] |
| 8. | De Rosa V, Procaccini C, Cali G, Pirozzi G, Fontana S, Zappacosta S, La Cava A, Matarese G. A key role of leptin in the control of regulatory T cell proliferation. Immunity. 2007;26:241-255. [PubMed] |
| 9. | Rahmouni K, Haynes WG. Endothelial effects of leptin: implications in health and diseases. Curr Diab Rep. 2005;5:260-266. [PubMed] |
| 10. | Madorin WS, Rui T, Sugimoto N, Handa O, Cepinskas G, Kvietys PR. Cardiac myocytes activated by septic plasma promote neutrophil transendothelial migration: role of platelet-activating factor and the chemokines LIX and KC. Circ Res. 2004;94:944-951. [PubMed] |
| 11. | Qin HL, Shen TY, Gao ZG, Fan XB, Hang XM, Jiang YQ, Zhang HZ. Effect of lactobacillus on the gut microflora and barrier function of the rats with abdominal infection. World J Gastroenterol. 2005;11:2591-2596. [PubMed] |
| 12. | Lin J, Yan GT, Xue H, Hao XH, Zhang K, Wang LH. Leptin protects vital organ functions after sepsis through recovering tissue myeloperoxidase activity: an anti-inflammatory role resonating with indomethacin. Peptides. 2007;28:1553-1560. [PubMed] |
| 13. | Harvey J. Leptin: a diverse regulator of neuronal function. J Neurochem. 2007;100:307-313. [PubMed] |
| 14. | Myers MG Jr. Leptin receptor signaling and the regulation of mammalian physiology. Recent Prog Horm Res. 2004;59:287-304. [PubMed] |
| 15. | Munzberg H, Bjornholm M, Bates SH, Myers MG Jr. Leptin receptor action and mechanisms of leptin resistance. Cell Mol Li. fe Sci. 2005;62:642-652. [PubMed] |
| 16. | Stefanou N, Satra M, Papanikolaou V, Kalala F, Gatselis N, Germenis A, Dalekos GN, Tsezou A. Leptin receptor isoforms mRNA expression in peripheral blood mononuclear cells from patients with chronic viral hepatitis. Exp Biol Med (Maywood. 2006;231:1653-1663. [PubMed] |
| 17. | Chelikani PK, Glimm DR, Kennelly JJ. Short communication: Tissue distribution of leptin and leptin receptor mRNA in the bovine. J Dairy Sci. 2003;86:2369-2372. [PubMed] |
| 18. | Gallardo N, Arribas C, Villar M, Ros M, Carrascosa JM, Martinez C, Andres A. ObRa and ObRe are differentially expressed in adipose tissue in aged food-restricted rats: effects on circulating soluble leptin receptor levels. Endocrinology. 2005;146:4934-4942. [PubMed] |
| 19. | Sayed-Ahmed A, Kulcsar M, Rudas P, Bartha T. Expression and localisation of leptin and leptin receptor in the mammary gland of the dry and lactating non-pregnant cow. Acta Vet Hung. 2004;52:97-111. [PubMed] |
| 20. | Buyse M, Aparicio T, Guilmeau S, Goiot H, Sobhani I, Bado A. Paracrine actions of the stomach-derived leptin. Med Sci (Paris). 2004;20:183-188. [PubMed] |
| 21. | Sitaraman S, Liu X, Charrier L, Gu LH, Ziegler TR, Gewirtz A, Merlin D. Colonic leptin: source of a novel proinflammatory cytokine involved in IBD. FASEB J. 2004;18:696-698. [PubMed] |
| 22. | Murad A, Nath AK, Cha ST, Demir E, Flores-Riveros J, Sierra-Honigmann MR. Leptin is an autocrine/paracrine regulator of wound healing. FASEB J. 2003;17:1895-1897. [PubMed] |
| 23. | Lin J, Yan GT, Wang LH, Hao XH, Zhang K, Xue H. Leptin fluctuates in intestinal ischemia-reperfusion injury as inflammatory cytokine. Peptides. 2004;25:2187-2193. [PubMed] |
| 24. | Shen TY, Qin HL, Gao ZG, Fan XB, Hang XM, Jiang YQ. Influences of enteral nutrition combined with probiotics on gut microflora and barrier function of rats with abdominal infection. World J Gastroenterol. 2006;12:4352-4358. [PubMed] |
| 25. | Song XM, Li JG, Wang YL, Zhou Q, Du ZH, Jia BH, Ke JJ. Effects of ketamine on proinflammatory cytokines and nuclear factor kappaB in polymicrobial sepsis rats. World J Gastroenterol. 2006;12:7350-7354. [PubMed] |
| 26. | Shang HF, Hsu CS, Yeh CL, Pai MH, Yeh SL. Effects of arginine supplementation on splenocyte cytokine mRNA expression in rats with gut-derived sepsis. World J Gastroenterol. 2005;11:7091-7096. [PubMed] |
| 27. | Faggioni R, Moser A, Feingold KR, Grunfeld C. Reduced leptin levels in starvation increase susceptibility to endotoxic shock. Am J Pathol. 2000;156:1781-1787. [PubMed] |
| 28. | Teta D, Bevington A, Brown J, Pawluczyk I, Harris K, Walls J. Acidosis downregulates leptin production from cultured adipocytes through a glucose transport-dependent post-transcriptional mechanism. J Am Soc Nephrol. 2003;14:2248-2254. [PubMed] |
| 29. | Boulbou M, Gourgoulianis K, Molyvdas PA. Insulin effect on lung diffusion: NO pathway. Am J Respir Crit Care Med. 2003;168:398; author reply 398-399. [PubMed] |
| 30. | Fujiwara T, Kawarasaki H, Fonkalsrud EW. Reduction of postinfusion venous endothelial injury with intralipid. Surg Gynecol Obstet. 1984;158:57-65. [PubMed] |
| 31. | Rong XZ, Zhang T, Li QH, Yang RH, Hua R, Huang XH. Effect of intralipid for ameliorating protein loss in severe burned patients. Nan Fang Yi Ke Da Xue Xue Bao. 2006;26:500-501. [PubMed] |