修回日期: 2007-09-24
接受日期: 2007-09-28
在线出版日期: 2007-10-08
目的: 观察人参皂苷Rh2(G-Rh2)诱导小鼠前胃癌MFC细胞的凋亡, 探讨Ca2+在G-Rh2诱导细胞凋亡中的作用, 揭示G-Rh2诱导MFC细胞凋亡的分子机制.
方法: 分别对无血清培养24 h后的MFC正常细胞组、G-Rh2(3、10、30 mg/L)给药组、Ca2+螯合剂BAPTA(20 μmol)+G-Rh2(10 mg/L)给药组及BAPTA(20 μmol)组, 荧光显微镜(Hoechst 33 258)观察细胞形态学改变; 流式细胞仪Annexin V-FITC双染法检测细胞早期凋亡率; 琼脂糖凝胶电泳法观察细胞晚期凋亡; 共聚焦显微镜分析G-Rh2给药后细胞内钙和细胞线粒体膜电位, Western blot分析caspase 3的表达.
结果: 10 mg/L的G-Rh2能显著抑制无血清培养的MFC细胞增殖和诱导MFC细胞凋亡, 可剂量和时间依赖性的提高细胞内钙浓度, 降低细胞线粒体膜电位, 增加caspase 3的表达, 但这些作用均可被BAPTA(20 μmol)抑制.
结论: G-Rh2可激活细胞内Ca2+信号转导途径, 从而最终通过线粒体凋亡途径诱导胃癌细胞凋亡.
引文著录: 吴歌, 杨世杰. 人参皂苷单体Rh2诱导小鼠前胃癌细胞系凋亡的分子机制. 世界华人消化杂志 2007; 15(28): 2972-2976
Revised: September 24, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
AIM: To investigate the effect of Ginseng (G) -Rh2 on the proliferation and apoptosis of mouse gastric carcinoma cells (MFCs), and to explore the activation of the Ca2+ transduction pathways mediating G-Rh2-induced MFC cell apoptosis.
METHODS: MFCs were divided into a normal free-serum MFC cell group, a G-Rh2 (3, 10, 30 mg/L) treatment group, a Ca2+ chelator BAPTA (20 μmol) + G-Rh2 (10 mg/L) group and a BAPTA (20 μmol) group. Morphologic changes were observed by fluorescence microscopy (Hoechst 33 258). The early apoptosis rate was detected by Annexin V-FITC using flow cytometry; late apoptosis was analyzed by agarose gel electrophoresis. The mitochondrial membrane potential (ΔΨm) and Ca2+ density were measured by confocal microscopy. The expression of caspase 3 was observed by Western blotting.
RESULTS: G-Rh2 (10 mg/L) reinforced cell activity and induced apoptosis of MFC cells. The apoptosis rate in the drug group increased greatly after G-Rh2 treatment. G-Rh2 induced MFC cell apoptosis, markedly enhance calcium ion concentration, effectively reduced ΔΨm and increased the protein expression of caspase 3, but all of these effects could be inhibited by BAPTA (20 μmol).
CONCLUSION: G-Rh2 can induce apoptosis of gastric carcinoma cells, possibly via a Ca2+ - dependent mitochondrial apoptosis pathway.
- Citation: Wu G, Yang SJ. Molecular mechanism of G-Rh2-induced apoptosis in gastric carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 2972-2976
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/2972.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.2972
人参皂苷单体Rh2(ginsenoside Rh2)是从人参中分离出的原人参二醇型低糖链皂苷单体, 多项研究证实, G-Rh2可以通过诱导细胞调亡或分化有效地抑制多种肿瘤细胞[1-7]的增殖活性, 而目前尚无其对胃癌增殖抑制的研究报道. 目前已揭示的参与G-Rh2诱导凋亡的信号分子包括JNK[8]、Cdk2[9], PKCδ[10]等, 然而G-Rh2上调这些蛋白酶活性的分子机制仍不明晰. 2006年, Ham et al[11]首次发现G-Rh2可使HeLa细胞线粒体的Ca2+升高, 随之产生大量ROS, 进而激活JNK途径, 并最终通过线粒体凋亡通路诱导MFC细胞凋亡. 本研究以小鼠前胃癌MFC细胞为受试细胞, 探讨G-Rh2在诱导胃癌细胞凋亡过程中Ca2+信号转导途径的激活及下游线粒体凋亡通路活化的分子机制.
G-Rh2由吉林大学分析化学教研室提供, IMDM培养基购自美国Gibco公司, 新生小牛血清购自杭州四季清生物有限公司, Hoechst 33258购自凯基生物, Annexin V-FITC试剂盒购自晶美生物工程有限公司, 动物细胞凋亡DNA Ladder提取试剂盒购自北京鼎国生物公司, Rhodamine123购自Sigma公司, Fluo-3, AM购自Molecular Probes公司, caspase 3购自天津灏阳, BAPTA购自北京海德生物.
MFC细胞由本室冻存, 常复苏后, 培养和维持在体积分数为100 mL/L新生小牛血清IMDM培养液里, 置CO2培养箱(37℃, 50 mL/L CO2)培养, 取对数生长期细胞经24 h无血清培养后, 分组进行实验.
1.2.1 分组及细胞处理: 对数生长期的MFC细胞经24 h无血清培养后, 将密度为1.0×109/L的MFC细胞分为: 空白对照组、G-Rh2各组(3、10、30 mg/L), 检测早期细胞凋亡率和晚期细胞凋亡率; 将MFC细胞分为: 空白组、G-Rh2(10 mg/L)组、G-Rh2(10 mg/L)+BAPTA(20 μmol)组、BAPTA(20 μmol)组, 检测细胞核形态, 线粒体膜电位, 细胞内钙各项实验指标.
1.2.2 流式细胞仪分析: 收获细胞, 用4℃预冷的PBS洗两次, 用250 μL结合缓冲液重新悬浮细胞, 调节其浓度为1×109/L, 取100 μL细胞悬液于5 mL流式管中, 加入5 μL Annexin V-FITC(150 mg/L)和10 μL碘化丙锭(120 mg/L), 混匀后室温避光孵育15 min, 在反应管中加400 μL PBS, 流式细胞仪(FACS)分析细胞凋亡率.
1.2.3 琼脂糖凝胶电泳检测晚期细胞凋亡: 药物处理24 h后, 收集细胞, 按动物细胞凋亡DNA Ladder提取试剂盒要求提取DNA, 每个泳道上样量为10 μL, 用20 g/L琼脂糖凝胶电泳, 电压为4 V/cm, 经EB染色后, 凝胶成像系统下观察和照相.
1.2.4 细胞形态学观察: 细胞经药物处理12 h后, 在同一视觉域内用Hoechst 33258(10 mg/L)进行核染色, 然后在荧光显微镜(Leica Microsystems Wetzlar GmbH, Germany)下观察细胞核形态并记录.
1.2.5 共聚焦显微镜测定线粒体膜电位和细胞内钙: 线粒体膜电位[12-13]: 收集细胞, 加入0.026 mmol/L的Rhodamine123染液200 μL, 37℃避光孵育10 min, 用PBS洗3次后, 每孔选4个视野, 每个视野观察50个细胞, 以平均荧光强度变化反映细胞线粒体膜电位的相对水平, 荧光探针Rhodamine123进入细胞, 其激发的荧光强度与细胞内线粒体膜电位成正比, 所得荧光强度以软件处理即得激光共聚焦显微镜检测线粒体膜电位. 细胞内钙: 收集细胞, 加入10 μmol/L的Fluo-3, AM负载液200 μL, 37℃避光孵育40 min,用Hepe液洗涤3次后, 每孔选4个视野, 每个视野观察50个细胞, 以平均荧光强度变化反映细胞内游离钙浓度的相对水平. 荧光探针Fluo-3/AM进入细胞, 其激发的荧光强度与细胞内游离钙离子的浓度成正比, 所得荧光强度以软件处理即得激光共聚焦显微镜检测细胞内钙浓度.
1.2.6 Western blotting分析caspase 3在细胞中的表达: 具体方法见分子克隆实验指南[14].
统计学处理 采用image-protein plus统计软件进行处理. 组间比较采用t检验, 结果采用mean±SD表示.
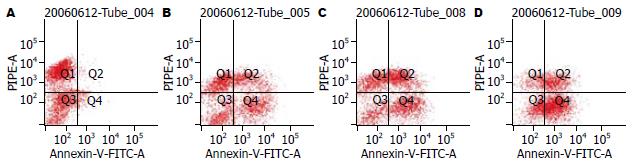
流式细胞仪分析可见, 与对照组相比G-Rh2各给药组, MFC细胞凋亡率分别为24%、29.7%和43%, 与对照组凋亡率1.9%相比显著增加, 且呈明显的剂量依赖性, 而各组间坏死率无明显差异(P>0.05, 图1).
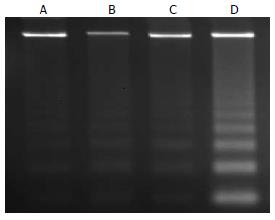
MFC细胞在加入G-Rh2(10 mg/L)4、6、12 h后, 凝胶电泳显示了180-200 bp或其多聚体组成的寡核苷酸片断的出现, 和空白对照组比较, DNA Ladder现象显著, 且呈明显的剂量依赖性, 但12 h组弥散现象明显, 提示此时G-Rh2对MFC的增殖抑制以诱导细胞坏死为主(图2).
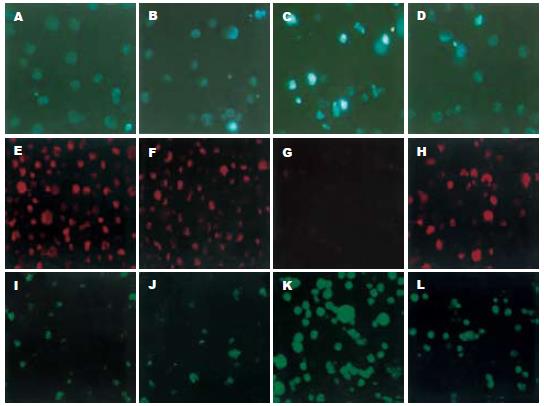
经Hoechst 33258染色后, 荧光显微镜下可观察到G-Rh2(10 mg/L)组胞核内出现浓染致密的颗粒块状荧光, 显示出胞核固缩、染色质高度凝聚和碎裂, 而对照组、BAPTA(20 μmol)组、BAPTA(20 μmol)+G-Rh2(10 mg/L)组胞核呈弥散均匀的荧光(图3).
共聚焦显微镜结果显示, G-Rh2给药30 min后Rhodamine123标记的MFC细胞荧光强度为120.08±10.32, 与对照组360.08±27.12相比显著降低(P<0.01), 表明G-Rh2处理后MFC细胞ΔΨm明显下降, 而BAPTA(20 μmol)组、BAPTA(20 μmol)+G-Rh2组荧光强度分别为353.32±18.28和310.08±29.20, 与对照组无显著性差异(P>0.05, 图3).
共聚焦显微镜结果显示, G-Rh2给药30 min后Fluo-3/AM标记的MFC细胞荧光强度为455.94±42.48, 与对照组110.25±10.69相比显著升高(P<0.01), 而BAPTA(20 μmol)组、BAPTA(20 μmol)+G-Rh2组荧光强度分别为110.03±10.74及160.08±15.24, 与对照组无显著性差异(P>0.05, 图3).
3的影响 Western blotting结果显示, G-Rh2作用后, caspase 3从30 min开始表达, 于2 h出现高峰, 其后降为基础水平, 而BAPTA(20 μmol)+G-Rh2组caspase 3没有激活(图4).
现代药理学研究表明人参皂苷单体Rh2具有较强的抗肿瘤作用, 而目前尚无其对胃癌增殖抑制的研究报道. 本实验通过流式细胞术检测早期凋亡和DNA凝胶电泳图检测晚期凋亡等途径首次证明, G-Rh2可诱导小鼠前胃癌MFC细胞发生典型凋亡从而有效地抑制胃癌细胞的增殖.
ΔΨm的崩解是细胞凋亡的早期特异性指标之一[15], 当细胞受到某些生理性或病理性刺激(如放射线、化学药物、氧化剂、钙超载、神经鞘鞍醇等)后, 线粒体外膜通透性增加, 内膜电化学梯度降低, 线粒体膜通道转换孔(PT孔)开放[16], 导致线粒体内外膜依次裂解释放出caspase激活蛋白等一系列变化, 使细胞进入不可逆的凋亡过程[17-19]. 本实验观察到10 mg/L G-Rh2用药30 min后MFC细胞的ΔΨm开始下降, 同时凋亡前蛋白caspase 3开始活化, 预示MFC细胞进入了不可逆凋亡过程.
肿瘤的增殖、侵袭、转移是一个复杂的过程, 肿瘤细胞针对细胞外刺激产生的应答通过信号转导过程来调节, 进而影响细胞的生命活动[20-23]. 在众多凋亡刺激因子中, Ca2+作为细胞内生命信号途径的重要成员, 其稳态失调是造成线粒体机能紊乱的主要机制之一[24], 已有大量实验证实Ca2+作为细胞凋亡的早期信号, 在细胞凋亡前有持续显著增高[15,25-26], 而如果使用钙螯合剂或阻断剂来减低细胞内Ca2+浓度, 则可有效抑制或延迟细胞凋亡的进程[27-29]. 为进一步揭示G-Rh2诱导MFC凋亡过程中可能启动的早期信号, 我们对细胞内游离钙进行了测定, 发现10 mg/L G-Rh2用药30 min后MFC细胞的细胞内Ca2+开始升高, 提示G-Rh2用药后MFC细胞的内钙水平和线粒体膜电位下降之间存在明显的协同性, 且均可被细胞内钙抑制剂BAPTA显著抑制.
本实验揭示G-Rh2在凋亡早期通过影响MFC细胞跨膜转导钙离子、膜离子通道的通透性等作用使线粒体内Ca2+升高, 导致钙超载和钙稳态的破坏, 致线粒体PT孔开放后, 激活Ca2+依赖磷脂酶、Ca2+依赖蛋白酶和Ca2+依赖核酸内切酶等多种凋亡相关蛋白酶的活性, 最终通过线粒体凋亡通路诱导细胞发生凋亡, 这可能是G-Rh2诱导胃癌细胞凋亡的机制之一. 而Ca2+超载具体导致哪些相关蛋白酶的活化及相应信号通路的开启尚有待于进一步的研究.
G-Rh2可以通过诱导细胞调亡或分化有效地抑制包括前列腺癌、黑 色素瘤、肝癌、宫颈癌等多种肿瘤细胞的增殖活性, 而目前尚无其对胃癌增殖抑制的研究报道.
2006年, Ham et al首次发现G-Rh2可使HeLa细胞线粒体的Ca2+升高, 随之产生大量ROS, 进而激活JNK途径, 并最终通过线粒体凋亡通路诱导MFC细胞凋亡.
在众多凋亡刺激因子中, Ca2+作为细胞内生命信号途径的重要成员,其稳态失调是造成线粒体机能紊乱的主要机制之一, G-Rh2诱导肿瘤细胞凋亡的研究对于钙在信号转导和凋亡中的作用研究甚少, 本研究较系统的对其进行了研究和报道.
本文首次证明, G-Rh2可诱导小鼠前胃癌MFC细胞发生典型凋亡从而有效地抑制胃癌细胞的增殖, 为临床应用中药治疗胃癌提供了一些有意义的实验基础.
本文选题较新颖, 行文流畅, 研究内容较丰富, 使用的研究方法恰当, 结果结论可信, 客观性强, 参考文献较新.
编辑: 程剑侠 电编:何基才
| 1. | Tatsuka M, Maeda M, Ota T. Anticarcinogenic effect and enhancement of metastatic potential of BALB/c 3T3 cells by ginsenoside Rh(2). Jpn J Cancer Res. 2001;92:1184-1189. [PubMed] |
| 2. | Fei XF, Wang BX, Tashiro S, Li TJ, Ma JS, Ikejima T. Apoptotic effects of ginsenoside Rh2 on human malignant melanoma A375-S2 cells. Acta Pharmacol Sin. 2002;23:315-322. [PubMed] |
| 3. | Popovich DG, Kitts DD. Ginsenosides 20(S)-protopanaxadiol and Rh2 reduce cell proliferation and increase sub-G1 cells in two cultured intestinal cell lines, Int-407 and Caco-2. Can J Physiol Pharmacol. 2004;82:183-190. [PubMed] |
| 4. | Yim H, Jin YH, Park BD, Choi HJ, Lee SK. Caspase-3-mediated cleavage of Cdc6 induces nuclear localization of p49-truncated Cdc6 and apoptosis. Mol Biol Cell. 2003;14:4250-4259. [PubMed] |
| 5. | Oh JI, Chun KH, Joo SH, Oh YT, Lee SK. Caspase-3-dependent protein kinase C delta activity is required for the progression of Ginsenoside-Rh2-induced apoptosis in SK-HEP-1 cells. Cancer Lett. 2005;230:228-238. [PubMed] |
| 6. | Cheng CC, Yang SM, Huang CY, Chen JC, Chang WM, Hsu SL. Molecular mechanisms of ginsenoside Rh2-mediated G1 growth arrest and apoptosis in human lung adenocarcinoma A549 cells. Cancer Chemother Pharmacol. 2005;55:531-540. [PubMed] |
| 7. | Kim YS, Jin SH. Ginsenoside Rh2 induces apoptosis via activation of caspase-1 and -3 and up-regulation of Bax in human neuroblastoma. Arch Pharm Res. 2004;27:834-839. [PubMed] |
| 8. | Jin YH, Yoo KJ, Lee YH, Lee SK. Caspase 3-mediated cleavage of p21WAF1/CIP1 associated with the cyclin A-cyclin-dependent kinase 2 complex is a prerequisite for apoptosis in SK-HEP-1 cells. J Biol Chem. 2000;275:30256-30263. [PubMed] |
| 9. | Kim YS, Jin SH, Lee YH, Park JD, Kim SI. Differential expression of protein kinase C subtypes during ginsenoside Rh2-lnduced apoptosis in SK-N-BE(2) and C6Bu-1 cells. Arch Pharm Res. 2000;23:518-524. [PubMed] |
| 10. | Ham YM, Chun KH, Choi JS, Kim DH, Lee SK. SEK1-dependent JNK1 activation prolongs cell survival during G-Rh2-induced apoptosis. Biochem Biophys Res Commun. 2003;304:358-364. [PubMed] |
| 11. | Ham YM, Lim JH, Na HK, Choi JS, Park BD, Yim H, Lee SK. Ginsenoside-Rh2-induced mitochondrial depolarization and apoptosis are associated with reactive oxygen species- and Ca2+-mediated c-Jun NH2-terminal kinase 1 activation in HeLa cells. J Pharmacol Exp Ther. 2006;319:1276-1285. [PubMed] |
| 12. | Huang M, Camara AK, Stowe DF, Qi F, Beard DA. Mitochondrial inner membrane electrophysiology assessed by rhodamine-123 transport and fluorescence. Ann Biomed Eng. 2007;35:1276-1285. [PubMed] |
| 13. | Kai L, Wang ZF, Shi YL, Liu LM, Hu DY. Opioid receptor antagonists increase [Ca2+]i in rat arterial smooth muscle cells in hemorrhagic shock. Acta Pharmacol Sin. 2004;25:395-400. [PubMed] |
| 15. | Sareen D, Darjatmoko SR, Albert DM, Polans AS. Mitochondria, Calcium, and Calpain are Key Mediators of Resveratrol-Induced Apoptosis in Breast Cancer. Mol Pharmacol. 2007;. [PubMed] |
| 16. | Grimm S, Brdiczka D. The permeability transition pore in cell death. Apoptosis. 2007;12:841-855. [PubMed] |
| 17. | Javadov S, Karmazyn M. Mitochondrial per-meability transition pore opening as an endpoint to initiate cell death and as a putative target for cardioprotection. Cell Physiol Biochem. 2007;20:1-22. [PubMed] |
| 18. | Scatena R, Bottoni P, Botta G, Martorana GE, Giardina B. The role of mitochondria in pharmacotoxicology: a reevaluation of an old, newly emerging topic. Am J Physiol Cell Physiol. 2007;293:C12-21. [PubMed] |
| 19. | Hacker G, Paschen SA. Therapeutic targets in the mitochondrial apoptotic pathway. Expert Opin Ther Targets. 2007;11:515-526. [PubMed] |
| 20. | Li SS. Signal transduction pathways and esophageal carcinoma. Zhonghua Bing Li Xue Za Zhi. 2007;36:366-369. [PubMed] |
| 21. | Hursting SD, Lashinger LM, Colbert LH, Rogers CJ, Wheatley KW, Nunez NP, Mahabir S, Barrett JC, Forman MR, Perkin SN. Energy balance and carcinogenesis: underlying pathways and targets for intervention. Curr Cancer Drug Targets. 2007;7:484-491. [PubMed] |
| 22. | Davis CD, Milner JA. Molecular targets for nutritional preemption of cancer. Curr Cancer Drug Targets. 2007;7:410-415. [PubMed] |
| 23. | Hagland H, Nikolaisen J, Hodneland LI, Gjertsen BT, Bruserud O, Tronstad KJ. Targeting mitochondria in the treatment of human cancer: a coordinated attack against cancer cell energy metabolism and signalling. Expert Opin Ther Targets. 2007;11:1055-1069. [PubMed] |
| 24. | Giacomello M, Drago I, Pizzo P, Pozzan T. Mi-tochondrial Ca2+ as a key regulator of cell life and death. Cell Death Differ. 2007;14:1267-1274. [PubMed] |
| 25. | Jozwiak Z, Marczak A. The role of ion channels in apoptosis. Postepy Biochem. 2006;52:373-382. [PubMed] |
| 26. | Mizobuchi M, Ogata H, Hatamura I, Saji F, Koiwa F, Kinugasa E, Koshikawa S, Akizawa T. Activation of calcium-sensing receptor accelerates apoptosis in hyperplastic parathyroid cells. Biochem Biophys Res Commun. 2007;362:11-16. [PubMed] |
| 27. | Mu D, Zhang W, Chu D, Liu T, Xie Y, Fu E, Jin F. The role of calcium, P38 MAPK in dihydroar-temisinin-induced apoptosis of lung cancer PC-14 cells. Cancer Chemother Pharmacol. 2007;. [PubMed] |
| 28. | Masuda Y, Aiuchi T, Mihara S, Nakajo S, Nakaya K. Increase in intracellular Ca(2+) concentrations and the corresponding intracellular acidification are early steps for induction of apoptosis by geranylgeraniol in HL60 cells. Biol Pharm Bull. 2007;30:880-884. [PubMed] |
| 29. | Ip SW, Weng YS, Lin SY, Mei-Dueyang , Tang NY, Su CC, Chung JG. The role of Ca+2 on rhein-induced apoptosis in human cervical cancer Ca Ski cells. Anticancer Res. 2007;27:379-389. [PubMed] |