修回日期: 2007-09-08
接受日期: 2007-09-28
在线出版日期: 2007-10-08
转化生长因子β1(TGFβ1)自1972年发现以来, 相关研究取得了长足进展, 其基因染色体定位、基因结构、表达、蛋白结构、受体结合、信号传导、生物学效应等均基本明确. 本文介绍了TGFβ1的结构和功能, 特别是他在肝纤维化中的独特作用的同时, 重点讨论TGFβ1基因单核苷酸多态性(SNP)对其功能的影响及其在疾病中的意义及前景, 以进一步了解该多肽类生长因子在以肝病为代表的多种疾病中的病理意义及潜在的诊断、干预治疗前景.
引文著录: 高春芳. TGFβ1基因变异与疾病相关性研究展望. 世界华人消化杂志 2007; 15(28): 2959-2965
Revised: September 8, 2007
Accepted: September 28, 2007
Published online: October 8, 2007
Since the description of transforming growth factor (TGF) β1 became known in 1972, much progress has been achieved in its genetic location, gene structure and expression, protein structure, receptor binding, and signal transduction, as well as its biological effects. Here we introduce the structure and function of TGFβ1, with an emphasis on its special effects on liver fibrosis. Single nucleotide polymorphisms of the TGFβ1 gene and its effects on disease development and prediction are also discussed to reveal the pathogenesis of this polypeptide growth factor and its potential in disease diagnosis and intervention.
- Citation: Gao CF. Progress of research on the correlation between transforming growth factor β1 gene mutation and disease. Shijie Huaren Xiaohua Zazhi 2007; 15(28): 2959-2965
- URL: https://www.wjgnet.com/1009-3079/full/v15/i28/2959.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i28.2959
转化生长因子β1(TGFβ1)自1972年发现以来, 共相关研究取得了长足进展, 其基因染色体定位、基因结构、表达、蛋白结构、受体结合、信号传导、生物学效应等均基本明确[1]. 目前已确定TGFβ1对细胞外间质基因表达、基质降解、细胞增殖分化、细胞凋亡及免疫功能起明确作用. 国外及本实验室的研究发现TGFβ1在肿瘤、脏器纤维化、创伤修复、炎症性疾病及自身免疫性疾病等发生发展中具有重要意义[1-4], 提示该分子在多种疾病发生发展中的特殊重要地位. 本文介绍了TGFβ1结构和功能, 特别是他在肝纤维化中的独特作用. 同时, 重点讨论了TGFβ1基因单核苷酸多态性(SNP)对其功能的影响及其在疾病中的意义和前景, 为进一步了解该多肽类生长因子在以肝病为代表的多种疾病中的病理意义及潜在的诊断、干预提供了应用前景.
TGFβ超家族在结构上具有一些共同的特征, 即在合成初期, 都是一个分子量较大的前体分子, 包括一个氨基酸末端信号肽及各种大小的羧基端(C端)活性分子. 前体分子在酶解位点裂解, 释放出一分子量大约在110-140个氨基酸的成熟多肽亚单位. 两个相同或不同的亚单位组成的二聚体具有生物活性. 在TGFβ超家族的TGFβ亚家族中, 目前研究报道有6种TGFβ分子, 分别为TGFβ1-6, 在哺乳动物中表达并已克隆的是TGFβ1-3. TGFβ1-3亚单体同源性近80%. TGFβ种属同源性高达95%以上, 提示该类分子介导了独特的、重要的进化中的保守生理过程. 在诸多TGFβ分子中, TGFβ1是目前研究最多的与疾病相关分子, 除非特指, 很多研究中采用的TGFβ即为TGFβ1分子.
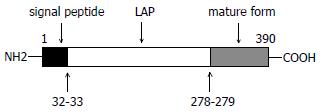
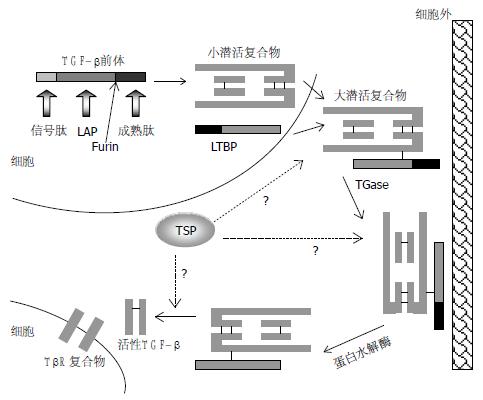
TGFβ1前体分子的一级结构(图1), N端的信号肽、潜活肽(latent associated peptide, LAP)酶解后产生C端成熟态单体(mature form), 分子量约12.5 kDa. LAP与TGFβ1成熟态同种二聚体(25 kDa)非共价交联可形成小复合物, 并可进一步与LTBP(latent TGFβ binding protein)共价结合形成分子量约为225 kDa以上的大复合物. TGFβ1单体(又称成熟态mature form)、TGFβ1活性二聚体及TGFβ前体大、小两种复合物之间的结构关系见图2. TGFβ大分子复合物将TGFβ锚定于细胞外间质, 是TGFβ活性分子的一个良好天然储存库[1].
TGFβ1具有多种广泛功能, 国外及本实验室的研究发现TGFβ1在肿瘤、脏器纤维化、创伤修复、炎症性疾病及自身免疫性疾病等发生发展中具有重要意义[1-4], 提示该分子在多种疾病发生发展中的特殊重要地位. 在上述诸多疾病中, TGFβ1与肝纤维化/硬化/肝癌的相关性研究有重要的现实意义. 众所周知, 我国是病毒性肝炎特别是乙型病毒性肝炎的高发地, 作为其主要不良结局的肝纤维化/硬化和原发性肝癌同样具有较高的发病率, 以肝星状细胞(hepatic stellate cell, HSC)激活、细胞外基质(ECM)过度沉积为特征的肝纤维化如果得不到及时诊断和治疗, 可进一步发展为肝硬化, 肝功能可从代偿走向失代偿, 患者最终因肝功能衰竭或并发肝癌而影响生存. 因此肝炎-肝纤维化-肝硬化-肝癌是这类疾病发展的典型规律. 肝硬化和肝癌均是病理条件下肝损伤修复的异常表现, 其中细胞外间质基因如何被异常激活并高水平表达、肝实质细胞在损伤后的修复中如何发生异常突变导致癌变等是目前肝纤维化/硬化及癌变发生机制中尚未弄清的核心问题. TGFβ1在纤维硬化性疾病中的特殊作用表现为: (1)对纤维化形成细胞的初始激活作用, (2)促进ECM的产生, (3)改变分泌基质金属蛋白酶(MMPs)及其抑制剂的活性, (4)增强靶细胞对细胞因子的反应性等. 因此TGFβ1是重要的介导细胞对组织损伤的强效致纤维化因子, 对肝炎肝损伤后肝纤维化(硬化)及其他脏器纤维化如心脑血管硬化、肺纤维化、肾纤维化、皮肤纤维癍痕等形成具有重要起始促进作用[1]. 此外, TGFβ1通过调节淋巴细胞增殖、分化和存活以及抑制NK细胞增殖及杀伤等途径发挥免疫抑制作用, 对维持机体免疫内环境稳定发挥重要作用[3]. 病理情况下, TGFβ1通过其免疫抑制机制, 损伤机体的免疫监督机制, 使机体失去对自我抗原、外来抗原、或肿瘤相关抗原的正常免疫应答, 从而导致自身免疫性疾病或肿瘤的发生[4]. TGFβ1对纤维硬化性疾病效应细胞的特殊激活作用及其在炎症、免疫反应中的独特作用赋予了TGFβ1异常在脏器纤维化/硬化及肿瘤等相关疾病中的特殊病理意义[3-4]. 多视角、多层次的进一步研究还表明TGFβ1转基因大鼠高表达TGFβ1后, 可发生包括肝纤维化在内的多种脏器损伤[5-7]; 可溶性TGFβ1受体中和阻断TGFβ1功能或导入TGFβ1信号传导的抑制性分子SMAD7后, 能有效预防DMN诱导或胆管结扎诱导的大鼠肝纤维化的发生[8-12], 这些研究进一步确认了TGFβ1在组织脏器纤维化中的作用.
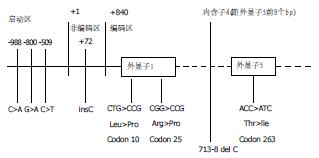
2000年后, 随着人类基因组计划的完成, 有关基因结构和功能的研究蓬勃发展, 其中TGFβ1基因多态性与疾病相关性的研究取得了令人鼓舞的结果. 研究表明, TGFβ1基因至少存在8个以上的基因多态性位点(图3).
2002年, Gressner实验室首先采用Lightcycler(实时荧光PCR结合熔点曲线分析)及ARMS-PCR(amplification refractory mutation system-PCR, 扩增难控性突变系统PCR)方法, 建立了其中4个位点(-800, -509, codon 10, codon 25)SNP的检测方法[13], 以后陆续有实验室采用不同方法如RFLP(限制性片段长度多态性)、SSCP(单链核酸构象多态性), ASO(等位基因特异性寡核苷酸探针)等, 分别分析-509, codon 10的多态性位点. 2004年本实验室建立了6个位点(-988, -800, -509, codon 10, codon 25, codon 263)SNP的检测方法[14-15]. 研究表明, 丙肝病毒(HCV)感染后, Arg25Arg者属于高TGFβ1表型, 更容易发生肝纤维化, Arg25Pro杂合子发生肝纤维化的进展更快[13]. 本实验室的研究也发现, HBV感染后肝硬化的发生与codon 10基因多态性密切相关, 这种肝硬化的严重性则与-509多态性有关[15]. 除了与乙型、丙型肝炎感染后肝硬化发生有关外, 查阅2000年以来的文献可以发现, TGFβ1 SNP主要与以下5大类疾病有关: (1)纤维硬化性疾病, 如心脑血管硬化导致的脑血管意外(脑卒中)、血管性痴呆、心梗、系统性硬化、心衰以及多发性硬化症、囊性纤维化等; (2)肿瘤性疾病如乳腺癌、肺癌、妇科肿瘤、前列腺肿瘤、结直肠癌等; (3)免疫性疾病如哮喘、风湿病、变态反应、HCV清除率、移植排斥反应等; (4)糖尿病及其并发症; (5)肾功能衰竭. 上述研究结论主要集中在-509、codon 10, codon 25这3个位点. 上述文献调研的结果见表1.
| 疾病名称 | 研究人群所在国家 | 疾病相关TGFβ1 SNP位点 | 参考文献 |
| 心脏移植受者肾功能 | 捷克 | Codon 25 | 16 |
| 派若尼氏症 | 德国 | Codon 25 | 17 |
| 肾移植受体免疫抑制病 | 瑞士 | ND | 18 |
| 增生性糖尿病视网膜病变 | 捷克 | Codon 25 | 19 |
| 丙肝引起的肝硬化 | 德国 | Codon 25 | 13, 14 |
| 特应性皮炎 | 英国 | Codon 25 | 20 |
| 牙龈增生 | 英国 | Codon 25 | 21 |
| 囊性纤维化的肺功能 | 英国 | Codon 25 | 22 |
| 心肌梗塞并高血压 | 爱尔兰/法国 | Codon 25 | 23 |
| 韦格纳肉芽肿病 | 德国 | Codon 25 | 24 |
| 疤痕疾病 | 英国 | Codon 25 | 25 |
| 系统性硬化症 | 日本 | Codon 25 | 26 |
| 老年性痴 | 法国 | Codon 25 | 27 |
| 1型糖尿病性肾炎 | 美国 | Codon 25 | 28 |
| 成人牙周炎 | 捷克 | Codon 25 | 29 |
| 哮喘 | 英国 | Codon 25 | 30 |
| 多发性硬化 | 美国 | Codon 25 | 31 |
| 扩张型心肌病心力衰竭 | 荷兰 | Codon 25 | 32 |
| 伯克肉样瘤 | 德国 | Codon 25 | 33 |
| 心脏移植后加速移植血管病 | 荷兰 | Codon 25 | 34 |
| 同种异体肾脏移植排斥反应 | 英国 | Codon 25 | 35 |
| 心脏移植后肾衰竭 | 荷兰 | Codon 25 | 36 |
| 原发性高血压 | 阿拉伯联合酋长国 | Codon 25 | 37 |
| 子宫颈侵袭性磷状细胞癌 | 津巴布韦 | Codon 25 | 38 |
| 脑中风 | 荷兰 | -509/Codon 10 | 39 |
| 缺血性脑卒/血管性痴呆 | 韩国 | Codon 10 | 40 |
| 变态反应/免疫活性 | 美国 | -509 | 41 |
| 乳腺癌 | 美国/中国 | Codon 10 | 42, 43 |
| 骨密度/骨折 | 中国 | Codon 10 | 44 |
| 肺癌 | 韩国 | -509, Codon 10 | 45 |
| 遗传缺陷性高度近视 | 中国 | Codon 10 | 46 |
| 丙肝病毒清除率 | 日本 | -509 | 47 |
| 哮喘 | 中国 | -509/Codon 10 | 48 |
| 风湿性心脏病/关节炎 | 中国台湾/北欧 | -509/Codon 10 | 49, 50 |
| 乙型肝炎后肝硬化 | 中国 | -509/Codon 10 | 14, 15 |
| 前列腺增生/肿瘤 | 日本 | Codon 10 | 51 |
TGFβ1基因多态性与如此多疾病的发生发展存在相关性, 进一步提示该分子在多种疾病发生发展中的特殊重要地位, 同时也提示细胞因子网络调控的复杂性. 目前有关TGFβ1多态性研究的结果主要停留在不同位点基因多态性与疾病的相关性、严重性或易感性上. 我们认为这种现象的研究不足以揭示靶基因对疾病发生发展影响的本质, TGFβ1基因多态性究竟以何种方式参与疾病的病理过程值得进一步深入研究.
根据我们实验室的研究结果, 在TGFβ1常见的8个SNP位点中, 中国人在-800、-988位点及codon 25、codon 263基本不存在基因多态性, 常见的变异主要存在于-509 C>T和codon 10(+29 T>C, 10 Leu>Pro), 其中-509存在于TGFβ1转录起始位点上游. 为弄清这一位点变异可能带来的影响, 我们采用计算机软件模拟分析其核转录因子结合情况, 下图中我们分析了以-509为核心的上、下游60 bp的序列即-449-570 bp(图中相应位置是-570为+1, -449为+122, 故-509相当于+62的位置)的DNA结合蛋白, 可以发现-509 C>T的变化, 相应核蛋白转录因子的结合谱是不同的. 提示-509 C>T的变化理论上可影响核转录因子的结合模式(图4A-B).
Codon 10(10 Leu>Pro)的变异存在于TGFβ1前体分子的的信号肽中(图1), 而信号肽中氨基酸序列的改变理论上可影响相应蛋白质的分泌. Dunning et al[52]通过Hela细胞转染研究发现, codon 10(10 Leu>Pro)变异可改变细胞TGFβ1分泌水平. 这种分泌活性的改变是否在其他储存或产生TGFβ1的细胞如正常肝细胞、肝星状细胞(HSC)等也存在类似现象尚无文献报道; 此外, 研究发现肝脏的HSC具有重要的抗原递呈活性[53]. 作为重要免疫抑制性调控因子的TGFβ1转录或分泌活性的改变是否可影响病理状态下HSC的抗原递呈活性并因此参与影响病毒清除进而成为影响其病理转归的重要原因目前尚无文献报道. 另外, TGFβ1具有诱导肝细胞凋亡的作用, 这在病毒性肝病、肝硬化及肿瘤的发生中具有重要意义. 不同个体对于病毒性肝病的不同病理转归是否与-509、codon10不同的基因表现型导致的凋亡活性改变有关尚不清楚.
针对上述研究现状, 以我国具有较大发生率的肝病为主要研究目标, 我们认为应解决以下几个问题: (1)TGFβ1基因多态性通过什么机制介导或参与以肝病为代表的相关疾病的发生、发展? 作为上游调控序列中重要位点变异-509C>T是否因不同细胞因子结合转录因子的不同导致启动转录活性的差异? (2)存在于信号肽中的Codon 10(+29 T>C, 10 Leu>Pro)的变异是否改变肝源性细胞如肝细胞、肝癌细胞、肝星状细胞TGFβ1的分泌? (3)不同的-509、codon 10基因型是否具有影响HSC抗原递呈活性的作用并因此影响病毒性肝病的病理转归? (4)不同的-509、codon 10基因型是否具有影响肝细胞的凋亡活性并因此影响肝损伤后的病理转归? (5)是否可通过临床大样本研究进一步证实不同的-509、codon10基因型影响HBV感染后HBV的清除以及病毒性肝炎后肝硬化或肝癌的发生?
基于前述国内外研究现状及上述问题, 我们认为应进一步深入研究TGFβ1基因变异对肝细胞、肝星状细胞、肝癌细胞TGFβ1基因转录调控、转录因子、细胞因子反应性的改变以及对TGFβ1成熟肽分泌、病毒清除、HCC发生等的影响, 从而在更深层次上阐述TGFβ1基因变异与肝病(肝纤维化/硬化、肝癌)发生发展相关的本质和作用机制. 上述问题的阐述将对以HBV感染后肝硬化、肝癌为代表的TGFβ1异常相关疾病的发病机制研究、实验室早期诊断及干预治疗靶点的寻找具有深远意义.
TGFβ1具有多种广泛功能, 对细胞外间质基因表达、基质降解、细胞增殖分化、细胞凋亡及免疫功能具有明确作用. 国外及本实验室的研究发现TGFβ1在肿瘤、脏器纤维化、创伤修复、炎症性疾病及自身免疫性疾病等发生发展中具有重要意义, 提示该分子在多种疾病发生发展中具有特殊重要地位.
研究表明, TGFβ1基因至少存在8个以上的基因多态性位点. 2002年, Gressner实验室首先采用Lightcycler、ARMS-PCR方法, 建立了其中4个位点(-800, -509, codon10, codon25)SNP的检测方法, 以后陆续有实验室采用不同方法如RFLP(限制性片段长度多态性)、SSCP(单链核酸构象多态性), ASO(等位基因特异性寡核苷酸探针)等, 分别分析-509, codon10的多态性位点.2004年本实验室建立了6个位点(-988, -800, -509,codon 10, codon25, codon 263)SNP的检测方法, 为进一步认识TGFβ1基因SNP与疾病的关系奠定了基础.
TGFβ1基因SNP的分析可辅助判断相关疾病的进展和预后, 为该多肽类生长因子在以肝病为代表的多种疾病中的病理意义及潜在的诊断、干预提供应用前景.
单核苷酸多态性(SNP): 是目前发现的第三代遗传标志. 染色体的某个位点上存在单个碱基的变化, 如果在人群中的频率超过1%, 就可以认为是SNPs.在人类基因组中平均每1000个碱基对就会有一个. 个体基因组DNA中的少数甚至个别碱基多态性, 可导致特定基因疾病相关的特征性改变, 这就是 SNP的主要特征. SNPs对于研究基因多态性以及识别、定位疾病位点、分析多基因疾病的主基因及个体对药物的不同反应性差异、个体化用药等具有重要价值.
本文内容新颖全面, 行文流畅, 引用的参考文献较新, 代表了国内外现阶段该领域的研究现状, 是一篇有深度有见解的文章, 具有较高的学术价值.
编辑: 何燕 电编:郭海丽
| 2. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 3. | Wahl SM, Wen J, Moutsopoulos N. TGF-beta: a mobile purveyor of immune privilege. Immunol Rev. 2006;213:213-227. [PubMed] |
| 4. | Li MO, Wan YY, Sanjabi S, Robertson AK, Flavell RA. Transforming growth factor-beta regulation of immune responses. Annu Rev Immunol. 2006;24:99-146. [PubMed] |
| 5. | Sanderson N, Factor V, Nagy P, Kopp J, Kondaiah P, Wakefield L, Roberts AB, Sporn MB, Thorgeirsson SS. Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions. Proc Natl Acad Sci U S A. 1995;92:2572-2576. [PubMed] |
| 6. | Kanzler S, Lohse AW, Keil A, Henninger J, Dienes HP, Schirmacher P, Rose-John S, zum Buschenfelde KH, Blessing M. TGF-beta1 in liver fibrosis: an inducible transgenic mouse model to study liver fibrogenesis. Am J Physiol. 1999;276:G1059-1068. [PubMed] |
| 7. | Ueberham E, Low R, Ueberham U, Schonig K, Bujard H, Gebhardt R. Conditional tetracycline-regulated expression of TGF-beta1 in liver of transgenic mice leads to reversible intermediary fibrosis. Hepatology. 2003;37:1067-1078. [PubMed] |
| 8. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] |
| 9. | Ueno H, Sakamoto T, Nakamura T, Qi Z, Astuchi N, Takeshita A, Shimizu K, Ohashi H. A soluble transforming growth factor beta receptor expressed in muscle prevents liver fibrogenesis and dysfunction in rats. Hum Gene Ther. 2000;11:33-42. [PubMed] |
| 10. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of rat stellate cell activation by soluble transforming growth factor beta type II receptor: a potential new therapy for hepatic fibrosis. Proc Natl Acad Sci U S A. 1999;96:12719-12724. [PubMed] |
| 11. | Arias M, Sauer-Lehnen S, Treptau J, Janoschek N, Theuerkauf I, Buettner R, Gressner AM, Weiskirchen R. Adenoviral expression of a transforming growth factor-beta1 antisense mRNA is effective in preventing liver fibrosis in bile-duct ligated rats. BMC Gastroenterol. 2003;3:29. [PubMed] |
| 12. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] |
| 13. | Gewaltig J, Mangasser-Stephan K, Gartung C, Biesterfeld S, Gressner AM. Association of polymorphisms of the transforming growth factor-beta1 gene with the rate of progression of HCV-induced liver fibrosis. Clin Chim Acta. 2002;316:83-94. [PubMed] |
| 14. | Wang H, Mengsteab S, Tag CG, Gao CF, Hellerbrand C, Lammert F, Gressner AM, Weiskirchen R. Transforming growth factor-beta1 gene polymorphisms are associated with progression of liver fibrosis in Caucasians with chronic hepatitis C infection. World J Gastroenterol. 2005;11:1929-1936. [PubMed] |
| 16. | Lacha J, Hubacek JA, Viklicky O, Malek I, Hutchinson I, Vitko S. TGF-beta1 gene polymorphism is a risk factor for renal dysfunction in heart transplant recipients. Transplant Proc. 2001;33:1567-1569. [PubMed] |
| 17. | Hauck EW, Hauptmann A, Schmelz HU, Bein G, Weidner W, Hackstein H. Prospective analysis of single nucleotide polymorphisms of the transforming growth factor beta-1 gene in Peyronie's disease. J Urol. 2003;169:369-372. [PubMed] |
| 18. | Ochsner S, Guo Z, Binswanger U, Knoflach A. TGF-beta 1 gene expression in stable renal transplant recipients: influence of TGF-beta 1 gene polymorphism and immunosuppression. Transplant Proc. 2002;34:2901-2903. [PubMed] |
| 19. | Beranek M, Kankova K, Benes P, Izakovicova-Holla L, Znojil V, Hajek D, Vlkova E, Vacha J. Polymorphism R25P in the gene encoding transforming growth factor-beta (TGF-beta1) is a newly identified risk factor for proliferative diabetic retinopathy. Am J Med Genet. 2002;109:278-283. [PubMed] |
| 20. | Arkwright PD, Chase JM, Babbage S, Pravica V, David TJ, Hutchinson IV. Atopic dermatitis is associated with a low-producer transforming growth factor beta(1) cytokine genotype. J Allergy Clin Immunol. 2001;108:281-284. [PubMed] |
| 21. | Linden GJ, Haworth SE, Maxwell AP, Poulton KV, Dyer PA, Middleton D, Irwin CR, Marley JJ, McNamee P, Short CD. The influence of transforming growth factor-beta1 gene polymorphisms on the severity of gingival overgrowth associated with concomitant use of cyclosporin A and a calcium channel blocker. J Periodontol. 2001;72:808-814. [PubMed] |
| 22. | Arkwright PD, Laurie S, Super M, Pravica V, Schwarz MJ, Webb AK, Hutchinson IV. TGF-beta(1) genotype and accelerated decline in lung function of patients with cystic fibrosis. Thorax. 2000;55:459-462. [PubMed] |
| 23. | Cambien F, Ricard S, Troesch A, Mallet C, Generenaz L, Evans A, Arveiler D, Luc G, Ruidavets JB, Poirier O. Polymorphisms of the transforming growth factor-beta 1 gene in relation to myocardial infarction and blood pressure. The Etude Cas-Temoin de l'Infarctus du Myocarde (ECTIM) Study. Hypertension. 1996;28:881-887. [PubMed] |
| 24. | Murakozy G, Gaede KI, Ruprecht B, Gutzeit O, Schurmann M, Schnabel A, Schlaak M, Gross WL, Muller-Quernheim J. Gene polymorphisms of immunoregulatory cytokines and angiotensin-converting enzyme in Wegener's granulomatosis. J Mol Med. 2001;79:665-670. [PubMed] |
| 25. | Bayat A, Walter JM, Bock O, Mrowietz U, Ollier WE, Ferguson MW. Genetic susceptibility to keloid disease: mutation screening of the TGFbeta3 gene. Br J Plast Surg. 2005;58:914-921. [PubMed] |
| 26. | Ohtsuka T, Yamakage A, Yamazaki S. The polymorphism of transforming growth factor-beta1 gene in Japanese patients with systemic sclerosis. Br J Dermatol. 2002;147:458-463. [PubMed] |
| 27. | Araria-Goumidi L, Lambert JC, Mann DM, Lendon C, Frigard B, Iwatsubo T, Cottel D, Amouyel P, Chartier-Harlin MC. Association study of three polymorphisms of TGF-beta1 gene with Alzheimer's disease. J Neurol Neurosurg Psychiatry. 2002;73:62-64. [PubMed] |
| 28. | Ng DP, Warram JH, Krolewski AS. TGF-beta 1 as a genetic susceptibility locus for advanced diabetic nephropathy in type 1 diabetes mellitus: an investigation of multiple known DNA sequence variants. Am J Kidney Dis. 2003;41:22-28. [PubMed] |
| 29. | Holla LI, Fassmann A, Benes P, Halabala T, Znojil V. 5 polymorphisms in the transforming growth factor-beta 1 gene (TGF-beta 1) in adult periodontitis. J Clin Periodontol. 2002;29:336-341. [PubMed] |
| 30. | Pulleyn LJ, Newton R, Adcock IM, Barnes PJ. TGFbeta1 allele association with asthma severity. Hum Genet. 2001;109:623-627. [PubMed] |
| 31. | Weinshenker BG, Hebrink D, Kantarci OH, Schaefer-Klein J, Atkinson E, Schaid D, McMurray CM. Genetic variation in the transforming growth factor beta1 gene in multiple sclerosis. J Neuroimmunol. 2001;120:138-145. [PubMed] |
| 32. | Holweg CT, Baan CC, Niesters HG, Vantrimpont PJ, Mulder PG, Maat AP, Weimar W, Balk AH. TGF-beta1 gene polymorphisms in patients with end-stage heart failure. J Heart Lung Transplant. 2001;20:979-984. [PubMed] |
| 33. | Murakozy G, Gaede KI, Zissel G, Schlaak M, Muller-Quernheim J. Analysis of gene polymorphisms in interleukin-10 and transforming growth factor-beta 1 in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis. 2001;18:165-169. [PubMed] |
| 34. | Holweg CT, Baan CC, Balk AH, Niesters HG, Maat AP, Mulder PM, Weimar W. The transforming growth factor-beta1 codon 10 gene polymorphism and accelerated graft vascular disease after clinical heart transplantation. Transplantation. 2001;71:1463-1467. [PubMed] |
| 35. | Poole KL, Gibbs PJ, Evans PR, Sadek SA, Howell WM. Influence of patient and donor cytokine genotypes on renal allograft rejection: evidence from a single centre study. Transpl Immunol. 2001;8:259-265. [PubMed] |
| 36. | Baan CC, Balk AH, Holweg CT, van Riemsdijk IC, Maat LP, Vantrimpont PJ, Niesters HG, Weimar W. Renal failure after clinical heart transplantation is associated with the TGF-beta 1 codon 10 gene polymorphism. J Heart Lung Transplant. 2000;19:866-872. [PubMed] |
| 37. | Frossard PM, Gupta A, Pravica V, Perrey C, Hutchinson IV, Lukic ML. A study of five human cytokine genes in human essential hypertension. Mol Immunol. 2002;38:969-976. [PubMed] |
| 38. | Stanczuk GA, Tswana SA, Bergstrom S, Sibanda EN. Polymorphism in codons 10 and 25 of the transforming growth factor-beta 1 (TGF-beta1) gene in patients with invasive squamous cell carcinoma of the uterine cervix. Eur J Immunogenet. 2002;29:417-421. [PubMed] |
| 39. | Sie MP, Uitterlinden AG, Bos MJ, Arp PP, Breteler MM, Koudstaal PJ, Pols HA, Hofman A, van Duijn CM, Witteman JC. TGF-beta 1 polymorphisms and risk of myocardial infarction and stroke: the Rotterdam Study. Stroke. 2006;37:2667-2671. [PubMed] |
| 40. | Kim Y, Lee C. The gene encoding transforming growth factor beta 1 confers risk of ischemic stroke and vascular dementia. Stroke. 2006;37:2843-2845. [PubMed] |
| 41. | Meng J, Thongngarm T, Nakajima M, Yamashita N, Ohta K, Bates CA, Grunwald GK, Rosenwasser LJ. Association of transforming growth factor-beta1 single nucleotide polymorphism C-509T with allergy and immunological activities. Int Arch Allergy Immunol. 2005;138:151-160. [PubMed] |
| 42. | Ziv E, Cauley J, Morin PA, Saiz R, Browner WS. Association between the T29-->C polymorphism in the transforming growth factor beta1 gene and breast cancer among elderly white women: The Study of Osteoporotic Fractures. JAMA. 2001;285:2859-2863. [PubMed] |
| 43. | Shin A, Shu XO, Cai Q, Gao YT, Zheng W. Genetic polymorphisms of the transforming growth factor-beta1 gene and breast cancer risk: a possible dual role at different cancer stages. Cancer Epidemiol Biomarkers Prev. 2005;14:1567-1570. [PubMed] |
| 44. | Lau HH, Ho AY, Luk KD, Kung AW. Transforming growth factor-beta1 gene polymorphisms and bone turnover, bone mineral density and fracture risk in southern Chinese women. Calcif Tissue Int. 2004;74:516-521. [PubMed] |
| 45. | Park KH, Lo Han SG, Whang YM, Lee HJ, Yoo YD, Lee JW, Shin SW, Kim YH. Single nucleotide polymorphisms of the TGFB1 gene and lung cancer risk in a Korean population. Cancer Genet Cytogenet. 2006;169:39-44. [PubMed] |
| 46. | Lin HJ, Wan L, Tsai Y, Tsai YY, Fan SS, Tsai CH, Tsai FJ. The TGFbeta1 gene codon 10 polymorphism contributes to the genetic predisposition to high myopia. Mol Vis. 2006;12:698-703. [PubMed] |
| 47. | Kimura T, Saito T, Yoshimura M, Yixuan S, Baba M, Ji G, Muramatsu M, Kawata S. Association of transforming growth factor-beta 1 functional polymorphisms with natural clearance of hepatitis C virus. J Infect Dis. 2006;193:1371-1374. [PubMed] |
| 48. | Mak JC, Leung HC, Ho SP, Law BK, Ho AS, Lam WK, Ip MS, Chan-Yeung MM. Analysis of TGF-beta(1) gene polymorphisms in Hong Kong Chinese patients with asthma. J Allergy Clin Immunol. 2006;117:92-96. [PubMed] |
| 49. | Chou HT, Chen CH, Tsai CH, Tsai FJ. Association between transforming growth factor-beta1 gene C-509T and T869C polymorphisms and rheumatic heart disease. Am Heart J. 2004;148:181-186. [PubMed] |
| 50. | Mattey DL, Nixon N, Dawes PT, Kerr J. Association of polymorphism in the transforming growth factor {beta}1 gene with disease outcome and mortality in rheumatoid arthritis. Ann Rheum Dis. 2005;64:1190-1194. [PubMed] |
| 51. | Li Z, Habuchi T, Tsuchiya N, Mitsumori K, Wang L, Ohyama C, Sato K, Kamoto T, Ogawa O, Kato T. Increased risk of prostate cancer and benign prostatic hyperplasia associated with transforming growth factor-beta 1 gene polymorphism at codon10. Carcinogenesis. 2004;25:237-240. [PubMed] |
| 52. | Dunning AM, Ellis PD, McBride S, Kirschenlohr HL, Healey CS, Kemp PR, Luben RN, Chang-Claude J, Mannermaa A, Kataja V. A transforming growth factorbeta1 signal peptide variant increases secretion in vitro and is associated with increased incidence of invasive breast cancer. Cancer Res. 2003;63:2610-2615. [PubMed] |
| 53. | Vinas O, Bataller R, Sancho-Bru P, Gines P, Berenguer C, Enrich C, Nicolas JM, Ercilla G, Gallart T, Vives J. Human hepatic stellate cells show features of antigen-presenting cells and stimulate lymphocyte proliferation. Hepatology. 2003;38:919-929. [PubMed] |