修回日期: 2007-09-01
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 通过检测胃癌、癌前病变和正常对照组中p16基因启动子区CpG岛甲基化水平及其表达, 并结合临床病理资料, 分析他们在胃癌发生、发展中的作用.
方法: 用甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)检测41例胃癌组织、40例癌前病变组织和38例正常对照组织中p16基因启动子5'CpG岛甲基化; 应用免疫组化检测基因的蛋白表达.
结果: 胃癌组织中p16基因甲基化阳性率为56.1%(23/41), 癌前病变组织中为17.5%(7/40), 而正常对照组织中为2.6%(1/38), 前组与后两组之间的差异有显著性(P<0.05). 胃癌组织中p16基因表达阳性率为51.2%, 癌前病变组织中为90.0%, 正常对照组织中为100.0%, 前组与后两组之间的差异有显著性(P<0.05). 低分化型胃癌组织中的p16基因甲基化阳性率明显高于高分化型(81.3% vs 40.0%, P<0.05). 有淋巴结转移的胃癌组织中, p16基因甲基化阳性率与无转移组的差异有显著性(81.0% vs 30.0%, P<0.05). 浸润深达浆膜层的胃癌组织中, 甲基化阳性率与未达浆膜层组无统计学差异(60.0% vs 52.4%, P>0.05). 胃癌组织中p16基因甲基化阳性组的蛋白表达阳性率显著低于甲基化阴性组(26.1% vs 83.3%, P<0.01).
结论: 胃癌组织中存在有p16基因启动子5'CpG岛高甲基化, 并导致其基因表达率显著低于正常对照及癌前病变组织. p16基因的高甲基化与胃癌分化程度、淋巴结转移相关. p16基因甲基化的发生, 从正常、癌前病变到胃癌有逐渐增加的趋势, 提示其基因CpG岛高甲基化有可能作为诊断早期胃癌的一项较为敏感的指标.
引文著录: 刘文天, 焦焕利, 杨玉龙, 王栋, 张维铭. p16基因高甲基化在胃癌发展中的作用. 世界华人消化杂志 2007; 15(26): 2839-2843
Revised: September 1, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: Transcriptional silencing induced by hypermethylation of CpG islands in the promoter regions of genes is believed to be an important mechanism underlying tumorigenesis. This study explored the correlation of p16 hypermethylation with tumorigenesis and the development of gastric cancer.
METHODS: Methylation-specific polymerase chain reaction (MSP) was used to detect methylation of the p16 gene in 41 specimens of gastric cancer, 40 specimens of premalignant lesions and 38 normal control specimens. The expression of p16 protein was detected by immunohistochemistry.
RESULTS: The positive rate of p16 gene methylation was significantly higher in gastric cancer than in premalignant lesions and normal control specimens (56.1% vs 17.5%, 2.63%, both P < 0.05). The positive rate of p16 gene expression was significantly lower in gastric cancer than in premalignant lesions and normal control specimens (51.2% vs 90.0%, 100.0%, both P < 0.05). The positive rate of p16 gene methylation was significantly higher in poorly differentiated cancer than in well-differentiated cancer (81.2% vs 40.0%, P < 0.05). The positive rate of p16 gene methylation was significantly higher in gastric cancers with metastasis to the lymph node than in those without metastasis to the lymph node (80.9% vs 30.0%, P < 0.05). The positive rate of p16 gene methylation was higher in gastric cancers with invasion to the serosa than in those without invasion to the serosa (60.0% vs 52.4%, P > 0.05). The positive rate of p16 protein expression in gastric cancers with p16 gene methylation was significantly lower than that in gastric cancers without p16 gene methylation (26.1% vs 83.3%, P < 0.05).
CONCLUSION: Hypermethylation of CpG islands in the promoter of the p16 gene exists in gastric cancer and can downregulate p16 expression. The level of hypermethylation of these CpG islands increases from premalignant lesions through lower degrees of malignancy to higher degrees of malignancy, and might be involved in tumorigenesis and the development of gastric cancer.
- Citation: Liu WT, Jiao HL, Yang YL, Wang D, Zhang WM. Correlation of p16 hypermethylation with tumorigenesis and the development of gastric cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2839-2843
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2839.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2839
现认为胃癌的发病是许多基因异常表达的结果. 基因的表达异常包括基因序列即遗传学(genetics)改变和基因表型遗传学(epigenetics)改变[1-2], 而表型遗传学是研究在DNA序列没有改变的情况下所发生的遗传性基因表达的改变. 这种基因表达的改变可通过DNA甲基化来实现. p16, p21等基因, 是一类抑制细胞增殖重要的抑癌基因, 在肿瘤的发生中起重要作用. 目前对这些肿瘤相关基因高甲基化与胃癌发病关系的研究还很少[3]. 本实验采用甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)[4]及免疫组织化学方法研究胃癌及癌前病变中p16基因启动子区甲基化状况及其蛋白表达, 旨在了解胃癌中p16基因启动子区域甲基化与蛋白表达的关系, 以及甲基化与胃癌临床病理指标之间的关系, 以认识p16基因高甲基化与胃癌发生、发展的关系.
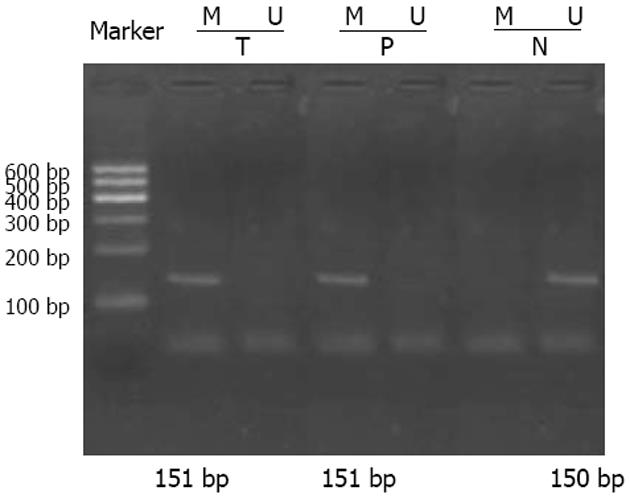
天津医科大学总医院2004-11/2005-03胃镜活检标本. 胃癌41例, 男23例, 女18例, 中位年龄54(38-72)岁, 高分化型(乳头状腺癌、管状腺癌)25例, 低分化型(黏液腺癌、印戒细胞癌)16例. 癌前病变40例中慢性萎缩性胃炎伴中-重肠上皮化生28例, 慢性萎缩性胃炎伴中-重不典型增生24例, 中-重肠上皮化生合并中-重不典型增生12例; 其中男22例, 女18例, 中位年龄53岁(38-64岁); 对照组(正常胃黏膜及慢性浅表性胃炎)38例, 男21例,女17例, 中位年龄53(44-68)岁. 将标本一部分立即置液氮, 然后放入-70℃的低温冰箱中保存, 采用MSP检测甲基化. 另一部分标本用40 g/L甲醛固定, 行常规病理及免疫组化检测. p16基因甲基化(M)和非甲基化(U)序列的特异性引物(上海生物工程有限公司合成)序列如下: p16(M): 5'TTATTAGAGGGTGGGGCGGATCGC3'(上游), 3'CAACCCGAACCGACCGTAA5'(下游), 扩增片段长度为151 bp; p16(U): 5'TTATTAGAGGGTGGGGTGGATTGT3'(上游), 3'CAACCCCAAACCACCATAA5'(下游), 扩增片段长度为150 bp. dNTP, 10×Taq Buffer, Taq DNA聚合酶均为天为时代公司. 生物素化羊抗兔IgG(北京中山生物技术有限公司), DAB显色液(武汉博士德生物工程有限公司).
1.2.1 PCR扩增p16基因: PCR反应体系为DMSO 0.7 μL, dNTP混合物2.0 μL(终浓度200 μmol/L), 10×Taq Buffer 2.5 μL, Taq DNA聚合酶0.6 μL (1.2 U), 引物0.7 μL, DNA 1.0 μL (0.2 μg), 加纯水至25 μL. 循环条件: 94℃ 5 min, 94℃ 30 s, 54℃ 30 s, 30个循环, 72℃ 7 min. 琼脂糖凝胶电泳判定PCR产物.
1.2.2 免疫组化法检测: 采用链霉素-抗生物素蛋白过氧化物酶连结法(SP法). 切片浸入0.01 mol/L枸橼酸盐缓冲液(pH6.0), 微波炉加热, 使之维持在92℃-98℃ 15 min, 室温冷却20 min, 0.1 mol/L PBS洗2次. 滴加正常山羊血清封闭液, 室温20 min, 甩去多余液体, 加1∶50稀释的一抗, 以正常山羊血清代替一抗做阴性对照, 37℃孵育2 h后, 室温恢复20 min, 置4℃冰箱中过夜. 取出切片, 室温恢复20 min, 0.1 mol/L PBS洗2 min× 3次, 加生物素化羊抗兔IgG, 37℃孵育0.5 h, 0.1 mol/L PBS洗2 min×3次. 滴加SP试剂, 37℃孵育0.5 h, 0.1 mol/L PBS洗5 min×3次. 滴加DAB显色液, 室温下显色, 镜下控制显色时间, 蒸馏水洗. 苏木素复染, 脱水, 透明, 中性树胶封片, 镜下观察结果. p16蛋白在黏膜上皮细胞膜着色呈棕黄色, 胞质也有很弱的着色, 为阳性表达. 取5个高倍视野计算阳性细胞占总细胞数的百分率作为阳性比例.
胃癌与癌前病变样品甲基化特异性引物扩增出151 bp的片段, 而正常对照样品非甲基化特异性引物扩增出150 bp的片段(图1).
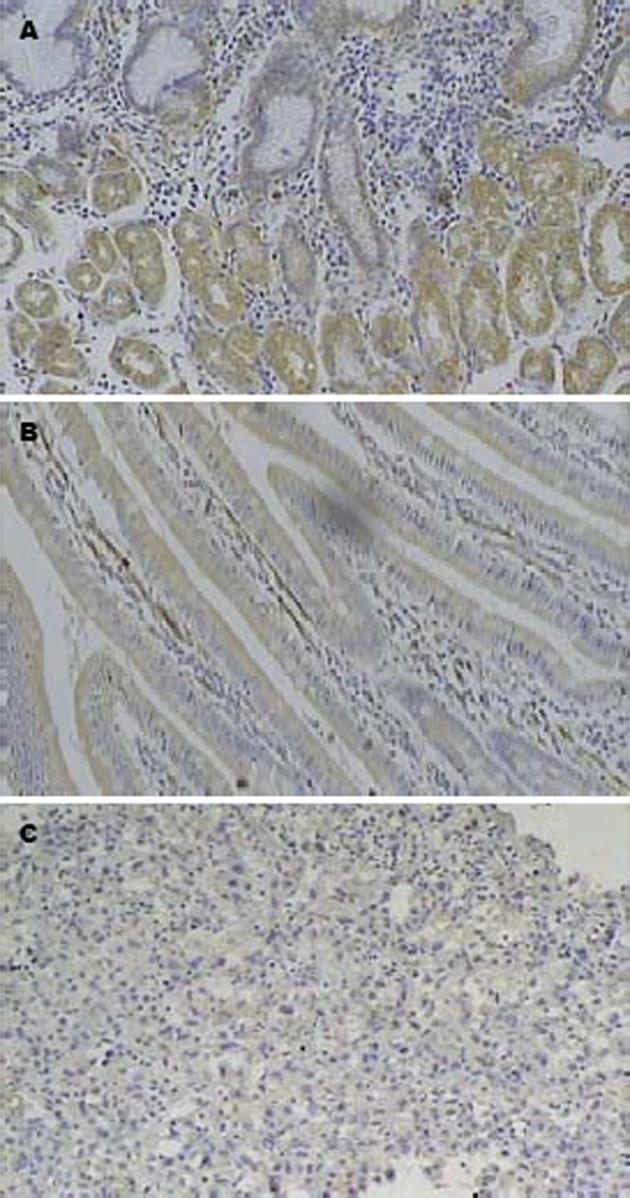
p16蛋白表达在正常黏膜上皮及间质淋巴细胞中胞核阳性着棕黄色, 病变细胞的胞核着色很弱时判定为蛋白表达异常(图2). 胃癌、癌前病变和正常胃黏膜组p16甲基化阳性率分别为56.0%, 17.5%及2.6%, 各组检测阳性率比较见表1. 未分化型胃癌甲基化阳性率(81.2%)较高分化型(40.0%)增高, 且两组间比较有统计学意义(P<0.05), 伴淋巴结转移的胃癌甲基化阳性率(80.9%)较不伴淋巴结转移的甲基化阳性率(30.0%)增高, 且两组间比较有统计学意义(P<0.05). 浸润深达浆膜层的胃癌甲基化阳性率(60.0%)较未达浆膜层的甲基化阳性率(52.4%)增高, 但两组间比较无统计学意义(P>0.05). p16蛋白在正常对照组, 癌前病变组和胃癌组表达阳性率分别为100.0%, 90.0%, 51.2%, 且逐渐降低. 胃癌组与正常对照组及癌前病变组p16表达阳性率比较有显著性差异(P<0.05). 胃癌中p16基因甲基化阳性组p16蛋白表达阳性率为26.1%, 而阴性组p16蛋白表达阳性率为83.3%. 两组间比较有显著差异(P<0.05)(表1).
胃癌是常见的消化道恶性肿瘤之一, 多种癌基因的活化和/或多种抑癌基因的失活及多种外源致癌物的刺激因素的作用导致了胃癌的发生[5]. 基因的表达不仅仅取决于DNA碱基排列顺序的改变, 还受DNA序列以外的机制所调控. DNA甲基化主要是由DNA甲基转移酶(DMT)催化, S-腺苷蛋氨酸(SAM)提供甲基给胞嘧啶, 形成5-甲基胞嘧啶. 5-甲基胞嘧啶是真核细胞中唯一存在的天然修饰方式, 约占整个胞嘧啶的3%-4%. 启动子区富含CpG序列, 故易发生甲基化. 基因启动子区甲基化可以在转录水平抑制基因表达. 在正常细胞中抑癌基因启动子区保持非甲基化状态, 基因可以正常转录、表达, 而在肿瘤细胞中, 抑癌基因启动子区甲基化, 转录受到抑制, 基因不能表达. 在肿瘤组织中常常有与DNA损伤修复、细胞周期等有关的肿瘤抑制基因失活, 从而导致恶性肿瘤的发生发展. 迄今已发现许多恶性肿瘤存在一个或多个肿瘤抑制基因CpG岛甲基化. 肿瘤抑制基因CpG岛甲基化是当今肿瘤分子生物学研究的热点[6].
p16基因的功能产物p16蛋白是重要的细胞周期抑制因子. p16基因变异或失活, 将失去对细胞周期的调控作用, 引起细胞周期中G1期缩短, 过早地进入S期, 从而使细胞无控制地增殖. p16基因的失活存在于大多数肿瘤中, 失活机制包括基因的缺失和高甲基化[7-8]. 本研究通过检测了p16基因启动子CpG岛甲基化的水平发现, 胃癌中pl6基因启动子CpG岛甲基化率达56.1%, 而Tang et al[9]报道胃癌中p16基因甲基化阳性率为30%-60%, 两项结果相一致. 通过对p16基因高甲基化与胃癌病理特征的分析发现, 胃癌p16基因高甲基化与分化程度和淋巴结转移有关, 而与浸润深度无关. 未分化型胃癌p16基因启动子甲基化阳性率明显高于分化型, 提示伴随着p16基因启动子甲基化程度增加, 对基因表达的抑制程度增加, 从而使肿瘤细胞的恶性程度增加. pl6基因启动子甲基化多发生于低分化、有淋巴结转移病例, 因此p16基因甲基化有可能作为评估胃癌预后的一个重要指标. 由于胃癌的发病从癌前病变发展而来, 在癌前病变中p16基因甲基化状态的研究也成为近年来较为有价值的方向[10-12], 所以本研究对胃癌前病变的p16基因甲基化状态进行了检测, 发现胃癌p16基因甲基化阳性率显著高于癌前病变及正常对照, 但在癌前病变中p16基因甲基化阳性率为17.50%, 在由正常、癌前病变到胃癌的转化过程中p16基因甲基化阳性率呈逐步增加的趋势, 提示p16基因启动子CpG岛甲基化可能是发生于胃癌早期的分子事件. 对p16基因甲基化与蛋白表达的关系研究发现, p16基因启动子区甲基化与蛋白表达缺失有密切的关系, 在p16基因高甲基化组pl6蛋白表达明显减低, 在正常对照、癌前病变、胃癌中pl6蛋白表达阳性率呈逐渐降低趋势, 表明启动子区甲基化是p16基因在胃癌中失活的主要机制.
总之, 肿瘤相关基因的甲基化状态异常可能是受损细胞的一种适应生存反应, 在肿瘤发生的启动、促进和进展阶段均发挥着重要作用. 这种CpG岛高甲基化异常在肿瘤预防和治疗中均有重要的应用价值. DNA甲基化在肿瘤诊断、化疗敏感性和预后评价等方面的应用价值已得到重视[13]. 发生DNA甲基化的肿瘤比DNA序列突变肿瘤, 遗传性损伤容易纠正, 经去甲基化治疗特异性地纠正过来, 继而恢复其表达状态, 已被认为是极有潜力的肿瘤基因治疗的新手段[14-16].
胃癌是常见的消化道恶性肿瘤之一, 多种癌基因的活化和/或多种抑癌基因的失活导致了胃癌的发生.基因的表达不仅仅取决DNA碱基排列顺序的改变,还受DNA序列以外的机制所调节,其中基因启动子区CpG岛高甲基化在调控抑癌基因的表达中具有重要的作用, 也成为胃癌研究的热点.
DNA甲基化作为表遗传学研究的重要部分, 调控许多肿瘤抑制基因表达, 已成为肿瘤预防、早期诊断和治疗的重要途径, 具有广泛的前景.
有关p16基因甲基化与胃癌的关系的研究目前已有所报道, 如Tang et al报道胃癌中p16基因甲基化阳性率为30%-60%. Kang et al报道p16、COX-2等基因在慢性胃炎, 肠化中甲基化水平较低, 但在胃癌中有较高的甲基化率.
本研究应用MSP方法及免疫组化方法对胃癌前病变和胃癌组织中p16基因甲基化及基因的蛋白表达进行了研究, 发现由癌前到胃癌的发展过程中甲基化水平呈逐步增高的趋势, 而其表达水平呈减低趋势, 提示p16基因甲基化有可能作为早期胃癌诊断和监测的手段.
胃肠道肿瘤相关的抑癌基因p16基因启动子区CpG岛异常DNA甲基化可以依靠MSP方法检测, 用于胃癌前病变的监测和早期胃癌的诊断.
表型遗传学(epigenetics): 是研究在DNA序列没有改变的情况下所发生的遗传性基因表达的改变. 这种基因表达的改变可通过DNA甲基化, 组蛋白乙酰化等来实现.
本文用甲基化特异性聚合酶链反应和免疫组化监测的方法, 研究了p16基因启动因子区GpG岛甲基化水平和p16蛋白的表达在胃癌发生发展中的作用. 全文研究方法较恰当, 设计较合理,引用的参考文献较新, 有一定的参考价值.
编辑: 何燕 电编:郭海丽
| 1. | Baylin SB, Herman JG. DNA hypermethylation in tumorigenesis: epigenetics joins genetics. Trends Genet. 2000;16:168-174. [PubMed] [DOI] |
| 3. | Robertson KD, Jones PA. DNA methylation: past, present and future directions. Carcinogenesis. 2000;21:461-467. [PubMed] [DOI] |
| 4. | Herman JG, Graff JR, Myohanen S, Nelkin BD, Baylin SB. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc Natl Acad Sci U S A. 1996;93:9821-9826. [PubMed] [DOI] |
| 6. | Luczak MW, Jagodzinski PP. The role of DNA methylation in cancer development. Folia Histochem Cytobiol. 2006;44:143-154. [PubMed] |
| 7. | Chim CS, Liang R, Tam CY, Kwong YL. Methylation of p15 and p16 genes in acute promyelocytic leukemia: potential diagnostic and prognostic significance. J Clin Oncol. 2001;19:2033-2040. [PubMed] |
| 8. | Sanz-Casla MT, Maestro ML, Vidaurreta M, Maestro C, Arroyo M, Cerdan J. p16 Gene methylation in colorectal tumors: correlation with clinicopathological features and prognostic value. Dig Dis. 2005;23:151-155. [PubMed] [DOI] |
| 9. | Tang S, Luo H, Yu J, Yang D, Shu J. Relationship between alterations of p16(INK4a) and p14(ARF) genes of CDKN2A locus and gastric carcinogenesis. Chin Med J (Engl). 2003;116:1083-1087. [PubMed] |
| 10. | Bai H, Gu L, Zhou J, Deng D. p16 hypermethylation during gastric carcinogenesis of Wistar rats by N-methyl-N'-nitro-N-nitrosoguanidine. Mutat Res. 2003;535:73-78. [PubMed] [DOI] |
| 11. | Kang GH, Lee S, Kim JS, Jung HY. Profile of aberrant CpG island methylation along the multistep pathway of gastric carcinogenesis. Lab Invest. 2003;83:635-641. [PubMed] [DOI] |
| 12. | Lee JH, Park SJ, Abraham SC, Seo JS, Nam JH, Choi C, Juhng SW, Rashid A, Hamilton SR, Wu TT. Frequent CpG island methylation in precursor lesions and early gastric adenocarcinomas. Oncogene. 2004;23:4646-4654. [PubMed] [DOI] |
| 13. | Paluszczak J, Baer-Dubowska W. Epigenetic diagnostics of cancer--the application of DNA methylation markers. J Appl Genet. 2006;47:365-375. [PubMed] [DOI] |
| 14. | Esteller M. DNA methylation and cancer therapy: new developments and expectations. Curr Opin Oncol. 2005;17:55-60. [PubMed] [DOI] |
| 15. | Yoo CB, Cheng JC, Jones PA. Zebularine: a new drug for epigenetic therapy. Biochem Soc Trans. 2004;32:910-912. [PubMed] [DOI] |
| 16. | Kalebic T. Epigenetic changes: potential therapeutic targets. Ann N Y Acad Sci. 2003;983:278-285. [PubMed] [DOI] |