修回日期: 2007-09-02
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 研究替加色罗对糖尿病大鼠胃排空功能及胃组织Ghrelin、P物质表达的影响, 探讨替加色罗对糖尿病胃轻瘫的治疗作用及其可能的机制.
方法: 50只清洁级♂Wistar大鼠随机分为正常对照组(NC组, n = 10)、糖尿病组(DM组, n = 10)、低剂量替加色罗治疗组(TEG-L组, n = 10)、中剂量替加色罗治疗组(TEG-M组, n = 10)和高剂量替加色罗治疗组(TEG-H组, n = 10). ip链脲佐菌素(STZ)制备糖尿病大鼠模型, 8 wk后分别以0.1, 0.5和1 mg/kg的剂量给予TEG-L, M和H组大鼠ip替加色罗连续3 d, 采用酚红灌胃法检测胃排空, 免疫组化技术检测各组大鼠胃黏膜Ghrelin与胃窦组织SP的表达.
结果: TEG各组大鼠Ghrelin(34.721±6.759, 33.547±6.255, 35.141±5.987)与SP的积分光密度(13.548±1.078, 13.952±1.246, 11.845±1.567)均低于NC组(Ghrelin: 43.514±5.323, P<0.05, P<0.01, P<0.01; SP: 16.383±2.275, 均P<0.01)而高于DM组(Ghrelin: 26.626±4.596, 均P<0.05; SP: 9.257±1.636, 均P<0.01); Ghrelin积分光密度在TEG各组之间无显著性差异, 而TEG-L, M组SP积分光密度均高于TEG-H组(均P<0.05).
结论: 替加色罗可通过促进胃组织Ghrelin与SP的表达释放来改善糖尿病大鼠延迟的胃排空.
引文著录: 魏良洲, 杨林, 王利华, 张民生, 李新华, 田字彬. 替加色罗对糖尿病大鼠胃排空功能及Ghrelin、P物质表达的影响. 世界华人消化杂志 2007; 15(26): 2825-2830
Revised: September 2, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: To investigate the effect of tegaserod on gastric emptying and the expression of ghrelin and substance P (SP) in diabetic rats, and to explore the therapeutic effect of tegaserod on diabetic gastroparesis and its possible mechanism.
METHODS: Fifty Wistar rats were randomly divided into five groups: a normal control group (NC group, n = 10), a diabetes mellitus group (DM group, n = 10), a low dose tegaserod-treated group (TEG-L group, n = 10), a moderate dose tegaserod-treated group (TEG-M group, n = 10) and a high dose tegaserod-treated group (TEG-H group, n = 10). Diabetes was induced by intraperitoneal injection of streptozotocin (STZ). After 8 weeks, tegaserod was administered by intraperitoneal injection at doses of 0.1 mg/kg, 0.5 mg/kg and 1 mg/kg in TEG-L, TEG-M and TEG-H groups, respectively, for 3 days. Gastric emptying was measured by intragastric administration of phenol red. The expression of ghrelin in the gastric mucosa and SP in the gastric antrum was detected by immunohistochemistry.
RESULTS: The staining intensities for ghrelin and SP in all TEG groups were significantly decreased compared with those in the NC group (ghrelin: 34.721 ± 6.759, 33.547 ± 6.255, 35.141 ± 5.987 vs 43.514 ± 5.323, P < 0.05, P < 0.01, P < 0.01; SP: 13.548 ± 1.078, 13.952 ± 1.246, 11.845 ± 1.567 vs 16.383 ± 2.275, all P < 0.01) and increased compared with the DM group (ghrelin: 26.626 ± 4.596, all P < 0.05; SP: 9.257 ± 1.636, all P < 0.01). However, the differences in ghrelin staining intensities among TEG groups were not statistically significant. The staining intensities for SP in the TEG-L and TEG-M groups were increased compared with the TEG-H group (both P < 0.05).
CONCLUSION: Tegaserod may improve delayed gastric emptying in diabetic rats by enhancing the expression and release of ghrelin and SP.
- Citation: Wei LZ, Yang L, Wang LH, Zhang MS, Li XH, Tian ZB. Effect of tegaserod on gastric emptying and the expression of ghrelin and substance P in diabetic rats. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2825-2830
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2825.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2825
糖尿病胃轻瘫(diabetic gastroparesis, DGP)是指糖尿病患者无机械性梗阻时并发的胃动力障碍和排空延迟[1-6], 其发病机制主要与高血糖导致的自主神经病变、胃肠激素分泌异常、胃肠平滑肌变性、微血管病变及代谢紊乱等有关[7-11], 治疗上主要包括积极控制血糖以及促胃肠动力药的使用[1-6]. Ghrelin是近年来新发现的一种主要由胃底黏膜分泌的、可促进胃肠运动的脑肠肽[12-18], 而P物质(substance P, SP)是一种广泛分布于胃肠道的兴奋性神经递质, 对胃运动和排空有促进作用[19]. 替加色罗(Tegaserod)是一种5-羟色胺4(5-HT4)受体部分激动剂, 用于治疗便秘型肠易激综合征并显示出良好疗效. 近年来研究发现替加色罗可以增加上消化道动力, 促进胃排空[20]. 我们通过研究替加色罗对糖尿病大鼠胃排空功能及胃组织Ghrelin、P物质表达的影响来探讨替加色罗对糖尿病胃轻瘫的治疗作用及其可能的机制.
清洁级♂Wistar大鼠50只, 体质量100 g左右, 购自青岛市动物实验中心, 链脲佐菌素(streptozotocin, STZ)购自美国Sigma公司. 替加色罗原粉由北京诺华公司惠赠. Ghrelin、SP一抗(兔抗鼠血清), 分别购自美国凤凰公司和北京中山生物技术有限公司, 二抗购自北京中山生物技术有限公司, VIDAS计算机图像分析系统由德国OPTON公司生产, 1-甲基-2-吡咯烷酮(1-methyl- 2-pyrrolidinone)购自Sigma公司.
1.2.1 动物模型的制作: 随机分为正常对照组(NC组)、糖尿病组(DM组)、低剂量替加色罗治疗组(TEG-L组)、中剂量替加色罗治疗组(TEG-M组)、高剂量替加色罗治疗组(TEG-H组), 每组10只. 大鼠适应性饲养1 wk后, 禁食8 h. NC组大鼠以6 mL/kg的剂量ip 0.1 mmol/L, pH4.4的柠檬酸缓冲液, 其他各组大鼠以60 mg/kg的剂量一次性ip上述柠檬酸缓冲液配制而成的10 g/L STZ, 注射后72 h剪尾取血, 血糖仪测随机血糖≥16.7 mmol/L且稳定1 wk确定为糖尿病模型建立. 模型建立后第9周进行实验. 替加色罗原粉在1-甲基-2-吡咯烷酮中溶解后用生理盐水稀释成0.1, 0.5和1 g/L 3种浓度. NC组与DM组大鼠以1 mL/kg的剂量ip 1-甲基-2-吡咯烷酮; TEG-L, M和H组分别以0.1, 0.5和1 mg/kg的剂量给大鼠ip替加色罗, 连续3 d. 第4天测定胃排空.
1.2.2 胃排空的测定: 给予1.5 mmol/L的酚红溶液2 mL ig, 15 min后处死大鼠, 剖腹, 结扎贲门和幽门, 取出整个鼠胃, 沿胃大弯切开, 以蒸馏水冲洗胃内容物, 定容为20 mL. 而后加入0.5 mol/L NaOH 20 mL搅拌混匀, 静置1 h, 取5 mL上清液加入200 mL/L三氯乙酸0.5 mL去蛋白, 以3500 r/min(离心半径0.1 m)离心10 min, 取上清液用分光光度计在560 nm波长下测定光密度值; 另取酚红溶液2 mL, 先后加入蒸馏水18 mL, 0.5 mol/L NaOH 20 mL, 200 mL/L三氯乙酸4 mL搅拌混匀, 测定光密度值[21]. 大鼠胃排空率 = (1-实测酚红光密度/标准酚红光密度)×100%.
1.2.3 免疫组化法检测Ghrelin和SP的表达: 取1 cm×0.3 cm大小的胃底、胃窦组织各1块置于40 g/L中性甲醛中固定, 石蜡包埋后切片、脱蜡, PBS溶液浸泡、微波修复抗原, 分别滴加Ghrelin、SP一抗及二抗, DAB显色, 苏木素复染. 高倍镜下观察Ghrelin与SP阳性产物的表达情况, 并随机选取互不重叠的5个视野, 用VIDAS计算机图像分析系统测定每个视野阳性染色的积分光密度(积分光密度 = 染色强度×染色面积), 取其平均值作为该切片Ghrelin与SP表达的定量指标.
统计学处理 数据均以均数±标准差(mean±SD)表示, 应用SPSS11.0统计软件进行处理, 多组资料间比较采用单因素方差分析, P<0.05为有显著性差异.
大鼠ip STZ 3 d后开始出现多饮、多食、多尿症状, 模型建立后1 wk糖尿病大鼠出现精神萎靡, 活动迟缓; 至第9周时糖尿病大鼠仍有多饮、多食、多尿, 但明显消瘦、懒动, 毛色干枯, 无光泽. 实验期间大鼠死亡6只.
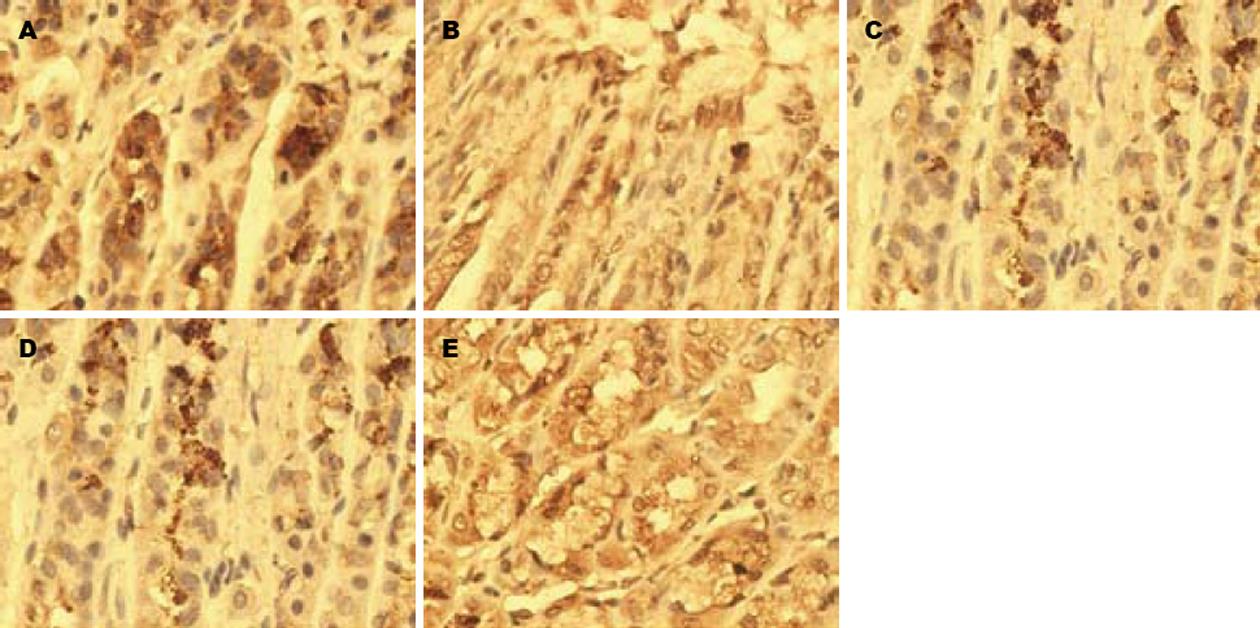
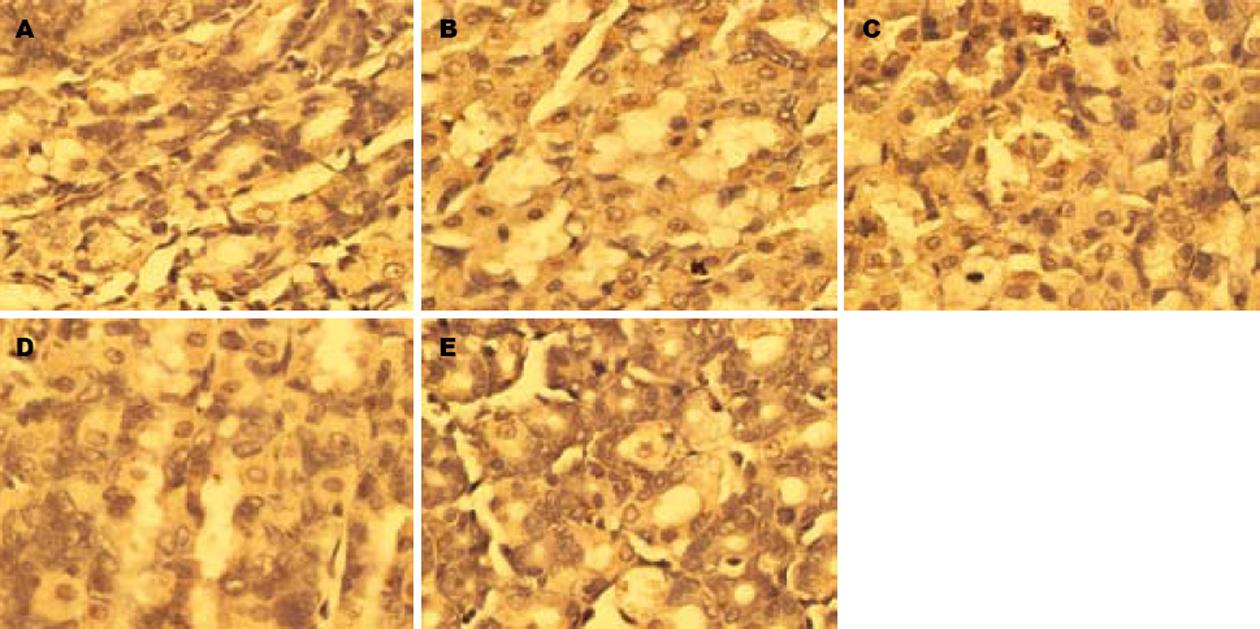
DM组大鼠胃排空率较NC组明显降低(q = 18.21, P<0.01); TEG各组大鼠胃排空率虽然也低于NC组(q = 8.54, P<0.01; q = 10.80, P<0.01; q = 14.75, P<0.01), 但较DM组明显增加(q = 9.70, P<0.01; q = 7.56, P<0.01; q = 3.28, P<0.05); 其中TEG-L组与TEG-M组大鼠胃排空率无明显差异(q = 2.20, P>0.05), 均高于TEG-H组(q = 6.32, P<0.01; q = 4.19, P<0.01)(表1).
| 分组 | n | 胃排空率(%) | Ghrelin积分光密度 | SP积分光密度 |
| NC | 10 | 68.35±2.07 | 43.514±5.323 | 16.383±2.275 |
| DM | 8 | 49.71±3.59b | 26.626±4.596b | 9.257±1.636b |
| TEG-L | 9 | 59.88±3.16bdf | 34.721±6.759ac | 13.548±1.078bde |
| TEG-M | 9 | 57.64±3.43bdf | 33.547±6.255bc | 13.952±1.246bde |
| TEG-H | 8 | 53.25±2.94bc | 35.141±5.987bc | 11.845±1.567bd |
如图1和表1所示, 大鼠胃底黏膜Ghrelin阳性染色主要位于固有层腺体内, 为棕黄色颗粒沉积. DM组大鼠胃黏膜腺体内Ghrelin阳性染色较NC组明显变淡, 其积分光密度较NC组显著降低(q = 8.61, P<0.01); 而TEG各组大鼠胃黏膜腺体内Ghrelin阳性染色强度与积分光密度均较DM组显著增加(q = 4.03, P<0.05; q = 3.45, P<0.05; q = 4.12, P<0.05), 但仍低于NC组(q = 4.63, P<0.05; q = 5.25, P<0.01; q = 4.27, P<0.01), 其中TEG-L、TEG-M和TEG-H 3组之间差异无显著性.
如图2和表1所示, 免疫组化染色显示大鼠胃窦组织SP阳性产物呈棕色沉淀, 在黏膜层、腺腔内及黏膜下层表达较多,而在肌层、肌间神经丛中表达较少. 图像分析结果表明, DM组大鼠胃窦组织SP阳性产物的积分光密度较NC组显著降低(q = 12.99, P<0.01); 而TEG各组大鼠胃窦组织SP阳性产物的积分光密度均较DM组显著增加(q = 7.64, P<0.01; q = 8.36, P<0.01; q = 4.48, P<0.01), 但仍低于NC组(q = 5.34, P<0.01; q = 4.58, P<0.01;
q = 8.28, P<0.01), 其中TEG-L组与TEG-M组大鼠胃窦组织SP阳性产物的积分光密度无明显差异(q = 0.74, P>0.05), 均高于TEG-H组(q = 3.03, P<0.05; q = 3.75, P<0.05).
大鼠ip STZ可选择性破坏胰腺β细胞, 制备的模型具有高血糖、体质量减轻、多饮、多食、多尿的特点, 可用于糖尿病慢性并发症的研究. 目前关于糖尿病患者胃液体排空研究的结果尚存在争论, 可表现为排空延迟、加速和无明显变化等, 可能与糖尿病的病程有关[4,6,21]. 而胃肠激素可通过血液循环以内分泌的形式作用于胃肠道平滑肌细胞相应的受体或作为肽能神经递质通过迷走神经介导, 在中枢和外周水平上对胃运动进行调节. 糖尿病长期高血糖引起的诸多胃肠激素分泌异常及调节失衡可导致胃动力学异常, 与糖尿病胃轻瘫的发病密切相关[1-4].
Ghrelin是近年来新发现的一种由28个氨基酸残基组成的脑肠肽, 主要由胃底部黏膜泌酸腺X/A细胞合成并分泌入血[12-13,17]. Ghrelin与其受体结合后通过中枢和(或)外周途径来调节胃肠运动, 表现出与胃动素类似的加速胃排空的作用[22-27]. Rauma et al[28]研究发现糖尿病小鼠胃肠道Ghrelin阳性细胞密度较正常对照组下降, 认为这种变化有助于解释糖尿病胃肠病变中的胃排空延迟和肠运动减慢. 而Murray et al[29]研究发现, 静脉给予Ghrelin可明显加快糖尿病胃轻瘫患者的胃排空. SP是调节胃肠运动的一种兴奋性神经递质, 可直接作用于平滑肌或间接通过释放乙酰胆碱引起胃肠道平滑肌收缩. 由于SP对胃平滑肌的兴奋作用大于对幽门括约肌的收缩作用, 因此可促进胃排空[19]. 在本实验中, 我们发现糖尿病大鼠模型建立后第9周时, DM组大鼠胃排空率较NC组明显降低, 同时DM组大鼠胃黏膜Ghrelin与胃窦组织SP的积分光密度也均较NC组显著降低, 因此糖尿病大鼠胃排空延迟可能与促运动的胃肠激素Ghrelin与SP的表达减少有关.
国外研究发现, 替加色罗作为一种5-羟色胺4(5-HT4)受体部分激动剂可促进健康志愿者、胃轻瘫及消化不良患者的胃排空, 减少餐后胃内潴留[20,30]. James et al[31]研究发现糖尿病胃轻瘫小鼠胃底运动减弱而幽门收缩增强是糖尿病胃排空延迟的重要原因之一; 替加色罗对正常小鼠和糖尿病小鼠都有促进胃收缩的效应, 且胃底的收缩要比胃窦明显. 而Crowell et al[32]通过实验证实低剂量的替加色罗(0.1 mg/kg)ip较中、高剂量更能明显改善糖尿病小鼠延迟的胃排空.
在本实验中, 我们发现TEG各组大鼠胃排空率均较DM组明显增加, 而胃黏膜Ghrelin与胃窦组织SP的积分光密度也均较DM组增加, 说明替加色罗可能通过促进胃组织Ghrelin与SP的表达释放来改善糖尿病大鼠延迟的胃排空. 替加色罗可选择性激活胃肠道的5-HT4受体, 通过胆碱能通路释放降钙素基因相关肽(CGRP)、P物质(SP)、血管活性肠肽(VIP)及乙酰胆碱(Ach)等神经递质, 触发胃肠蠕动反射、减少时相性收缩、增加推进性运动[33]. 同时我们还得到了与Crowell et al[32]相似的结论, 即低、中剂量的替加色罗较高剂量更能明显改善糖尿病大鼠延迟的胃排空, 其原因可能与以下几方面有关: (1)替加色罗可剂量依赖性的增加SP的表达释放. 较多的SP可使幽门括约肌收缩过强, 影响了胃窦、十二指肠的协调运动. (2)替加色罗对胃排空的促进作用可能不直接依赖于血药浓度, 而取决于替加色罗在肠肌丛的生物利用度[32]. (3)高剂量替加色罗对胃平滑肌受体起抑制作用, 而低剂量替加色罗可激活肠肌丛特定的神经元[34]. 此外, TEG各组大鼠胃黏膜Ghrelin积分光密度无明显差异, 提示替加色罗促进Ghrelin表达的机制与SP不同, 可能不依赖于胆碱能通路, 有待于进一步研究.
通过以上研究我们认为, 替加色罗可通过促进胃组织Ghrelin与SP的表达释放来改善糖尿病大鼠延迟的胃排空. 对其作用机制的进一步研究有助于更好的探讨糖尿病胃轻瘫的治疗方法, 推动新的促胃肠动力药物的开发与应用.
糖尿病慢性并发症已成为糖尿病患者致残致死的主要原因, 对于糖尿病胃肠动力紊乱及其危害往往被忽视. 据报道, 糖尿病胃轻瘫发生率高达30%-50%, 该并发症不仅影响糖尿病患者的生活质量, 还可以造成饮食及口服降糖药的吸收和排空障碍, 导致无规律的血糖波动, 从而影响患者的营养状况和治疗效果.
相关研究发现约半数糖尿病患者存在胃排空障碍. 胃固体排空的核素测定表明,不同阶段糖尿病的胃排空功能不同, 有胃肠症状和(或)合并其他脏器并发症的糖尿病患者的胃排空延迟, 胃液体排空则有排空延迟、加速和无明显变化等. 目前认为, 糖尿病患者发生胃排空障碍的机制主要认为与高血糖及其导致的自主神经病变、胃肠平滑肌变性、Cajal间质细胞异常、胃肠激素分泌调节失衡、微血管病变以及代谢紊乱等有关.
糖尿病胃肠功能障碍的治疗一直是困扰临床医生的一个难题, 药物治疗仍然是一些应用已久的促动力药. 胃复安仍是唯一的由FDA批准的治疗糖尿病胃轻瘫的药物, 多潘立酮有较高的安全性和较少的迟发性运动障碍.红霉素由于具有一定的快速过敏和心脏毒性等问题使其应用价值受到了限制, 小剂量的三环类抗抑郁药物常被用来控制恶心或呕吐.
本文以动物模型为研究对象, 实验条件控制严格, 其实验方法为国际公认. 药物的剂量分组合理, 有利于观察到最为合理的药物剂量, 为探索治疗糖尿病胃肠功能障碍的方法提供了新的研究思路.
本文研究发现替加色罗能够改善糖尿病胃轻瘫的胃排空, 并在其作用机制上进行了探讨, 为临床治疗提供了有益的帮助, 为开发新型的胃肠动力药物, 用于治疗糖尿病胃肠功能障碍奠定了基础.
本文探讨了5-羟色胺受体部分激动剂替加色罗对糖尿病大鼠胃排空功能及Ghrelin、P物质表达的影响. 结果表明替加色罗既可促进糖尿病大鼠胃排空, 又可促进胃组织Ghrelin与SP的表达, 有一定的参考价值.
编辑: 何燕 电编:郭海丽
| 1. | Kong MF, Horowitz M. Diabetic gastroparesis. Diabet Med. 2005;22 Suppl 4:13-18. [PubMed] [DOI] |
| 2. | Smith DS, Ferris CD. Current concepts in diabetic gastroparesis. Drugs. 2003;63:1339-1358. [PubMed] [DOI] |
| 3. | Horowitz M, Su YC, Rayner CK, Jones KL. Gastroparesis: prevalence, clinical significance and treatment. Can J Gastroenterol. 2001;15:805-813. [PubMed] [DOI] |
| 4. | Kong MF, Horowitz M. Gastric emptying in diabetes mellitus: relationship to blood-glucose control. Clin Geriatr Med. 1999;15:321-338. [PubMed] |
| 5. | Stacher G. Diabetes mellitus and the stomach. Diabetologia. 2001;44:1080-1093. [PubMed] [DOI] |
| 6. | Horowitz M, O'Donovan D, Jones KL, Feinle C, Rayner CK, Samsom M. Gastric emptying in diabetes: clinical significance and treatment. Diabet Med. 2002;19:177-194. [PubMed] [DOI] |
| 7. | Darwiche G, Almer LO, Bjorgell O, Cederholm C, Nilsson P. Delayed gastric emptying rate in Type 1 diabetics with cardiac autonomic neuropathy. J Diabetes Complications. 2001;15:128-134. [PubMed] [DOI] |
| 8. | Rayner CK, Samsom M, Jones KL, Horowitz M. Relationships of upper gastrointestinal motor and sensory function with glycemic control. Diabetes Care. 2001;24:371-381. [PubMed] [DOI] |
| 9. | Kockar MC, Kayahan IK, Bavbek N. Diabetic gastroparesis in association with autonomic neuropathy and microvasculopathy. Acta Med Okayama. 2002;56:237-243. [PubMed] |
| 10. | Duby JJ, Campbell RK, Setter SM, White JR, Rasmussen KA. Diabetic neuropathy: an intensive review. Am J Health Syst Pharm. 2004;61:160-173; quiz 175-176. [PubMed] |
| 11. | Vazeou A, Papadopoulou A, Papadimitriou A, Kitsou E, Stathatos M, Bartsocas CS. Autonomic neuropathy and gastrointestinal motility disorders in children and adolescents with type 1 diabetes mellitus. J Pediatr Gastroenterol Nutr. 2004;38:61-65. [PubMed] [DOI] |
| 12. | Nakazato M, Murakami N, Date Y, Kojima M, Matsuo H, Kangawa K, Matsukura S. A role for ghrelin in the central regulation of feeding. Nature. 2001;409:194-198. [PubMed] [DOI] |
| 13. | Asakawa A, Inui A, Kaga T, Yuzuriha H, Nagata T, Ueno N, Makino S, Fujimiya M, Niijima A, Fujino MA. Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin. Gastroenterology. 2001;120:337-345. [PubMed] [DOI] |
| 14. | Levin F, Edholm T, Ehrstrom M, Wallin B, Schmidt PT, Kirchgessner AM, Hilsted LM, Hellstrom PM, Naslund E. Effect of peripherally administered ghrelin on gastric emptying and acid secretion in the rat. Regul Pept. 2005;131:59-65. [PubMed] [DOI] |
| 15. | Kitazawa T, De Smet B, Verbeke K, Depoortere I, Peeters TL. Gastric motor effects of peptide and non-peptide ghrelin agonists in mice in vivo and in vitro. Gut. 2005;54:1078-1084. [PubMed] [DOI] |
| 16. | Fujino K, Inui A, Asakawa A, Kihara N, Fujimura M, Fujimiya M. Ghrelin induces fasted motor activity of the gastrointestinal tract in conscious fed rats. J Physiol. 2003;550:227-240. [PubMed] [DOI] |
| 17. | Masuda Y, Tanaka T, Inomata N, Ohnuma N, Tanaka S, Itoh Z, Hosoda H, Kojima M, Kangawa K. Ghrelin stimulates gastric acid secretion and motility in rats. Biochem Biophys Res Commun. 2000;276:905-908. [PubMed] [DOI] |
| 18. | Tack J, Depoortere I, Bisschops R, Delporte C, Cou-lie B, Meulemans A, Janssens J, Peeters T. Influence of ghrelin on interdigestive gastrointestinal motility in humans. Gut. 2006;55:327-333. [PubMed] [DOI] |
| 19. | Schmidt PT, Holst JJ. Tachykinins in regulation of gastric motility and secretion. Cell Mol Life Sci. 2000;57:579-588. [PubMed] [DOI] |
| 20. | Degen L, Matzinger D, Merz M, Appel-Dingemanse S, Osborne S, Luchinger S, Bertold R, Maecke H, Beglinger C. Tegaserod, a 5-HT4 receptor partial agonist, accelerates gastric emptying and gastrointestinal transit in healthy male subjects. Aliment Pharmacol Ther. 2001;15:1745-1751. [PubMed] [DOI] |
| 21. | Miyamoto Y, Yoneda M, Morikawa A, Itoh H, Makino I. Gastric neuropeptides and gastric motor abnormality in streptozotocin-induced diabetic rats: observation for four weeks after streptozotocin. Dig Dis Sci. 2001;46:1596-1603. [PubMed] [DOI] |
| 22. | Peeters TL. Central and peripheral mechanisms by which ghrelin regulates gut motility. J Physiol Pharmacol. 2003;54 Suppl 4:95-103. [PubMed] |
| 23. | Shuto Y, Shibasaki T, Wada K, Parhar I, Kamegai J, Sugihara H, Oikawa S, Wakabayashi I. Generation of polyclonal antiserum against the growth hormone secretagogue receptor (GHS-R): evidence that the GHS-R exists in the hypothalamus, pituitary and stomach of rats. Life Sci. 2001;68:991-996. [PubMed] |
| 24. | Dass NB, Munonyara M, Bassil AK, Hervieu GJ, Osbourne S, Corcoran S, Morgan M, Sanger GJ. Growth hormone secretagogue receptors in rat and human gastrointestinal tract and the effects of ghrelin. Neuroscience. 2003;120:443-453. [PubMed] [DOI] |
| 25. | Kamegai J, Tamura H, Shimizu T, Ishii S, Sugihara H, Wakabayashi I. Central effect of ghrelin, an endogenous growth hormone secretagogue, on hypothalamic peptide gene expression. Endocrinology. 2000;141:4797-4800. [PubMed] [DOI] |
| 26. | Trudel L, Tomasetto C, Rio MC, Bouin M, Plourde V, Eberling P, Poitras P. Ghrelin/motilin-related peptide is a potent prokinetic to reverse gastric postoperative ileus in rat. Am J Physiol Gastrointest Liver Physiol. 2002;282:G948-952. [PubMed] [DOI] |
| 27. | Tack J, Depoortere I, Bisschops R, Verbeke K, Janssens J, Peeters T. Influence of ghrelin on gastric emptying and meal-related symptoms in idiopathic gastroparesis. Aliment Pharmacol Ther. 2005;22:847-853. [PubMed] [DOI] |
| 28. | Rauma J, Spangeus A, El-Salhy M. Ghrelin cell density in the gastrointestinal tracts of animal models of human diabetes. Histol Histopathol. 2006;21:1-5. [PubMed] |
| 29. | Murray CD, Martin NM, Patterson M, Taylor SA, Ghatei MA, Kamm MA, Johnston C, Bloom SR, Emmanuel AV. Ghrelin enhances gastric emptying in diabetic gastroparesis: a double blind, placebo controlled, crossover study. Gut. 2005;54:1693-1698. [PubMed] [DOI] |
| 30. | Degen L, Petrig C, Studer D, Schroller S, Beglinger C. Effect of tegaserod on gut transit in male and female subjects. Neurogastroenterol Motil. 2005;17:821-826. [PubMed] [DOI] |
| 31. | James AN, Ryan JP, Crowell MD, Parkman HP. Regional gastric contractility alterations in a diabetic gastroparesis mouse model: effects of cholinergic and serotoninergic stimulation. Am J Physiol Gastrointest Liver Physiol. 2004;287:G612-619. [PubMed] [DOI] |
| 32. | Crowell MD, Mathis C, Schettler VA, Yunus T, Lacy BE. The effects of tegaserod, a 5-HT receptor agonist, on gastric emptying in a murine model of diabetes mellitus. Neurogastroenterol Motil. 2005;17:738-743. [PubMed] [DOI] |
| 33. | Lacy BE, Yu S. Tegaserod: a new 5-HT4 agonist. J Clin Gastroenterol. 2002;34:27-33. [PubMed] [DOI] |
| 34. | Prins NH, Van Haselen JF, Lefebvre RA, Briejer MR, Akkermans LM, Schuurkes JA. Pharmacological characterization of 5-HT4 receptors mediating relaxation of canine isolated rectum circular smooth muscle. Br J Pharmacol. 1999;127:1431-1437. [PubMed] [DOI] |