修回日期: 2007-09-03
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 观察启膈散及其活血和化痰2个拆方对原代培养的食管癌细胞血小板衍生生长因子受体(PDGFR)和磷脂酶C-γ1(PLC-γ1)酪氨酸磷酸化的影响, 以探讨启膈散治疗食管癌的作用机制.
方法: 从外科切除的原发性食管癌组织中采集食管上皮细胞进行原代培养, 加入PDGF和启膈散及其活血和化痰2个拆方的水提物, 免疫印迹法(Western blotting)测定PDGFR-PLC-γ1蛋白表达和酪氨酸磷酸化水平.
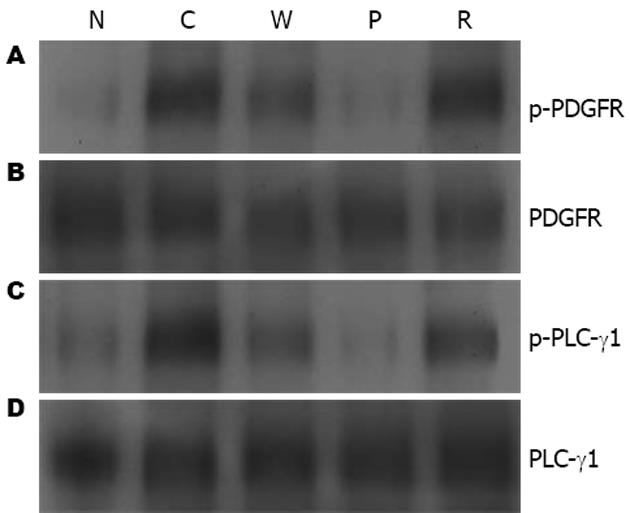
结果: 用PDGF-BB刺激4 min和启膈散及其拆方处理15 min前后, 原代培养食管癌细胞PDGFRβ和PLC-γ1蛋白表达没有变化; 但PDGF-BB刺激后PDGFRβ和PLC-γ1蛋白酪氨酸磷酸化明显增强, 启膈散及其拆方能不同程度地降低其蛋白磷酸化水平, 其中以活血组作用最好, 全方组次之.
结论: 食管癌病变与PDGFR-PLC-γ1蛋白酪氨酸磷酸化增强有关, 启膈散及其拆方通过抑制PDGFR-PLC-γ1酪氨酸磷酸化从而抑制生长信号转导是其治疗食管癌重要机制.
引文著录: 司富春. 启膈散及其拆方抑制原代培养食管癌细胞PDGFR-PLC-γ1酪氨酸的磷酸化. 世界华人消化杂志 2007; 15(26): 2821-2824
Revised: September 3, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: To investigate the signaling pathways involved in the action of Qigesan in treating esophageal cancer, the effects of Qigesan and its different individual components on tyrosine phosphorylation of PDGFR-PLC-γ1 were studied in primary cultured esophageal carcinoma cells.
METHODS: Cells from surgically resected human esophageal carcinoma specimens were primary cultured and treated with PDGF and the water extracts from Qigesan and its individual components. Total protein and tyrosine phosphorylated levels of PDGFR and PLC-γ1 were assessed by Western blotting.
RESULTS: There was no difference in the levels of PDGFRβ and PLC-γ1 proteins before and after treatment of primary cultured esophageal carcinoma cells with water extracts from Qigesan and its separated components for 15 minutes and PDGF-BB for 4 minutes. The tyrosine phosphorylation levels of PDGFRβ and PLC-γ1 were markedly increased by stimulation with PDGF-BB, and markedly decreased in cells treated with Qigesan and its separated components, which showed the best effects for promoting blood circulation group, while the second best was a whole prescription of Qigesan.
CONCLUSION: Inhibiting growth signaling via inhibition of tyrosine phosphorylation of PDGFR and PLC-γ1 is an important mechanism in the treatment of esophageal cancer with Qigesan and its separated components.
- Citation: Si FC. Inhibitory effects of Qigesan and its individual components on tyrosine phosphorylation of PDGFR-PLC-γ1 in primary cultured esophageal carcinoma cell. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2821-2824
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2821.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2821
血小板衍生生长因子(platelet-derived growth factor, PDGFs)包括PDGF-AA、PDGF-AB、 PDGF-BB、 PDGF-CC和PDGF-DD, 分别通过与相对应的受体(platelet-derived growth factor receptorα/β, PDGFR)结合而对细胞发生作用[1-4]. PDGFR有1个细胞外配体结合区、1个跨膜区和1个细胞内区, 细胞内区为酪氨酸蛋白激酶[5]. PDGF与细胞表面受体结合引起受体聚合成二聚体和PDGF受体多肽链上特异酪氨酸残基磷酸化[6]. 受体自磷酸化激活其酪氨酸激酶活性, 向细胞内底物传导促细胞有丝分裂的信号[7]. 这些磷酸化的酪氨酸残基是细胞蛋白质结合的位点, 这种结合是通过与效应蛋白质的SH2区相互作用而实现[8]. PDGF受体的底物包括磷脂酶C-γ1(PLC-γ1)、ras GTPase激活蛋白、PI3K调节单位P85、蛋白酪氨酸激酶P60src家族成员、Nck、Grb-2等[9-10].
PDGF及其受体参与各种各样生理活动, 例如胚胎发育和伤口愈合. PDGF异常高的活性在某些病理生理发生中起关键作用[11]. PDGF B链对急性转染猿猴肉瘤病毒的sis癌基因是必需的, PDGF类生长因子在猿肉瘤感染细胞或转染sis癌基因的细胞中表达, 由于对PDGF受体持续的自分泌刺激, 导致这些细胞转型[12]. PDGF和其受体在多种肿瘤如肺癌、前列腺癌、视网膜神经细胞瘤中起重要作用, 参与了肿瘤的自分泌刺激生长、刺激血管生成和转移[13].
PLC-γ1作为PDGF受体细胞内底物, 被PDGF受体酪氨酸磷酸化激活, 是PDGF产生促细胞有丝分裂信号的重要通路[14-15]. 我们研究发现食管癌组织中PLC-γ1和PDGFR受体超量表达, PLC-γ1介导的信号转导增强, 中医复方启膈散及其拆方可以抑制人食管癌肿瘤细胞Eca109细胞和原代培养的人食管癌细胞PLC-γ1介导的信号作用, 并能降低PDGFR受体表达. 为了深入研究PDGF-PLC-γ1信号转导在食管癌病变中的作用和启膈散的作用机制, 我们观察了启膈散及其拆方对原代培养食管癌细胞PDGFR- PLC-γ1酪氨酸磷酸化的影响.
丹参、郁金、砂仁壳、沙参、贝母、茯苓购于河南中医学院第三附属医院, 经鉴定皆为正品. 分为全方组(W)、活血组(P)(丹参、郁金、砂仁壳)、化痰组(R)(沙参、贝母、茯苓), 每味药10 g, 煎煮、浓缩、5000 g离心、0.22 μm滤膜过滤, 取部分干燥称重, 换算出浓度, 用时调至所需浓度. 人食管癌组织来源于河南省肿瘤医院, 经病理确诊的患者, 病理类型为鳞癌. RPMI 1640培养基(Gibco公司); 胎牛血清(Hyclone公司); PMSF和Leupeptin (Amresco公司); 丙烯酰胺(Biomol公司); 胰蛋白酶、山羊抗小鼠IgG-HRP和山羊抗兔IgG-HRP(华美公司); ECL试剂盒(Santa Cruz公司); PLC-γ1 mAb(韩国浦项科技大学国家信号传导网络实验室惠赠); rhPDGF-BB(R&D公司); PDGFRβ多克隆抗体(Santa Cruz公司); 抗phosphotyrosine mAb 4G10(UBI公司); 考马斯亮蓝G250(Amresco公司). Heraeus细胞培养箱(德国 Kendro公司); 倒置显微镜(Zeiss公司); 紫外分光光度计(Thermo公司); SG-603生物安全柜(Bake公司); ELx800型酶标仪(Bio-Tek公司); 蛋白电泳系统(Bio-Rad公司).
1.2.1 细胞培养: 外科切除的原发性食管癌组织, 从肉眼可见的肿瘤组织和标本末端2个部位采集食管上皮组织, 用不含血清的RPMI 1640培养液10 mL冲洗3次, 去除其表面的凝血块及坏死组织, 一部分组织直接用于检测, 一部分用于体外培养. 将体外培养的组织剪成泥状, 加入5 mL trypsine消化液, 37℃消化15 min, 用60目不锈钢网筛过滤, 1000 g离心10 min, 用10 mL不含血清的RPMI培养液洗3次, 台盘兰染色检测活细胞数在90%以上, 用含100 mL/L胎牛血清的RPMI培养液悬浮细胞, 按实验分组要求分配于96孔培养板中和Φ60培养皿中, 37℃、50 mL/L CO2培养箱培养.
1.2.2 PDGFR-PLC-γ1蛋白表达及酪氨酸磷酸化水平检测: Western blot[16]检测蛋白表达. 用启膈散及其拆方水提物处理15 min后, 然后用PDGF-BB(30 µg/L)处理4 min, 再用裂解液裂解细胞(裂解液组成: 20 mmol/L HEPES, pH7.2, 100 mL/L甘油, 150 mmol/L NaCl, 10 mL/L TritonX-100, 1 mmol/L Na3VO4, 10 mg/L Leupeptin和1 mmol/L PMSF), 提取蛋白, 用Bradford法测定蛋白浓度. 用80 g/L SDS-PAGE电泳, 同一个凝胶左右上两套同样样品. 分离的蛋白质转移到硝酸纤维素膜, 丽春红染色后, 将硝酸纤维素膜剪成左右两部分. 50 g/L脱脂奶粉TTBS溶液封闭滤膜30 min(TTBS: 10 mmol/L, Tris, pH7.6, 150 mmol/L NaCl, 0.5 mL/L Tween 20), 一部分用PLC-γ1 mAb或PDGFRβ多抗反应, 另一部分用抗磷酸酪氨酸mAb(4G10)反应, 再用辣根过氧化物酶偶联的抗鼠IgG抗体或抗兔IgG抗体检测和ECL底物显影.
启膈散及其拆方抑制PDGFR-PLC-γ1酪氨酸磷酸化Western blot分析显示用PDGF-BB刺激4 min和用启膈散及其拆方处理15 min前后, 原代培养食管癌细胞PDGFRβ和PLC-γ1蛋白表达没有变化; 但PDGF-BB刺激后PDGFR-PLC-γ1蛋白酪氨酸磷酸化明显增强, 应用启膈散及其拆方处理的原代培养食管癌细胞磷酸化水平与对照组相比显著降低. 说明启膈散及其拆方对PDGFR-PLC-γ1蛋白酪氨酸磷酸化具有不同程度的抑制作用, 其中以P组作用最好, W组次之(图1).
PDGFR是自磷酸化的酪氨酸蛋白激酶, 与其配体结合后, 受体发生空间构象改变, 酪氨酸残基相互作用发生磷酸化而激活, 并磷酸化多种下游分子, 启动级联信号传导[17]. PLC-γ1在肿瘤发生和发展中起关键作用, 其超量表达和激活引起肿瘤发生、浸润和转移[18]. PLC-γ1通过SH2区与PDGFR相互作用, 是以PDGFR为中心的多级蛋白质复合物的一个重要组成成分, 直接被PDGFR酪氨酸残基磷酸化而活化. PLC-γ1酶活化后, 催化PIP2分解成产物IP3和DAG作为第2信使物质在细胞内发生作用, IP3能引起细胞内钙库的释放, DAG能激活PKC[19-20]. 通过这两条通路和其他未知通路从而激活多种细胞反应. PDGFR-PLC-γ1酪氨酸磷酸化是PDGFR介导的PDGFR-PLC-γ1信号传导的前提条件.
食管癌细胞以自分泌PDGF的形式促进生存和增殖[21]. 我们研究发现, 食管癌组织中PDGFR超量表达、PDGFR-PLC-γ1磷酸化水平升高、PLC-γ1介导的信号转导增强, 中医复方启膈散及其拆方可以抑制PDGFR-PLC-γ1的表达, 减弱PLC-γ1介导的信号转导. 为了进一步研究该方对PDGF受体介导的生长信号转导的影响, 我们用rhPDGF-BB刺激原代培养的食管癌细胞, 观察启膈散及其拆方对其PDGFR-PLC-γ1酪氨酸磷酸化的作用, 发现启膈散及其拆方可以不同程度地抑制PDGFR-PLC-γ1的酪氨酸磷酸化, 用中药短时间处理食管癌细胞, 并不影响PDGFR-PLC-γ1蛋白表达. 上述结果表明启膈散及其拆方可以通过抑制酪氨酸蛋白激酶受体的酪氨酸磷酸化而抑制PLC-γ1介导的信号转导, 这也是启膈散治疗食管癌的部分重要机制.
自1989年报道PLC-γ1是PDGF受体酪氨酸激酶的底物以来,已发现PDGFRPLC-γ1信号转导在多种生理和病理过程中起关键作用, 已成为肿瘤病理和药物研究重要的信号转导通路, 但有关在食管癌病变中的作用尚未报道.
PDGFR-PLC-γ1信号转导在对肝细胞、成骨肉瘤细胞、肾小球膜细胞和星状细胞等研究中已有报道, PDGFR-PLC-γ1信号转导机制除已知的PDGFR受体酪氨酸激酶使PLC-γ1酪氨酸磷酸化外, 近年还发现PDGFR与PLC-γ1直接结合的相互作用途径.
本文首次发现食管癌病变与PDGFR-PLCγ1蛋白酪氨酸磷酸化增强有关, 启膈散及其拆方通过抑制PDGFR-PLCγ1酪氨酸磷酸化从而抑制生长信号转导是其治疗食管癌的重要机制.
本文对食管癌细胞PDGFR-PLC-γ1信号转导异常的发现可以为食管癌病变提供新的认识, 为研制药物提供新的靶点.
蛋白酪氨酸激酶是一类催化ATP上γ-磷酸转移到蛋白酪氨酸残基上的激酶, 能催化多种底物蛋白质酪氨酸残基磷酸化, 在细胞生长、增殖、分化中具有重要作用. 根据PTK是否存在于细胞膜受体可将其分成非受体型和膜受体型.
本文研究了启膈散及其拆方抑制原代培养食管癌细胞PDGFRPLCγ1酪氨酸磷酸化, 设计合理,分析有据, 对基础研究有一定的参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Alvarez RH, Kantarjian HM, Cortes JE. Biology of platelet-derived growth factor and its involvement in disease. Mayo Clin Proc. 2006;81:1241-1257. [PubMed] [DOI] |
| 2. | Ostman A. PDGF receptors-mediators of autocrine tumor growth and regulators of tumor vasculature and stroma. Cytokine Growth Factor Rev. 2004;15:275-286. [PubMed] [DOI] |
| 3. | Heldin CH, Westermark B. Mechanism of action and in vivo role of platelet-derived growth factor. Physiol Rev. 1999;79:1283-1316. [PubMed] |
| 4. | Fredriksson L, Li H, Eriksson U. The PDGF family: four gene products form five dimeric isoforms. Cytokine Growth Factor Rev. 2004;15:197-204. [PubMed] [DOI] |
| 5. | Srinivasan DM, Kapoor M, Kojima F, Crofford LJ. Growth factor receptors: implications in tumor biology. Curr Opin Investig Drugs. 2005;6:1246-1249. [PubMed] |
| 6. | Hubbard SR, Miller WT. Receptor tyrosine kinases: mechanisms of activation and signaling. Curr Opin Cell Biol. 2007;19:117-123. [PubMed] [DOI] |
| 7. | Tallquist M, Kazlauskas A. PDGF signaling in cells and mice. Cytokine Growth Factor Rev. 2004;15:205-213. [PubMed] [DOI] |
| 8. | Koch CA, Anderson D, Moran MF, Ellis C, Pawson T. SH2 and SH3 domains: elements that control interactions of cytoplasmic signaling proteins. Science. 1991;252:668-674. [PubMed] [DOI] |
| 9. | Cantley LC, Auger KR, Carpenter C, Duckworth B, Graziani A, Kapeller R, Soltoff S. Oncogenes and signal transduction. Cell. 1991;64:281-302. [PubMed] [DOI] |
| 10. | Schlesinger TK, Demali KA, Johnson GL, Kazlauskas A. Platelet-derived growth factor-dependent association of the GTPase-activating protein of Ras and Src. Biochem J. 1999;344 Pt 2:519-526. [PubMed] [DOI] |
| 11. | Betsholtz C. Biology of platelet-derived growth factors in development. Birth Defects Res C Embryo Today. 2003;69:272-285. [PubMed] [DOI] |
| 12. | Doolittle RF, Hunkapiller MW, Hood LE, Devare SG, Robbins KC, Aaronson SA, Antoniades HN. Simian sarcoma virus onc gene, v-sis, is derived from the gene (or genes) encoding a platelet-derived growth factor. Science. 1983;221:275-277. [PubMed] [DOI] |
| 13. | Jones AV, Cross NC. Oncogenic derivatives of platelet-derived growth factor receptors. Cell Mol Life Sci. 2004;61:2912-2923. [PubMed] [DOI] |
| 14. | Valius M, Kazlauskas A. Phospholipase C-gamma 1 and phosphatidylinositol 3 kinase are the downstream mediators of the PDGF receptor's mitogenic signal. Cell. 1993;73:321-334. [PubMed] [DOI] |
| 15. | Kim HK, Kim JW, Zilberstein A, Margolis B, Kim JG, Schlessinger J, Rhee SG. PDGF stimulation of inositol phospholipid hydrolysis requires PLC-gamma 1 phosphorylation on tyrosine residues 783 and 1254. Cell. 1991;65:435-441. [PubMed] [DOI] |
| 16. | Sambrook J, Russell DW. Molecular Cloning. third edition. New York: Cold Spring Harbor Laboratory Press 2001; 16: 25-26. |
| 17. | Funa K, Uramoto H. Regulatory mechanisms for the expression and activity of platelet-derived growth factor receptor. Acta Biochim Pol. 2003;50:647-658. [PubMed] |
| 18. | Wells A, Grandis JR. Phospholipase C-gamma1 in tumor progression. Clin Exp Metastasis. 2003;20:285-290. [PubMed] |
| 19. | Kim MJ, Si F, Kim SJ, Hong SB, Hwang JI, Lee HJ, Lee SJ, Chang JS, Lee YH, Ryu SH. The SH2-SH2-SH3 domain of phospholipase C-gamma1 directly binds to translational elongation factor-1alpha. Mol Cells. 1999;9:631-637. [PubMed] |
| 20. | Piccolo E, Innominato PF, Mariggio MA, Maffucci T, Iacobelli S, Falasca M. The mechanism involved in the regulation of phospholipase Cgamma1 activity in cell migration. Oncogene. 2002;21:6520-6529. [PubMed] [DOI] |
| 21. | Liu YC, Chen SC, Chang C, Leu CM, Hu CP. Platelet-derived growth factor is an autocrine stimulator for the growth and survival of human esophageal carcinoma cell lines. Exp Cell Res. 1996;228:206-211. [PubMed] [DOI] |