修回日期: 2007-08-13
接受日期: 2007-09-11
在线出版日期: 2007-09-18
目的: 探讨慢性乙型肝炎患者外周血CD4+CD25+T调节细胞(regulatory T cell, Treg)的变化及其意义.
方法: 采用流式细胞术对66例乙肝病毒(hepatitis B virus, HBV)感染者和19例健康对照者外周血CD4+CD25+Treg细胞进行检测, 并观察CD4+CD25+Treg细胞与患者总胆红素(total bilirubin, TBIL)、凝血酶原活动度(prothrombin activity, PTA)和病毒复制指标HBV DNA水平的关系. 免疫组化检测叉状头/翅膀状螺旋转录因子(forkhead/winged helix transcription factor, FOXP3)蛋白的表达水平.
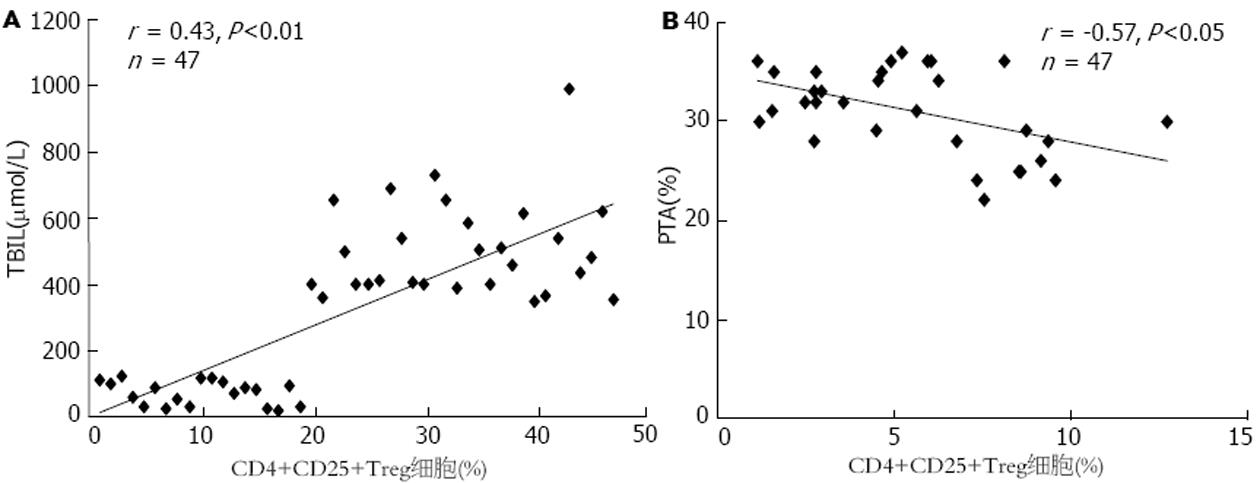
结果: 慢性重型肝炎组CD4+CD25+Treg细胞4.80%±1.50%分别高于慢性肝炎组1.67%±0.87%、HBV携带者组0.53%±0.37%和正常对照组0.50%±0.34%, (P<0.01); 慢性肝炎组与HBV携带者组和正常对照组相比有显著性差异(P<0.01); 慢性重型乙型肝炎患者和慢性乙型肝炎患者FOXP3蛋白表达也相应增高, 且与CD4+CD25+Treg细胞的变化相平行. CD4+CD25+Treg细胞的变化与TBIL的变化成正相关(r = 0.43, P<0.01), 与PTA的变化成负相关(r = -0.57, P<0.05), 与HBV-DNA水平的变化没有相关性(r = 0.22, P>0.05).
结论: 在慢性乙型肝炎发病过程中, CD4+CD25+Treg细胞水平相应增高, FOXP3蛋白变化与CD4+CD25+Treg细胞的改变相
平行.
引文著录: 沈俊辉, 李宁, 范学工. 慢性乙型肝炎患者CD4+CD25+Treg细胞的检测及意义. 世界华人消化杂志 2007; 15(26): 2790-2795
Revised: August 13, 2007
Accepted: September 11, 2007
Published online: September 18, 2007
AIM: To investigate the frequency of CD4+CD25+ regulatory T cells (Tregs) in peripheral blood of patients with chronic hepatitis B (CHB) and those with chronic severe hepatitis B (CSHB).
METHODS: Peripheral blood mononuclear cells (PBMCs) from 19 patients with CHB, 28 with CSHB, 19 hepatitis B carriers, and 19 healthy controls were analyzed for Treg frequency using flow cytometry. The expression of forkhead/winged helix transcription factor (FOXP3) protein in PBMCs was examined by immunohistochemistry. The correlations between Treg frequency and total bilirubin (TBIL), prothrombin activity (PTA) or HBV-DNA were also analyzed.
RESULTS: Results were evaluated for Tregs/PBMCs. The number of Tregs in patients with CSHB (4.80% ± 1.50%) significantly exceeded that in CHB (1.67% ± 0.87%), hepatitis B carriers (0.59% ± 0.37%) and normal controls (0.50% ± 0.34%) (P < 0.01). The same results were found between CHB and hepatitis B carriers as well as normal controls (P < 0.01). The expression of FOXP3 protein also increased in CSHB and CHB, which paralleled the variation in the number of Tregs. The variation in the number of Tregs correlated positively with that of TBIL (r = 0.43, P < 0.01) but negatively with that of PTA (r = -0.57, P < 0.05). There was no correlation between the difference in the number Tregs and that of HBV DNA levels (r = 0.22, P > 0.05).
CONCLUSION: The results indicate that variations in the number of Tregs are the result of excessive immune and inflammatory reactions. However, the function of Tregs in CSHB and CHB may be defective. The expression of FOXP3 protein also increases in CSHB and CHB patients, paralleling the variations in the number of Tregs.
- Citation: Shen JH, Li N, Fan XG. Significance of CD4+CD25+ regulatory T cells in peripheral blood of chronic hepatitis B patients. Shijie Huaren Xiaohua Zazhi 2007; 15(26): 2790-2795
- URL: https://www.wjgnet.com/1009-3079/full/v15/i26/2790.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i26.2790
CD4+CD25+T调节细胞(regulatory T cell, Treg)是近年来发现的一种新型免疫抑制性调节细胞, 1995年由Sakaguchi et al[1]首次报道. CD4+CD25+Treg细胞具有低反应性和免疫抑制性两大功能特征[2]. 而叉状头/翅膀状螺旋转录因子[3](forkhead/winged helix transcription factor, FOXP3)在CD4+CD25+Treg细胞上特异性表达, 是CD4+CD25+Treg细胞发育和产生功能效应的主要因素.
基于CD4+CD25+Treg细胞独特的免疫效应, 我们认为在慢性乙型肝炎发病过程中, CD4+CD25+Treg对机体的免疫反应可能起着一定的调节作用. 因此, 本研究旨在通过检测慢性乙型肝炎患者CD4+CD25+Treg细胞数量及FOXP3的表达, 来探讨CD4+CD25+Treg细胞在慢性乙型肝炎发病机制中的意义.
2006-06/12湘雅医院感染科门诊及住院乙型肝炎病毒(hepatitis B virus, HBV)感染者66例, 男46例, 女20例, 年龄17-69(平均43)岁. 慢性乙型肝炎组19例, 慢性重型乙型肝炎组28例, HBV携带者组19例. 另收集健康志愿者组19例, 作为正常对照. 诊断符合2000-09中华传染病与寄生虫病学分会、肝病学分会西安会议标准[4]. 排除其他病毒性肝炎、慢性酒精性肝病、药物性肝炎、自身免疫性肝病、遗传性肝病等; 同时排除合并有严重感染、败血症、脓毒症以及近6 mo接受过免疫调节剂和/或抗病毒治疗的患者. PE标记抗CD4和FITC标记抗CD25(Ebioscience公司, 美国); 流式细胞仪(FACSAriaTM Cell Sorter, BD公司, 美国); 流式细胞分析软件(FACSDiva Software, BD公司, 美国); 免疫组化所用一抗是小鼠抗人FOXP3抗体(BioLegend公司, 美国); SABC-AP免疫组化试剂盒SA1051(武汉博士德生物工程有限公司, 中国); 倒置显微镜IX-70和高分辨摄像显微镜BX-41(Olympus公司, 日本).
1.2.1 免疫荧光标记和流式细胞分析: 采集慢性重型乙型肝炎患者组, 慢性乙型肝炎患者组, HBV携带者组, 正常对照组肝素抗凝血5 mL, 淋巴细胞分离液分离外周血单个核细胞(peripheral blood mononuclear cell, PBMC), 采用免疫荧光双标记方法标记细胞表面CD4和CD25分子, 室温中避光孵育30 min. 同型对照管另取1 mL细胞加入鼠抗人CD4-PE 10 μL, 鼠抗人IgG1-FITC 10 μL. 流式细胞仪分析细胞表面CD4, CD25分子表达水平. 由全自动生化分析仪测定肝功能、PTA等.
1.2.2 免疫组化检测和涂片法制成PBMC切片: 经消除内源性过氧化物酶处理后, 参照免疫组化三步法试剂盒说明书进行免疫组化染色. 最后在高分辨摄像显微镜下摄片, 再用Motic3.2图像分析软件测量免疫阳性灰度值.
统计学处理 数所有数据处理均在SPSS11.0软件包上进行均数t检验和ANOVA检验. 各组间比较用多个样本均数间的多重比较, 假设检验采用LSD-t检验, 组内比较采用配对t检验, 两组数据间的相关关系用直线相关分析方法, P<0.05为有显著性差异.
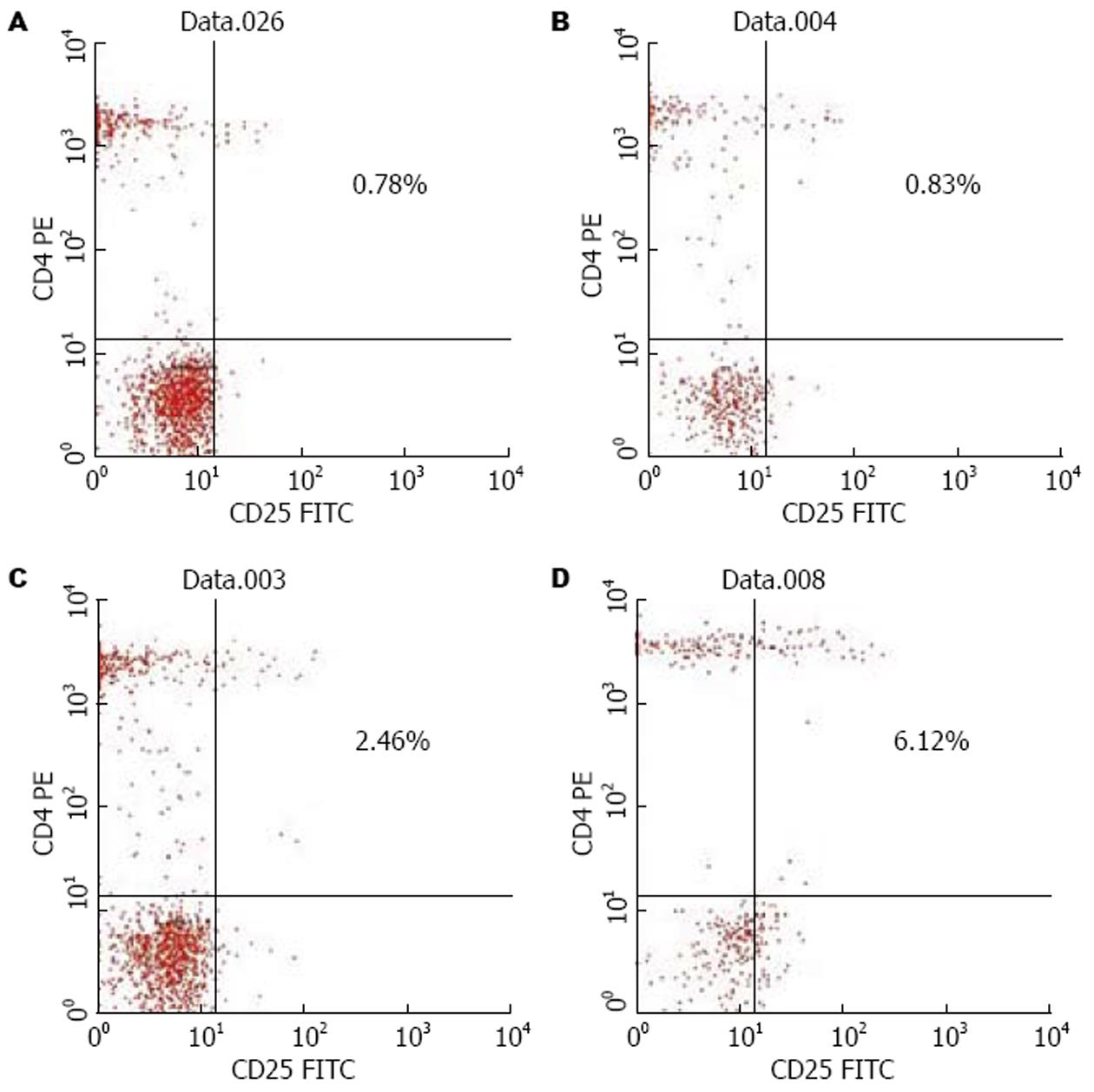
实验结果以CD4+CD25+/PBMC来评价. 正常对照组、HBV携带者组、慢性乙型肝炎组和慢性重型乙型肝炎组CD4+CD25+Treg细胞表达水平分别为0.50%±0.34%, 0.53%±0.37%, 1.67%±0.87%和4.80%±1.50%. 慢性重型肝炎组分别高于慢性肝炎组、HBV携带者组和正常对照组(P<0.01); 慢性肝炎组高于HBV携带者组和正常对照组(P<0.01); 与正常对照组相比, HBV携带者组CD4+CD25+Treg细胞的变化无明显差异(P>0.05)(表1, 图1). 在19例慢性肝炎患者中, 其中包括慢性重度肝炎、慢性中度肝炎和慢性轻度肝炎, 他们的CD4+CD25+Treg细胞分别为4.00%±0.90%, 1.03%±0.15%, 0.48%±0.30%. 慢性重度肝炎组分别高于慢性中度和慢性轻度肝炎组(P<0.01); 慢性中度肝炎组高于慢性轻度肝炎组(P<0.01, 表1).
| 分组 | n | CD4+CD25+Treg | TBIL(μmol/L) | PTA(%) | 灰度值 |
| 细胞(%) | |||||
| 正常对照 | 19 | 0.50±0.34bd | 11.20±2.34 | 87.70±8.84 | 165.10±6.21b |
| HBV携带者 | 19 | 0.53±0.37bd | 11.60±2.32 | 83.80±7.42 | 154.70±18.18b |
| 慢性乙型肝炎 | 19 | 1.67±0.87b | 70.42±36.4 | 53.70±8.17 | 147.30±13.36b |
| 轻度 | 6 | 0.48±0.30f | 25.00±4.61 | 67.70±2.73 | 156.94±11.30f |
| 中度 | 6 | 1.03±0.15fh | 71.70±16.57 | 58.00±5.40 | 143.98±3.03fh |
| 重度 | 7 | 4.00±0.90 | 107.70±11.11 | 50.30±4.23 | 133.04±7.66 |
| 慢性重型乙型肝炎 | 28 | 4.80±1.50 | 487.30±119.10 | 34.70±4.42 | 117.8±25.54 |
| 未恢复 | 12 | 3.40±0.90 | 500.00±120.92 | 35.10±4.28 | 112.42±20.99 |
| 恢复 | 16 | 4.00±1.10 | 475.80±116.27 | 34.40±4.66 | 123.16±30.09 |
追踪观察28例慢性重型肝炎患者, 其中12例患者病情恶化, 未恢复, 其在发病期CD4+CD25+Treg细胞为3.40%±0.90%; 16例患者恢复好转, 其在发病期CD4+CD25+Treg细胞为4.00%±1.10%, 这两者之间比较差异无显著性意义(P>0.05, 表1).
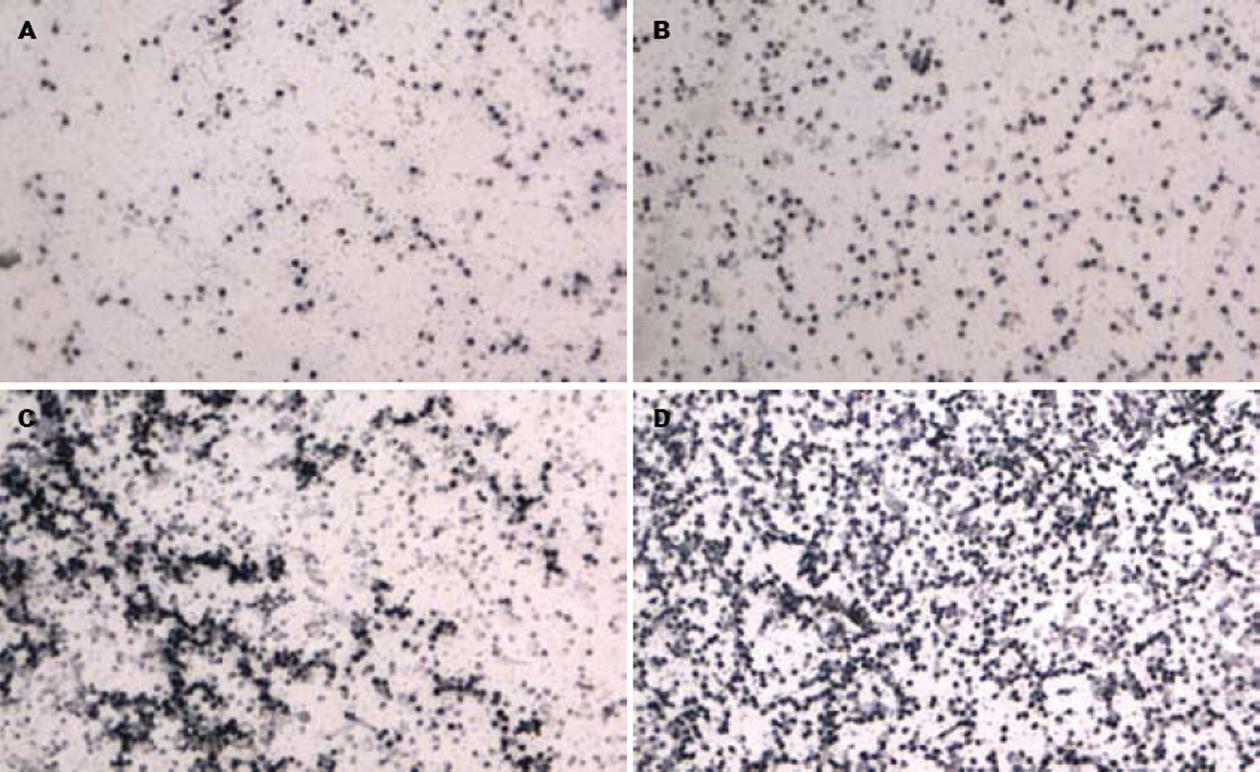
根据Motic3.2图像分析软件测量结果, 免疫阳性反应越强其灰度值则越低, 即FOXP3表达越强则灰度值越低. 慢性重型肝炎组免疫阳性灰度值(117.80±25.54)分别低于慢性肝炎组(147.30±13.36)、HBV携带者组(154.70±18.18)和正常对照组(165.10±6.21)(P<0.01, 表1, 图2). 在慢性肝炎患者组中, 慢性重度肝炎组免疫阳性灰度值(133.04±7.66)分别低于慢性中度肝炎组(143.98±3.03)和慢性轻度肝炎组(156.94±11.3)(P<0.01); 慢性中度肝炎组免疫阳性灰度值(143.98±3.03)低于慢性轻度肝炎组(156.94±11.30)(P<0.01, 表1). 慢性重型肝炎恢复组免疫阳性灰度值(123.16±30.09)和未恢复组(112.42±20.99)比较, 差异无显著性意义(P>0.05, 表1).
2.3 CD4+CD25+Treg细胞的变化与FOXP3, TBIL, PTA, HBV-DNA的直线相关性分析 CD4+CD25+Treg细胞的变化与FOXP3水平的变化没有相关性[n = 47(包括慢性肝炎组和重型肝炎组), r = -0.22, P>0.05]; 与TBIL的变化成正相关[n = 47(包括慢性肝炎组和重型肝炎组), r = 0.43, P<0.01]; 与PTA的变化成负相关[n = 47(包括慢性肝炎组和重型肝炎组), r = -0.57, P<0.05]; 与HBV-DNA水平的变化没有相关性[n = 47(包括慢性肝炎组和重型肝炎组), r = 0.22, P>0.05] (图3)
免疫应答时序和强弱的调节是保证机体自稳的重要机制. 在长期的进化过程中, 机体的免疫系统形成了精密的调节机制, 以控制免疫应答的质和量. 20世纪70年代免疫学家就发现机体存在抑制性T细胞, 是维持外周免疫耐受的重要因素, 然而由于缺乏特异性标志, 难以得到认同. 近年来有关CD4+CD25+Treg细胞的研究使得人们逐渐接受调节性T细胞的概念[5-8].
国外报道了CD4+CD25+Treg细胞在慢性乙型肝炎发病机制中的作用, 该细胞可以通过抑制HBV特异性的CD8+T细胞的激活, 一方面抑制过度免疫病理损伤, 另一方面也可能有利于病毒的持续感染[9-11]. 2005年Stoop et al[12]报道慢性HBV感染者外周血CD4+CD25+Treg细胞数量较正常人增多, 去除CD4+CD25+Treg细胞后, HBV特异性增殖反应增强. 我们起初认为, 慢性乙型肝炎发病过程中可能存在CD4+CD25+Treg细胞数量减少和/或功能的缺陷, 以至于不能抑制机体的过强的免疫反应从而导致肝细胞的损害. 我们的实验结果显示: 慢性重型乙型肝炎患者和慢性乙型肝炎患者CD4+CD25+Treg细胞水平明显高于HBV携带者和正常人. 在19例慢性肝炎患者中, 慢性重度肝炎组高于慢性中度和慢性轻度肝炎组, 慢性中度组高于慢性轻度肝炎组. 目前CD4+CD25+Treg细胞水平增高的原因仍然不明确, 我们考虑可能的原因有: (1)慢性的HBV感染过程中宿主出现过度的免疫病理损伤和炎症反应, 导致CD4+CD25+Treg细胞水平相应增高, 使得二者之间在一个新的高度达到平衡; (2)虽然在慢性重型乙型肝炎患者和慢性乙型肝炎患者中的CD4+CD25+Treg细胞水平明显增高, 但是他的功能可能存在缺陷, 所以仍然不能有效抑制机体过度的免疫反应; (3)还有其他很多因素参与肝损伤的发病过程, 例如肝损伤后继发引起肠源性内毒素血症, 内毒素介导产生细胞因子和炎症介质对肝脏产生毒性作用, 造成微循环障碍等. 这些因素的共同作用可能超过CD4+CD25+Treg细胞的免疫抑制作用, 所以出现了肝损伤. 总之, 目前CD4+CD25+Treg细胞水平增高的原因仍不明确, 有待于日后的研究进一步探讨.
我们的研究发现, HBV携带者的CD4+CD25+Treg细胞水平变化和正常对照组无明显差异, 考虑可能的原因是: 虽然HBV携带者的临床免疫状态是非消除性免疫, 但是机体免疫系统仍处于一个相对平衡的状态. 所以HBV携带者的CD4+CD25+Treg细胞数量和功能基本正常. 本组资料显示, CD4+CD25+Treg细胞水平与外周血浆TBIL呈显著正相关, 与PTA呈负相关, 说明CD4+CD25+Treg细胞水平与病情的严重程度相关. 此外, 我们还发现, CD4+CD25+Treg细胞水平与HBV-DNA的水平变化无相关关系, 提示CD4+CD25+Treg细胞水平与HBV复制是否活跃不存在相关关系.
追踪观察23例慢性重型肝炎患者, 发现未恢复的患者发病期CD4+CD25+Treg细胞表达水平与恢复的患者CD4+CD25+Treg细胞表达水平差异无显著性意义. 提示CD4+CD25+Treg细胞表达水平不能反应慢性乙型肝炎患者的预后. 有多种因素可以影响慢性乙型肝炎患者的预后.
2003年Hori et al[13-15]研究小组均证明FOXP3在CD4+CD25+Treg细胞上特异性表达, 且FOXP3在CD4+CD25+Treg细胞的发育和功能上是必需的. 然而FOXP3表达和CD4+CD25+Treg细胞并不完全一致. 实验证实[16], 缺失功能性的FOXP3可导致CD4+CD25+Treg细胞种群全部丧失对自身反应细胞的抑制功能, 从而大大加剧自身免疫性疾病的某些症状, 以至Scurfy鼠迅速死亡, 而通过去除鼠的CD4+CD25+Treg细胞引起的自身免疫性疾病不会导致鼠的迅速死亡. 由此可见, 目前CD4+CD25+Treg细胞和FOXP3的对应关系还存在争议. 我们的研究也发现, 慢性乙型肝炎及慢性重型乙肝患者FOXP3蛋白的表达均高于HBV携带者组和正常人组, 其变化与CD4+CD25+Treg细胞数量的改变相平行. 但是二者之间没有相关关系(r = -0.22, P>0.05). 其确切原因不清楚, 可能还有其他细胞表达FOXP3 mRNA和/或FOXP3 mRNA的表达受到其他基因调控的影响.
CD4+CD25+T调节细胞(regulatoryT cell, Treg)是近年来发现的一种新型免疫抑制性调节细胞, 他一方面能保护机体免受过激炎症的损伤, 另一方面亦减轻巨噬细胞等对病原体的杀伤作用, 使机体处于感染的慢性化过程中.
1995年Sakaguchi et al首次报道CD4+CD25+Treg调节细胞是一种新型免疫抑制性调节细胞; 2003年Ho r i e t a l 均证明FOXP3在CD4+CD25+Treg细胞上特异性表达, 且FOXP3在CD4+CD25+Treg细胞的发育和功能上是必需的;2005年Stoop et al报道慢性H B V感染者外周血CD4+CD25+Treg细胞数量较正常人增多, 去除CD4+CD25+Treg细胞后, HBV特异性增殖反应增强.
本文研究结果再一次证实了检测乙型肝炎患者外周血CD4+CD25细胞的临床意义, 对深入探讨乙型肝炎的发病机制, 寻求有效治疗措施具有指导意义.
本文研究慢性乙型肝炎患者CD4+CD25+Treg的检测及意义, 文章层次清楚, 数据可信, 结果客观,有一定的学术和实际应用价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-1164. [PubMed] |
| 2. | Shevach EM. CD4+ CD25+ suppressor T cells: more questions than answers. Nat Rev Immunol. 2002;2:389-400. [PubMed] |
| 3. | Schubert LA, Jeffery E, Zhang Y, Ramsdell F, Ziegler SF. Scurfin (FOXP3) acts as a repressor of transcription and regulates T cell activation. J Biol Chem. 2001;276:37672-37679. [PubMed] |
| 5. | Furtado GC, Olivares-Villagomez D, Curotto de Lafaille MA, Wensky AK, Latkowski JA, Lafaille JJ. Regulatory T cells in spontaneous autoimmune encephalomyelitis. Immunol Rev. 2001;182:122-134. [PubMed] [DOI] |
| 6. | Aandahl EM, Michaelsson J, Moretto WJ, Hecht FM, Nixon DF. Human CD4+ CD25+ regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens. J Virol. 2004;78:2454-2459. [PubMed] [DOI] |
| 7. | Belkaid Y, Piccirillo CA, Mendez S, Shevach EM, Sacks DL. CD4+CD25+ regulatory T cells control Leishmania major persistence and immunity. Nature. 2002;420:502-507. [PubMed] [DOI] |
| 8. | Cabrera R, Tu Z, Xu Y, Firpi RJ, Rosen HR, Liu C, Nelson DR. An immunomodulatory role for CD4(+)CD25(+) regulatory T lymphocytes in hepatitis C virus infection. Hepatology. 2004;40:1062-1071. [PubMed] [DOI] |
| 9. | Vahlenkamp TW, Tompkins MB, Tompkins WA. The role of CD4+CD25+ regulatory T cells in viral infections. Vet Immunol Immunopathol. 2005;108:219-225. [PubMed] [DOI] |
| 10. | Franzese O, Kennedy PT, Gehring AJ, Gotto J, Williams R, Maini MK, Bertoletti A. Modulation of the CD8+-T-cell response by CD4+ CD25+ regulatory T cells in patients with hepatitis B virus infection. J Virol. 2005;79:3322-3328. [PubMed] [DOI] |
| 11. | Suvas S, Kumaraguru U, Pack CD, Lee S, Rouse BT. CD4+CD25+ T cells regulate virus-specific primary and memory CD8+ T cell responses. J Exp Med. 2003;198:889-901. [PubMed] [DOI] |
| 12. | Stoop JN, van der Molen RG, Baan CC, van der Laan LJ, Kuipers EJ, Kusters JG, Janssen HL. Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection. Hepatology. 2005;41:771-778. [PubMed] [DOI] |
| 13. | Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061. [PubMed] [DOI] |
| 14. | Khattri R, Cox T, Yasayko SA, Ramsdell F. An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat Immunol. 2003;4:337-342. [PubMed] [DOI] |
| 15. | Ramsdell F, Ziegler SF. Transcription factors in autoimmunity. Curr Opin Immunol. 2003;15:718-724. [PubMed] [DOI] |
| 16. | Chatila TA, Blaeser F, Ho N, Lederman HM, Voulgaropoulos C, Helms C, Bowcock AM. JM2, encoding a fork head-related protein, is mutated in X-linked autoimmunity-allergic disregulation syndrome. J Clin Invest. 2000;106:R75-R81. [PubMed] [DOI] |