修回日期: 2007-08-27
接受日期: 2007-09-01
在线出版日期: 2007-09-08
目的: 探讨便秘型肠易激综合征(C-IBS)大鼠模型对直肠球囊扩张的内脏敏感性改变和脊髓背角5-羟色胺(5-HT)、c-fos的分布和异常表达.
方法: C-IBS大鼠模型组应用冰水ig方法建立(A组, n = 10), 和正常对照大鼠(B组, n = 10). 所有大鼠给予直肠内球囊扩张, 检测球囊扩张引起腹部收缩反射的最小容量阈值及球囊不同容量扩张时腹部收缩反射的次数. 腰骶段脊髓背角5-HT和c-fos表达应用免疫组织化学染色及计算机图像分析系统半定量进行分析.
结果: 直肠内球囊扩张时, A组引起腹部收缩的最小容量阈值略高于B组, 无明显统计学差异(0.59±0.09 vs 0.57±0.13, P>0.05). 直肠球囊扩张体积1.0 mL时A组腹部收缩反射次数低于B组(10.3±3.3 vs 18.3±5.5, P<0.05); 体积1.5和2.0 mL高容量扩张时两组无明显差异(P>0.05). A组腰骶段脊髓背角5-HT、c-fos阳性神经组织的面积均明显高于B组(5-HT面积: 146.5±15.1 vs 109.3±18.5; 5-HT OD: 45826±2563.2 vs 29358±8965.5; c-fos面积: 125.4±23.3 vs 88.7±23.2; c-fos OD: 46258±4642 vs 33238±4587; 均P<0.05).
结论: C-IBS大鼠模型存在对直肠球囊扩张的内脏敏感性异常, 脊髓背角5-HT、c-fos的异常表达可能参与C-IBS大鼠内脏敏感性异常的调节.
引文著录: 孙刚, 杨云生, 彭丽华, 王巍峰. 肠易激综合征大鼠内脏敏感性和脊髓背角5-HT和c-fos的表达. 世界华人消化杂志 2007; 15(25): 2718-2722
Revised: August 27, 2007
Accepted: September 1, 2007
Published online: September 8, 2007
AIM: To study the visceral sensitivity by rectal balloon distension and expression of 5-hydroxy-tryptamine (5-HT) and c-fos in the spinal dorsal horn of a rat model with constipation-predominant irritable bowel syndrome (C-IBS).
METHODS: The rat model was established by intragastric injection with ice-cold water (0-4℃). The perception thresholds and the number of abdominal withdrawal reflexes (AWRs) were recorded during rectal balloon distention in order to evaluate visceral sensitivity in the model group (A, n = 10) and control group (B, n = 10). Expression of 5-HT and c-fos in the spinal dorsal horn was shown by immunohistochemical staining, and analyzed semi-quantitatively by computerized color image analyzer using immunoreactive areas and optical density (OD). The statistical difference of the OD and immunoreactive areas between the two groups was examined by t test.
RESULTS: The perception threshold in group A was slightly higher than that in group B during rectal balloon distention, but there was no significant difference (0.59 ± 0.09 vs 0.57 ± 0.13, P > 0.05). The number of AWRs to the lower balloon content (1.0 mL) was much lower in group A than in group B (10.3 ± 3.3 vs 18.3 ± 5.5, P < 0.05), although no difference was found to the higher balloon content (1.5 and 2.0 mL). Immunoreactive area and OD of 5-HT- and c-fos-positive neurons and fibers in group A were significantly higher than those in group B (5-HT immunoreactive area, 146.5 ± 15.1 vs 109.3 ± 18.5; 5-HT OD, 45826 ± 2563.2 vs 29358 ± 8965.5; c-fos immunoreactive area, 125.4 ± 23.3 vs 88.7 ± 23.2; c-fos OD, 46258 ± 4642 vs 33238 ± 4587; all P < 0.05).
CONCLUSION: The model of C-IBS has a decreased visceral sensitivity to rectal balloon distention. The increased expression of 5-HT and c-fos in the spinal dorsal horn is probably involved in the process.
- Citation: Sun G, Yang YS, Peng LH, Wang WF. Visceral sensitivity and expression of 5-hydroxytryptamine and c-fos in the spinal dorsal horn in a rat model with irritable bowel syndrome. Shijie Huaren Xiaohua Zazhi 2007; 15(25): 2718-2722
- URL: https://www.wjgnet.com/1009-3079/full/v15/i25/2718.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i25.2718
肠易激综合征(irritable bowel syndrome, IBS)是指腹痛或腹部不适同时伴有排便异常为特征的一种功能性肠病, 目前IBS的病因和发病机制尚不清楚, 其中对直肠球囊扩张刺激的内脏敏感性异常被认为是IBS重要的病理生理机制[1-4]. 5-HT是一种重要的神经递质, 在外周和中枢对内脏感觉传递和调节方面起重要作用, 一些研究显示IBS与5-HT异常有一定的关系[5-7]. 本研究通过观察C-IBS大鼠直肠球囊扩张后脊髓背角5-HT及c-fos异常表达, 探讨5-HT和c-fos在脊髓水平对内脏敏感性调节的可能机制.
4周龄的♂Wistar大鼠20只, 体质量120-150 g, 军事医学科学院实验动物中心提供. 兔抗大鼠c-fos抗体、兔抗人5-HT多克隆抗体、生物素标记羊抗兔IgG、辣根过氧化物酶标记的链霉卵蛋白及DAB显色剂均购自北京中山生物技术有限公司. Olympus CX40光学显微镜, 德国Braun公司8F导尿管, 导管直径2 mm, 球囊最大容量3 mL, 最大直径2 cm, 用作直肠内球囊扩张导管. 直径6 cm鼠固定器, 日本ICM株式会社制作.
大鼠20只随机分为2组, 模型组(A组)10只, 采用本研究小组彭丽华 et al[8]冰水ig法建立C-IBS大鼠模型. 每日给予0-4℃冰水灌胃1次, 2 mL/只, 共14 d, 停止灌胃后正常饲养. 正常对照组(B组)10只, 每日正常饲养. 第28天肠球囊扩张后处死大鼠并制备组织标本.
1.2.1 内脏敏感性测定: 第28天, 2组大鼠分别于清醒状态下放入鼠固定器内, 限制大鼠的各项活动, 但可观察到腹部收缩反射. 将Braun 8F带气囊导尿管外涂石蜡油后经肛门插入, 气囊末端距肛门1 cm. 用4号手术缝线在导尿管平肛门外缘水平打结固定于鼠尾, 相隔2 cm处同样方法固定. 15 min后大鼠适应环境呈安静状态, 经导尿管外口向球囊内注入常温水(26-28℃生理盐水)扩张. 记录引起大鼠腹部收缩反射(AWR)的最小注水量为最小容量阈值. 重复扩张3次, 每次间隔15 min, 以3次扩张测得的最小容量阈值的均值为该鼠直肠扩张引起腹部收缩反射的最小容量阈值. 测定阈值后第2天, 分别测定注水量为1.0, 1.5和2.0 mL时3 min内AWR次数, 每次间隔30 min. 采用引起大鼠AWR的最小容量阈值和直肠内球囊不同容量扩张时3 min内大鼠AWR的次数评价大鼠对直肠内扩张刺激的内脏敏感性.
1.2.2 标本制备及免疫组化染色: 2组大鼠直肠内球囊扩张结束1 h后, 给予大鼠ip 200 g/L乌拉坦2 mL/只处死动物, 心脏穿刺插管至主动脉根部, 剪破右心耳, 生理盐水200 mL经左心室和升主动脉快速灌注冲洗, 待冲洗液清亮后予40 g/L甲醛250 mL灌注固定. 取大鼠的脊髓腰骶段(L5-S2)以40 g/L甲醛固定, 常规石蜡包埋. 脊髓进行连续切片, 片厚2 μm, 隔5张取1张. 每例每部位取2张, 置于经APES(3-氨丙基三乙氧基硅烷)防脱片剂处理的载玻片上, 烤箱56℃ 60 min以使切片紧密黏附. 应用工作浓度为1∶100稀释的兔抗5-HT和c-fos抗体, 按SABC免疫化学法进行标记, 操作步骤按试剂说明. DAB室温显色5-10 min, 镜下控制反应时间, 以着棕色者为染色阳性. 应用计算机图像分析系统半定量分析5-HT和c-fos阳性反应的面积和不透光率密度A值. A值反应组织染色强度, 即A值越大, 染色越强; 面积表示阳性细胞染色象素的总和.
统计学处理 计数资料用mean±SD描述, 组间资料进行t检验. 采用SAS6.0软件完成, P<0.05为差异显著.
C-IBS模型组大鼠直肠扩张引起腹部收缩的最小容量阈值为0.59±0.09 mL, 正常对照组为0.57±0.13 mL, 两组直肠扩张引起腹部收缩的最小容量阈值无明显差异(P>0.05). 两组大鼠直肠内球囊1.0 mL低容量扩张时, A组3 min内腹部收缩反射次数为10.3±3.3次, 低于B组的18.3±5.5次(P<0.05); 而直肠球囊体积1.5和2.0 mL高容量扩张时, 两组大鼠3 min内腹部收缩反射次数无明显差异(P>0.05)(表1).
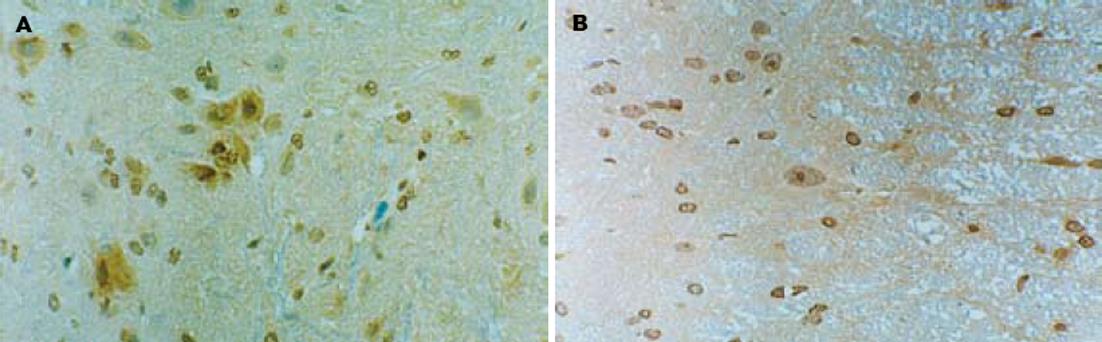
根据Rexed提出的脊髓灰质板层构筑学说, 从背角到前角可分为10个板层, 背角包括: Ⅰ层相当于背角缘层, Ⅱ层相当于胶状质, Ⅲ、Ⅳ层相当于背角固有核, Ⅴ、Ⅵ层位于背角基部. 两组大鼠c-fos阳性神经组织在脊髓灰质分布较多的区域有背角Ⅰ、Ⅱ和Ⅴ层, 其他板层也有少量阳性细胞. 集中于神经元细胞, 胞质阳性, 呈黄至棕色(图1A). 而5-HT阳性神经元在脊髓背角罕见, 在脊髓背角Ⅰ层和Ⅱ层可见较多的5-HT阳性神经纤维, 胞质阳性, 呈黄至棕色(图1B). 根据计算机图像分析, C-IBS模型组大鼠脊髓背角5-HT、c-fos表达的A值和面积均明显超过正常对照组(P<0.05)(表1).
对直肠球囊扩张的内脏敏感性异常被认为是IBS重要的病理生理特征, 推测可能涉及肠道、肠神经系统和中枢神经系统. 利用动物模型研究表明脊髓背角作为感觉传导的次级中枢参与内脏敏感性调节, 并有多种神经递质表达异常[9-11]. 5-HT作为一种重要的神经递质, 在脊髓水平的感觉信息尤其是伤害性信息传递和调节中起重要作用[12-13], 已有研究表明IBS患者中血清和结肠黏膜5-HT异常增加并与内脏敏感性异常相关[14-17], 但在脊髓水平5-HT有无表达异常及与内脏敏感性改变的关系研究较少. 本研究利用C-IBS大鼠模型研究直肠球囊扩张后脊髓背角5-HT异常表达, 并利用伤害性感觉神经元兴奋的标志物c-fos探讨5-HT参与IBS发病的可能机制.
本研究组采用冰水灌胃法建立的C-IBS大鼠模型, 表现为便秘及对直肠球囊扩张存在内脏敏感性改变, 较好的模拟了人类IBS的特点. 脊髓是肠道的内脏感觉等传入纤维与大脑间进行信号传递的中继站, 在脑肠互动中起重要的作用. 根据Rexed提出脊髓灰质板层构筑学说, 外周伤害性感受器信息通过Aδ、C类传入纤维传至脊髓背角Ⅰ、Ⅱ、Ⅳ层, 释放化学性物质(谷氨酸、SP), 使背角Ⅰ、Ⅳ及Ⅶ-Ⅹ段投射神经元兴奋, 将伤害性冲动经轴突组成上行通路, 传递到高级中枢. 同时, 脊髓背角接收来自高级中枢下行通路对内脏感觉进行调节, 因此, 脊髓背角是抗伤害性感受调节的关键部位.
c-fos被认为是一种即刻早基因, 在神经元活动时c-fos蛋白表达增强, 可作为神经元被激活的标志, 机体受到外界伤害性刺激后, 诱导表达的c-fos蛋白主要出现在与痛觉传递有关的神经元细胞核内, 因此表达产物被认为是伤害性感受神经元兴奋的标志物[18-19], 据此c-fos被用作痛觉传导神经通路的研究. 本研究发现直肠球囊扩张后两组大鼠腰骶部脊髓背角Rex Ⅰ、Ⅱ及Ⅴ层c-fos阳性表达, 提示背角c-fos阳性神经元很可能参与内脏痛觉信息传递和调控. 利用大鼠前爪掌心sc福尔马林方法造成的炎性痛大鼠模型中, 脊髓免疫组化染色显示c-fos阳性神经元于同侧脊髓背角Ⅰ、Ⅱ及Ⅴ层表达明显增多, 这一部位与传递外周伤害性信息的初级传入纤维的终止区及背角痛敏神经元的分布区一致; 也与电生理记录的对伤害性刺激反应的背角神经元的分布部位相重叠[20], 提示脊髓背角c-fos阳性神经元很可能介导痛觉信息传递. 本研究中对于大鼠直肠球囊扩张刺激后, 两组大鼠脊髓背角均可见c-fos蛋白表达, 与文献一致[21-23]. 而冰水灌胃组c-fos表达强度和范围明显高于正常组, 这可能与肠道致敏大鼠脊髓背角痛觉神经元接受过多的来自肠神经系统上传的伤害性信号有关, 或与反复冰水灌胃刺激后脊髓背角痛觉神经元可塑性的改变有关.
5-HT是脊髓内主要的抑制性神经递质, 正常大鼠来自脑干中缝核簇的5-HT样阳性终末密集地分布于脊髓背角浅层的RexedⅠ、Ⅱ层, 与向丘脑投射的神经元和局部环路神经元形成以对称性为主的突触联系[24-25], 并对脊髓背角浅层神经元的活动有抑制作用[26-27]. 本研究发现, C-IBS大鼠脊髓背角浅层的5-HT能神经纤维数量分布和表达增强, 说明脊髓背角的5-HT能神经可能在脊髓水平参与内脏痛觉的调控, 表现为对于直肠球囊扩张的敏感性下降, 说明脊髓背角5-HT能神经纤维可能是内脏敏感性改变的物质基础之一. 由于5-HT不能直接抑制脊髓背角浅层神经元, 他可能先作用于γ-氨基丁酸(GABA)受体和甘氨酸(Gly)受体共存的神经元, 这些共存神经元释放的GABA和/或Gly作用于初级传入纤维的终末和脊髓背角浅层的痛觉神经元, 通过突触后机制抑制他们的电活动, 从而间接达到抑制外周伤害性信息向中枢神经系统内传递的效应[25,28-31].
内脏敏感性异常可能牵涉肠道、肠神经系统、脊髓和脑, 脊髓背角作为脑-肠轴的"中继站"是内脏敏感性调节的关键部位, 脊髓背角的c-fos阳性痛觉神经元和来自下行通路的5-HT能神经纤维参与内脏敏感性的调控, 其结构和功能的异常可能是内脏敏感性异常的物质基础之一. 近年来多项研究发现神经、免疫、内分泌系统的多种细胞及活性物质可能参与IBS患者内脏敏感性异常的调节, 为IBS的神经、免疫、内分泌网络调控提供间接和直接依据[2], 但在其中哪种物质起到始动作用或关键作用尚需大量工作证实.
肠易激综合征(IBS)患者对直肠球囊扩张刺激的内脏敏感性异常是其重要的病理生理机制, 可能牵涉外周神经和中枢神经系统结构和神经递质异常. 本研究应用IBS大鼠模型研究直肠球囊扩张刺激对模型脊髓背角5-HT及c-fos表达的影响, 探讨5-HT和c-fos在脊髓水平对内脏敏感性调节的可能机制.
本研究涉及IBS内脏敏感性异常、脑-肠轴异常机制, 利用c-fos作为痛觉传递和神经元兴奋的标志物对5-HT在脊髓背角调节内脏敏感性的可能机制进行探讨, 阐明了5-HT可能作为一种重要的神经递质在脊髓水平参与内脏敏感性异常.
应用本课题组创建的IBS大鼠模型进行5-HT在脊髓背角异常表达对内脏敏感性的影响, 初步揭示该神经递质可能的作用途径和机制; 把c-fos作为脊髓伤害性感受神经元兴奋的标记物, 研究脊髓背角内脏感觉通路.
本研究方法可应用于在脊髓和高级中枢其他神经递质和蛋白分子的研究, 将来对IBS治疗新药疗效和机制的评估有潜在的应用价值.
本文研究得出脊髓背角5-HT, c-fos的异常表达可能参与c-IBS大鼠内脏敏感性异常的调节, 设计合理, 目的明确, 方法先进, 技术路线正确, 数据可信, 对基础与临床研究有一定的参考价值.
编辑: 何燕 电编:何基才
| 1. | Azpiroz F. Hypersensitivity in functional gastrointestinal disorders. Gut. 2002;51 Suppl 1:i25-28. [PubMed] [DOI] |
| 2. | 杨 云生. 肠易激综合征神经免疫内分泌网络调控机制. 胃肠病学和肝病学杂志. 2002;11:320-322. |
| 5. | Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, Neal KR. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000;47:804-811. [PubMed] [DOI] |
| 6. | Miwa J, Echizen H, Matsueda K, Umeda N. Patients with constipation-predominant irritable bowel syndrome (IBS) may have elevated serotonin concentrations in colonic mucosa as compared with diarrhea-predominant patients and subjects with normal bowel habits. Digestion. 2001;63:188-194. [PubMed] [DOI] |
| 11. | Ragnarsson G, Hallbook O, Bodemar G. Abdominal symptoms and anorectal function in health and irritable bowel syndrome. Scand J Gastroenterol. 2001;36:833-842. [PubMed] [DOI] |
| 12. | O'Mahony S, Dinan TG, Keeling PW, Chua AS. Central serotonergic and noradrenergic receptors in functional dyspepsia. World J Gastroenterol. 2006;12:2681-2687. [PubMed] [DOI] |
| 13. | Sarkar S, Hobson AR, Furlong PL, Woolf CJ, Thompson DG, Aziz Q. Central neural mechanisms mediating human visceral hypersensitivity. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1196-1202. [PubMed] |
| 18. | Monnikes H, Ruter J, Konig M, Grote C, Kobelt P, Klapp BF, Arnold R, Wiedenmann B, Tebbe JJ. Differential induction of c- fos expression in brain nuclei by noxious and non-noxious colonic distension: role of afferent C-fibers and 5-HT3 receptors. Brain Res. 2003;966:253-264. [PubMed] [DOI] |
| 19. | Nakagawa T, Katsuya A, Tanimoto S, Yamamoto J, Yamauchi Y, Minami M, Satoh M. Differential patterns of c-fos mRNA expression in the amygdaloid nuclei induced by chemical somatic and visceral noxious stimuli in rats. Neurosci Lett. 2003;344:197-200. [PubMed] [DOI] |
| 20. | Berrocal YA, Pearse DD, Andrade CM, Hechtman JF, Puentes R, Eaton MJ. Increased spinal c-Fos expression with noxious and non-noxious peripheral stimulation after severe spinal contusion. Neurosci Lett. 2007;413:58-62. [PubMed] [DOI] |
| 21. | Ghanima A, Bennis M, Rampin O. c-Fos expression as endogenous marker of lumbosacral spinal neuron activity in response to vaginocervical-stimulation. Brain Res Brain Res Protoc. 2002;9:1-8. [PubMed] [DOI] |
| 22. | Anand P, Aziz Q, Willert R, van Oudenhove L. Peripheral and central mechanisms of visceral sensitization in man. Neurogastroenterol Motil. 2007;19:29-46. [PubMed] [DOI] |
| 23. | Ren TH, Wu J, Yew D, Ziea E, Lao L, Leung WK, Berman B, Hu PJ, Sung JJ. Effects of neonatal maternal separation on neurochemical and sensory response to colonic distension in a rat model of irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2007;292:G849-856. [PubMed] [DOI] |
| 24. | Holden JE, Farah EN, Jeong Y. Stimulation of the lateral hypothalamus produces antinociception mediated by 5-HT1A, 5-HT1B and 5-HT3 receptors in the rat spinal cord dorsal horn. Neuroscience. 2005;135:1255-1268. [PubMed] [DOI] |
| 25. | Suzuki R, Rahman W, Rygh LJ, Webber M, Hunt SP, Dickenson AH. Spinal-supraspinal serotonergic circuits regulating neuropathic pain and its treatment with gabapentin. Pain. 2005;117:292-303. [PubMed] [DOI] |
| 26. | 周 静, 李 辉, 刘 翔宇, 王 亚云, 李 云庆, 武 胜昔. 5-HT2,4,5受体亚型mRNAs在大鼠不同节段脊髓背、腹角的表达. 第四军医大学学报. 2004;25:1345-1348. |
| 27. | Liu FY, Xing GG, Qu XX, Xu IS, Han JS, Wan Y. Roles of 5-hydroxytryptamine (5-HT) receptor subtypes in the inhibitory effects of 5-HT on C-fiber responses of spinal wide dynamic range neurons in rats. J Pharmacol Exp Ther. 2007;321:1046-1053. [PubMed] [DOI] |
| 28. | Tanaka H, Amamiya S, Miura N, Araki A, Ohinata J, Fujieda K. Postnatal development of brainstem serotonin-containing neurons projecting to lumbar spinal cord in rats. Brain Dev. 2006;28:586-591. [PubMed] [DOI] |
| 29. | Tanimoto T, Takeda M, Nishikawa T, Matsumoto S. The role of 5-hydroxytryptamine3 receptors in the vagal afferent activation-induced inhibition of the first cervical dorsal horn spinal neurons projected from tooth pulp in the rat. J Pharmacol Exp Ther. 2004;311:803-810. [PubMed] [DOI] |
| 30. | Kawamata T, Omote K, Toriyabe M, Yamamoto H, Namiki A. The activation of 5-HT(3) receptors evokes GABA release in the spinal cord. Brain Res. 2003;978:250-255. [PubMed] [DOI] |
| 31. | Li H, Lang B, Kang JF, Li YQ. Serotonin potentiates the response of neurons of the superficial laminae of the rat spinal dorsal horn to gamma-aminobutyric acid. Brain Res Bull. 2000;52:559-565. [PubMed] [DOI] |