修回日期: 2007-08-16
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 探讨肿瘤芽殖强度与大肠癌生物学行为及预后的关系及其临床应用价值.
方法: 回顾性调查施行根治手术并具有完整临床病理资料的大肠癌94例, 分析肿瘤芽殖强度与患者预后及反映大肠癌生物学行为的病理因素间的相关性.
结果: 肿瘤芽殖强度与淋巴结转移数(P<0.001)、浸润深度(P = 0.004)、肿瘤分化(P = 0.03)相关; 高和低芽殖组间(20% vs 90%), T2 (33% vs 90%)和T3 (26% vs 90%)期, 隆起型(33% vs 88%)和溃疡型(18% vs 91%), 组织学分级1级(即高分化腺癌)(25% vs 92%)的高、低芽殖组间5 年生存率差异具有极显著意义(P<0.001); 高低芽殖组在肿瘤复发病例分布中有显著性差异(P<0.001). Cox模型分析表明肿瘤芽殖强度是反映大肠癌预后的独立指标之一.
结论: 肿瘤芽殖强度是反映大肠癌恶性生物学行为和估计预后的良好指标, 并具有简单、客观、易操作、较好的可重复性及易于推广应用的特点.
引文著录: 高照华, 王振宁, 王梅先. 肿瘤芽殖与大肠癌生物学行为及预后的关系. 世界华人消化杂志 2007; 15(24): 2619-2625
Revised: August 16, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To investigate the clinical value of the intensity of tumor budding, and to assess the relationship between the intensity of tumor budding and prognosis and biological behavior in colorectal carcinoma.
METHODS: The relationship between the intensity of tumor budding and prognosis and biological behavior was retrospectively studied in 94 patients with colorectal cancer who underwent radical excision from January 2000 to December 2001.
RESULTS: The intensity of tumor budding correlated with lymph node metastasis (P < 0.001), depth of cancer invasion (P = 0.004), and tumor differentiation (P = 0.03). Five-year survival rates in different groups were significantly different between high- and low-grade budding (20% vs 90%), the T2 (33% vs 90%) and T3 (26% vs 90%) phases, and swelling (33% vs 88%) and ulcer (18% vs 91%) types. Further, histological grade I was 25% vs 92% for high- and low-grade budding, respectively. High- and low-grade budding were related to growth and recurrence (P < 0.001). Multivariate Cox model analysis showed that the intensity of tumor budding was a significant independent prognostic factor.
CONCLUSION: The intensity of tumor budding is an objective, simple and reproducible indicator, as well as a good index for estimating prognosis and any aggressive biological behavior of colorectal cancer.
- Citation: Gao ZH, Wang ZN, Wang MX. Relationship between tumor budding and prognosis and biological behavior of colorectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2619-2625
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2619.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2619
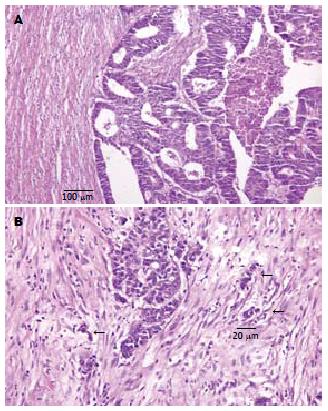
大肠癌是常见的恶性肿瘤, 发病率高, 预后差, 其复发和转移是影响患者疗效和预后的首要因素. 肿瘤芽殖是浸润转移过程的第一步, 即癌细胞与原发癌灶脱离. Morodomi et al[1]首先提出肿瘤芽殖的概念, 即位于浸润前缘孤立的单个癌细胞或少于5个癌细胞的癌细胞簇. 本文回顾性调查中国医科大学肿瘤外科施行根治手术并具有完整临床病理资料大肠癌病例, 分析其肿瘤芽殖的有无及强度与大肠癌生物学行为及预后的关系, 旨在为早期预测复发转移和制定合理的治疗方案提供依据.
2000-01/2001-12中国医科大学肿瘤外科施行根治手术大肠癌患者94例, 男50例, 女44例, 平均年龄57.5(36-86)岁. 入选病例术后均系统门诊复查随诊, 术后复发转移情况明确, 复发转移病例经临床、CT、B超、X线摄片等诊断, 随访期间≥5 年.
入选病例的病理淋巴结检测均大于12个. 大肠癌大体类型、组织学分型、组织学分级均按WHO 2000年分类标准进行. T分期、N分期、TNM分期均按1997年UICC的TNM分期标准执行. Dukes分期按全国大肠癌病理研究协作组最新修订标准. 芽殖存在与否根据Ueno et al[2]的标准判定, 即一个孤立的单个癌细胞或由少于5个癌细胞组成的一个癌细胞簇显现从大的癌体浸润前缘的发芽.
对于肿瘤芽殖的定量[3]: 每例病理片用低倍光镜(×10倍物镜)细查, 并选择3个最高密度区, 再用20倍物镜计数每个区域的芽殖灶数量, 以其中数量最多的作为该例肿瘤芽殖的程度, 并用强度这个名词代表; 按芽殖强度<10和≥10把患者分成2组. 生存时间, 以手术日至末次随访的时间为准.
统计学处理 采用χ2检验分析变量之间的联系, 利用kaplan-Meier方法计算术后5 年生存率并绘制生存曲线; 应用Log-rank方法比较各组间生存曲线差异. 用Cox比例风险模型分析变量对预后独立影响的作用, 统计分析采用SPSS13.0软件.
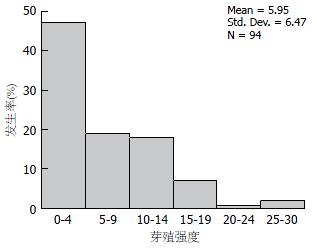
在观察的病例中, 肿瘤芽殖强度<5的病例出现的频率最多, 约占50%; 其次, 芽殖强度5-9之间组, 约占20.2%(图2). 芽殖强度≥10组约占29.8%. 肿瘤芽殖强度分布与淋巴结转移数、Dukes分期、TNM分期(P<0.0001)、浸润深度(P = 0.004)、肿瘤分化(P = 0.03)等有显著性相关, 而与年龄、性别、肿瘤最大直径、生长方式、肿瘤类型等无显著性关系(表1).
| 临床病理因素 | n | 肿瘤芽殖强度分组 | P值 | |
| 0-9 | ≥10 | |||
| 年龄1 | 57.5 | 56.89 | 58.93 | NS |
| 性别 | ||||
| 男 | 50 | 39 | 11 | 0.078 |
| 女 | 44 | 27 | 17 | |
| 肿瘤最大直径 | 5.631 | 5.618 | 5.661 | NS |
| 肿瘤类型 | ||||
| 腺癌 | 73 | 50 | 23 | 0.497 |
| 黏液腺癌 | 21 | 16 | 5 | |
| 分化 | ||||
| 高分化(1级) | 48 | 38 | 10 | 0.03 |
| 中分化(2级) | 21 | 10 | 11 | |
| 低分化(3级) | 25 | 18 | 7 | |
| 淋巴结转移数量 | ||||
| 0个 | 57 | 50 | 7 | <0.0001 |
| 1-3个 | 19 | 12 | 7 | |
| ≥4个 | 18 | 4 | 14 | |
| 生长方式 | ||||
| 膨胀型 | 48 | 34 | 14 | 0.921 |
| 浸润型 | 46 | 32 | 14 | |
| 淋巴管浸润 | ||||
| 无 | 87 | 63 | 24 | 0.1 |
| 有 | 7 | 3 | 4 | |
| 脉管浸润 | ||||
| 无 | 85 | 62 | 23 | 0.075 |
| 有 | 9 | 4 | 5 | |
| 浸润深度 | ||||
| pT2 | 23 | 20 | 3 | 0.004 |
| pT3 | 61 | 43 | 18 | |
| pT4 | 10 | 3 | 7 | |
| Dukes分期 | ||||
| A期 | 18 | 18 | 0 | <0.0001 |
| B期 | 39 | 32 | 7 | |
| C1期 | 19 | 12 | 7 | |
| C2期 | 18 | 4 | 14 | |
| TNM分期 | ||||
| Ⅰ期 | 18 | 18 | 0 | <0.0001 |
| Ⅱ期 | 39 | 32 | 7 | |
| Ⅲ期 | 37 | 16 | 21 | |
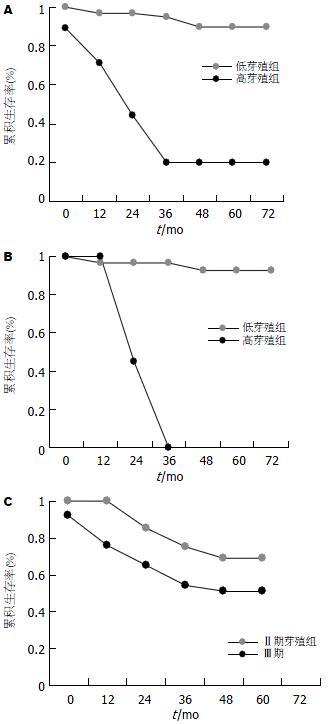
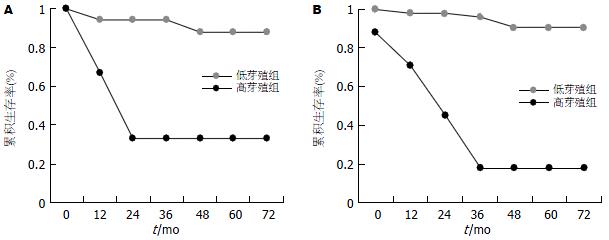
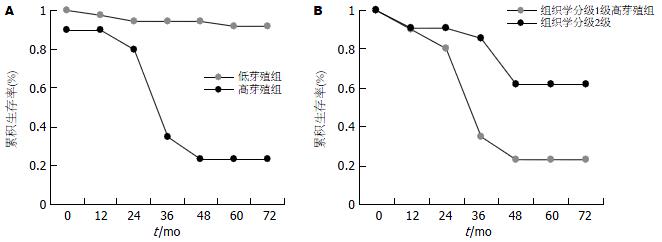
高芽殖组(budding≥10)与低芽殖组(budding<10)患者5 年生存率分别为20%和90%, 生存曲线的差异有显著性意义(P<0.0001); 随着芽殖强度的增加术后生存率逐渐下降(图3A).Ⅱ期高芽殖组与低芽殖组生存曲线的差异亦有显著意义(P<0.001)(图3B); 而Ⅱ期芽殖组与Ⅲ期生存曲线间的差异无统计学意义(图3C, P = 0.116).
T2期高芽殖组与低芽殖组术后5 年生存率分别为33%和90%, 生存曲线间的差异有显著性意义(P<0.001, 图4A); T3期高芽殖组与低芽殖组术后5 年生存率分别为26%和90%, 生存曲线间的差异亦有显著意义(P<0.001, 图4B).
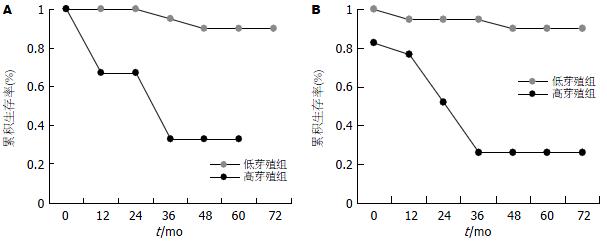
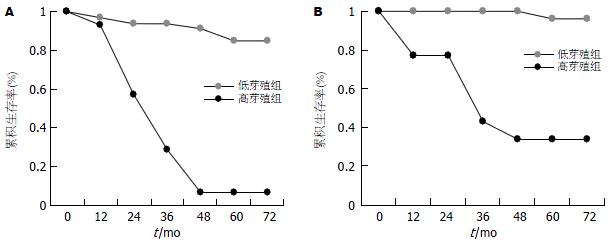
隆起型高低芽殖组间比较术后5 年生存率分别为33%和88%, 生存曲线间的差异有显著性意义(P<0.0001, 图5A); 溃疡型高低芽殖组间比较术后5 年生存率分别为18%和91%, 生存曲线间的差异也具有显著性意义(P<0.0001, 图5B).
组织学分级1级(即高分化腺癌)高低芽殖组术后5 年生存率分别为25%和92%, 2组生存曲线间的差异有显著性意义(P<0.0001, 图6A). 组织学分级1级高芽殖组与组织学分级2级(即中分化腺癌)组生存曲线间的差异有显著性意义(P = 0.015, 图6B), 前者较后者预后更差.
膨胀型生长高低芽殖组间生存曲线间的差异具有显著性意义(P<0.001, 图7A). 浸润型生长高低芽殖组间生存曲线间的差异也具有非常显著性意义(P<0.001, 图7B).
肿瘤芽殖强度与肝, 肺, 骨等血源性复发有显著相关性(P<0.001); 亦与局部复发, 腹膜复发等非血源性复发有显著相关性(P = 0.012); 与术后总复发也存在显著相关性(P<0.001, 表2).
| 复发方式 | n | P值 | |
| 芽殖(0-9) | 芽殖(≥10) | ||
| 血源性 有 | 3 | 17 | <0.001 |
| 无 | 63 | 11 | |
| 非血源 有 | 1 | 4 | 0.012 |
| 无 | 65 | 24 | |
| 总复发 有 | 4 | 21 | <0.001 |
| 无 | 62 | 7 | |
如表3, 根据Cox比例风险模型的多因素分析, 肿瘤芽殖与淋巴结转移数量、肿瘤分化程度、浸润深度等临床病理指标一起被做为独立变量. 肿瘤芽殖强度是影响大肠癌预后的最主要独立变量之一(相对危险度: 40.574; 相对危险度的95%置信区间: 9.222-178.516; P<0.001).
| 变量 | 回归系数(B) | χ2 | P值 | 相对危险度(RR) | 相对危险度的95%置信区间(CI) |
| 肿瘤芽殖 | 3.703 | 23.999 | <0.001 | 40.574 | 9.222-178.516 |
| 淋巴结转移数量 | 1.128 | 6.681 | 0.010 | 3.089 | 1.313-7.265 |
| 分化 | 2.189 | 4.390 | 0.036 | 8.927 | 1.152-69.190 |
| 浸润深度 | 0.771 | 4.072 | 0.044 | 2.162 | 1.022-4.574 |
目前, 在临床上对大肠癌最常用的分期方法是Dukes分期和TNM分期. 他们是指导大肠癌临床合理治疗和判断预后的重要分期系统, 主要包括肿瘤浸润深度和淋巴结转移2个参数, 被普遍作为判断大肠癌预后的最佳指标. 但是, 在临床实践中我们会经常看到相同的Dukes分期, 甚至相同的T分期及N分期的患者预后却截然不同. 因此, 有必要寻找一个能够代表大肠癌恶性侵袭性生物学行为, 反映其预后更加敏感的指标; 以便临床选择更合理的治疗方案, 更准确的判断预后. 多年来外科及病理学者们一直致力于寻找一种反映恶性肿瘤生物学行为的敏感指标及合理的肿瘤分期方法. 人们研究发现实体瘤浸润和转移的第一步是浸润前缘的去分化和离解, 随后肿瘤细胞移行出主瘤体[4]. Zmai于1949年首先描述了在肿瘤浸润前缘的芽殖这一病理特征. 随后许多研究者注意到了这种组织学现象, 并用肿瘤芽殖这一名称代表这一事件, 报道了这种组织学特征及其与转移[1-2,9-11]和长期生存率[3,6,12-15]的关系. Morodomi et al[1]提出肿瘤芽殖的概念, 即肿瘤浸润前缘孤立的单个癌细胞或少于5个癌细胞的癌细胞簇. 本研究表明, 肿瘤芽殖与淋巴结转移数[16-17]、Dukes分期、TNM分期(P<0.0001)、浸润深度(P = 0.004)、肿瘤分化(P = 0.03)等临床病理指标有显著性相关; 此结果与研究类似[2-3,6,18-21]. 相同TNM分期高芽殖组与低芽殖组预后的差异具有显著性(P<0.001), Ⅱ期芽殖组与Ⅲ期病例预后差异无显著性(P = 0.116)[6-8], 提示肿瘤芽殖的有无及其强度可能是判断预后的良好指标. 相同T分期高芽殖组与低芽殖组预后的差异具有显著性(P<0.001); 相同大体类型高芽殖组与低芽殖组预后差异显著(P<0.001); 相同生长方式高芽殖组与低芽殖组预后差异显著(P<0.001); 提示肿瘤芽殖强度是独立于T分期、大体类型、生长方式等代表大肠癌恶性侵袭性生物学行为的又一良好参数. 相同组织学分级中高芽殖组较低芽殖组预后明显差(P<0.0001); 高分化高芽殖组与中分化组生存曲线间的差异有显著性意义(P = 0.015), 前者较后者预后更差, 提示肿瘤芽殖强度较组织学分级可能更好地反映大肠癌恶性侵袭性生物学行为. 肿瘤芽殖强度和术后复发关系的研究表明高芽殖组术后复发率明显高于低芽殖组, 2组间的差异具有非常显著性意义[3-8](P = 0.001), 提示肿瘤芽殖强度是预测肿瘤复发和转移的良好指标.
为了探讨肿瘤芽殖强度与影响大肠癌预后因素的关系, 本研究采用了UICC推荐的Cox模型进行多因素分析, 结果表明, 肿瘤芽殖强度可能是反映大肠癌预后最主要的独立指标.
我们认为肿瘤芽殖强度较好地反映了大肠癌的生物学行为, 是指导大肠癌治疗、判断预后的良好指标, 其检测简单、易操作、有较好的可重复性, 并客观、实用, 易于推广. 我们的结果提示芽殖能为临床提供较为可信的预后评估, 可能是分级系统的一个重要参数, 可在大肠癌常规病理检查中采用并推广.
我们研究结果受取材及切片数量等因素的影响, 且肿瘤芽殖确切的分子机制目前仍不清楚[13,22], 我们将在进一步研究中应用组织微阵列技术, 增加样本量, 以期提高结果的可靠性, 从基因和分子水平进一步探讨肿瘤芽殖的发生机制.
大肠癌是常见的恶性肿瘤, 发病率 高, 预后差. 在临床实践中我们会经常看到相同的Dukes分期, 甚至相同的T分期及N分期的患者预后却截然不同. 因此, 有必要寻找一个能够代表大肠癌恶性侵袭性生物学行为, 反映其预后更加敏感的指标; 以便临床选择更合理的治疗方案, 更准确的判断预后.
肿瘤芽殖的分子机制及在肿瘤复发和转移过程中的作用, 是目前的研究热点.
本文首次报道, 肿瘤芽殖强度与大体类型、组织学分级、生长方式等代表大肠癌恶性侵袭性生物学行为病理参数的联系.
肿瘤芽殖在常规HE染色病理片下就可观察, 其检测简单、易操作、有较好的可重复性, 并客观、实用, 易于推广. 可作为临床判断预后和指导治疗的有效指标.
肿瘤芽殖: 即位于浸润前缘孤立的单个癌细胞或少于5个癌细胞的癌细胞簇.
本文分析了肿瘤芽殖强度与淋巴结转移数, 浸润深度, 肿瘤分化, 生长方式以及复发的相关性. 得出肿瘤芽殖强度是反映大肠癌恶性生物学行为和估计预后的指标. 文章立题新颖, 设计合理, 层次清楚, 分析有据, 具有一定的可读性和参考性.
编辑: 程剑侠 电编:张敏
| 1. | Morodomi T, Isomoto H, Shirouzu K, Kakegawa K, Irie K, Morimatsu M. An index for estimating the probability of lymph node metastasis in rectal cancers. Lymph node metastasis and the histopathology of actively invasive regions of cancer. Cancer. 1989;63:539-543. [PubMed] |
| 2. | Ueno H, Murphy J, Jass JR, Mochizuki H, Talbot IC. Tumour 'budding' as an index to estimate the potential of aggressiveness in rectal cancer. Histopathology. 2002;40:127-132. [PubMed] |
| 3. | Park KJ, Choi HJ, Roh MS, Kwon HC, Kim C. Intensity of tumor budding and its prognostic implications in invasive colon carcinoma. Dis Colon Rectum. 2005;48:1597-1602. [PubMed] |
| 4. | Gabbert H, Wagner R, Moll R, Gerharz CD. Tumor dedifferentiation: an important step in tumor invasion. Clin Exp Metastasis. 1985;3:257-279. [PubMed] |
| 5. | Ueno H, Price AB, Wilkinson KH, Jass JR, Mochizuki H, Talbot IC. A new prognostic staging system for rectal cancer. Ann Surg. 2004;240:832-839. [PubMed] |
| 6. | Hase K, Shatney C, Johnson D, Trollope M, Vierra M. Prognostic value of tumor "budding" in patients with colorectal cancer. Dis Colon Rectum. 1993;36:627-635. [PubMed] |
| 7. | Okuyama T, Oya M, Ishikawa H. Budding as a useful prognostic marker in pT3 well- or moderately-differentiated rectal adenocarcinoma. J Surg Oncol. 2003;83:42-47. [PubMed] |
| 8. | Okuyama T, Nakamura T, Yamaguchi M. Budding is useful to select high-risk patients in stage II well-differentiated or moderately differentiated colon adenocarcinoma. Dis Colon Rectum. 2003;46:1400-1406. [PubMed] |
| 9. | Morodomi T. Clinicopathological studies of advanced rectal cancers--prediction of the degree of lymph node metastasis from histopathological finding of pre-operative biopsy specimens. Nippon Geka Gakkai Zasshi. 1988;89:352-364. [PubMed] |
| 10. | Araki Y, Isomoto H, Shirouzu K, Miura K, Iwanaga H, Okita A, Sasatomi T, Ogata Y, Morodomi T, Kakegawa T. Clinicopathological characteristics of colorectal submucosal carcinoma with lymph node metastasis. Kurume Med J. 1993;40:123-127. [PubMed] |
| 11. | Park SY, Choe G, Lee HS, Jung SY, Park JG, Kim WH. Tumor budding as an indicator of isolated tumor cells in lymph nodes from patients with node-negative colorectal cancer. Dis Colon Rectum. 2005;48:292-302. [PubMed] |
| 12. | Okuyama T, Oya M, Yamaguchi M. Budding (sprouting) as a useful prognostic marker in colorectal mucinous carcinoma. Jpn J Clin Oncol. 2002;32:412-416. [PubMed] |
| 13. | Masaki T, Matsuoka H, Sugiyama M, Abe N, Izumisato Y, Sakamoto A, Atomi Y. Laminin-5 gamma2 chain expression as a possible determinant of tumor aggressiveness in T1 colorectal carcino-mas. Dig Dis Sci. 2003;48:272-278. [PubMed] |
| 14. | Prall F, Nizze H, Barten M. Tumour budding as prognostic factor in stage I/II colorectal carcinoma. Histopathology. 2005;47:17-24. [PubMed] |
| 15. | Nilsson PJ, Rubio C, Lenander C, Auer G, Glimelius B. Tumour budding detected by laminin-5 {gamma}2-chain immunohistochemistry is of prognostic value in epidermoid anal cancer. Ann Oncol. 2005;16:893-898. [PubMed] |
| 16. | Okuyama T, Oya M, Ishikawa H. Budding as a risk factor for lymph node metastasis in pT1 or pT2 well-differentiated colorectal adenocarcinoma. Dis Colon Rectum. 2002;45:628-634. [PubMed] |
| 17. | Masaki T, Matsuoka H, Sugiyama M, Abe N, Sakamoto A, Watanabe T, Nagawa H, Atomi Y. Tumor budding and evidence-based treatment of T2 rectal carcinomas. J Surg Oncol. 2005;92:59-63. [PubMed] |
| 18. | Hase K, Shatney CH, Mochizuki H, Johnsn DL, Tamakuma S, Vierra M, Trollope M. Long-term results of curative resection of "minimally invasive" colorectai cancer. Dis Colon Rectum. 1995;38:19-26. |
| 19. | Tanaka M, Hashiguchi Y, Ueno H, Hase K, Mochizuki H. Tumor budding at the invasive margin can predict patients at high risk of recurrence after curative surgery for stage II, T3 colon cancer. Dis Colon Rectum. 2003;46:1054-1059. [PubMed] |
| 20. | Hase K, Ueno H, Kurihara H, Yoshimura K, Ozawa K, Hashiguchi Y, Mochizuki H, Shimazaki H, Aida S, Matsukuma S. Risk factors for an adverse outcome in early invasive colorectal carcinoma. Gastroenterology. 2004;127:385-394. |
| 21. | Minsky BD, Mies C, Rich TA, Recht A. Lymphatic vessel invasion is an independent prognostic factor for survival in colorectal cancer. Int J Radiat Oncol Biol Phys. 1989;17:311-318. [PubMed] |
| 22. | Masaki T, Sugiyama M, Matsuoka H, Abe N, Izumisato Y, Sakamoto A, Atomi Y. Coexpression of matrilysin and laminin-5g2 chain may contribute to tumor cell migration in colorectal carcinomas. Dig Dis Sci. 2003;48:1262-1267. |