修回日期: 2007-08-23
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 观察珠子参对小鼠移植性肝癌(H22)的增殖抑制作用及其作用机制.
方法: 建立H22小鼠肝癌实体瘤模型, 观察珠子参对荷瘤小鼠肿瘤生长的抑制作用, 放免法(RIA)检测血清中肿瘤坏死因子(TNF)-α含量, 光镜(HE染色)观察肿瘤细胞生长增殖状态, 并在透射电镜下观察肿瘤细胞超微结构形态, 流式细胞仪技术(FCM)检测细胞凋亡并进行周期分析.
结果: 与模型对照组相比, 珠子参低浓度和高浓度组和5-FU组小鼠平均肿瘤质量均显著降低(1.66±0.96 g, 1.49±0.52 g, 1.56±0.19 g vs 2.70±0.90 g, 均P<0.01); 珠子参低浓度和高浓度组小鼠胸腺平均质量和胸腺指数均高于模型对照组(胸腺平均质量: 74.18±20.51 mg, 80.25±15.73 mg vs 61.82±12.26 mg, P>0.05, P<0.05; 胸腺指数: 3.17±1.28 mg/g, 3.36±1.17 mg/g vs 2.35±0.60 mg/g); 与5-FU组(59.51±24.74 mg, 2.18±1.18 mg/g)比较, 珠子参高浓度组平均胸腺质量和胸腺指数均增高, 且结果有显著差异(均P<0.01); 血清中TNF-α浓度珠子参低浓度和高浓度组高于正常对照组(12.89±1.10 pmol/L, 12.15±2.35 pmol/L vs 10.97 ±1.16 pmol/L), 而比模型对照组低(15.31±3.45 pmol/L, 均P<0.05); 光镜观察到珠子参组小鼠肿瘤组织周围有大量的吞噬细胞和淋巴细胞浸润, 电镜下可见珠子参组癌细胞胞质浓染, 核固缩, 线粒体明显减少; FCM分析显示, 珠子参低浓度和高浓度组与模型组相比G0-G1期(35.73%±5.90%, 33.78%±6.12% vs 36.59%±2.61%)和S期细胞(42.51%±9.85%, 50.48%±3.28% vs 52.46%±2.76%)减少, 而G2-M期细胞(21.76%±7.02%, 15.73%±6.91% vs 10.96%±2.75%, 均P<0.01)和凋亡细胞(26.88%±1.22%, 27.69%±0.21% vs 9.45%±0.14%, 均P<0.01)增加.
结论: 珠子参对H22肝癌小鼠具有良好的抑瘤作用, 其作用机制可能与珠子参阻止G2-M期细胞转换而影响癌细胞在细胞周期中的进程, 干扰S期DNA合成以及诱导小鼠肝癌细胞凋亡有关.
引文著录: 陈涛, 胡卫, 崔帮平, 黎家华. 珠子参对小鼠H22肝癌抑制作用及机制. 世界华人消化杂志 2007; 15(24): 2597-2601
Revised: August 23, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To observe the action of panax japlcus var (PJ) on mouse liver cancer and its mechanism of action.
METHODS: Mouse models of solid tumor liver cancer were established. The rate of inhibition of solid tumors was observed. The cell cycle and apoptosis were measured by flow cytometry. The content of tumor necrosis factor (TNF)-α in serum was examined by radioimmunoassay. Optical and transmission electron microscopy were used to observe cytomorphological changes.
RESULTS: Low and high concentration of PJ obviously inhibited tumor growth. PJ decreased the number of cells in G0-G1 (35.73% ± 5.90%, 33.78% ± 6.12% vs 36.59% ± 2.61%) and S phase (42.51% ± 9.85%, 50.48% ± 3.28% vs 52.46% ± 2.76%), and increased the number of cells in G2-M phase (21.76% ± 7.02%, 15.73% ± 6.91 % vs 10.96% ± 2.75%, both P < 0.01) and the number of apoptotic cells (26.88% ± 1.22%, 27.69% ± 0.21% vs 9.45% ± 0.14%, both P < 0.01). The serum level of TNF-α in the two PJ groups was higher than that in the normal control group (12.89 ± 1.10 pmol/L, 12.15 ± 2.35 pmol/L vs 10.97 ± 1.16 pmol/L), but lower than that in the model control group (15.31 ± 3.45 pmol/L, both P < 0.05). Transmission electron microscopy revealed that some cells in the solid tumors of the PJ group had some morphological characteristics of apoptosis.
CONCLUSION: PJ appears to suppress liver cancer in mice. The anticancer mechanism is probably associated with the arrest of the cell cycle at G2-M to G1 phase transition, interference with DNA synthesis in the S phase, and the induction of cancer cell apoptosis. PJ also inhibits the abnormal elevation of TNF-α in tumor-bearing mice, and TNF-α is maintained at a certain level for anti-tumor effects and regulation of immunity.
- Citation: Chen T, Hu W, Cui BP, Li JH. Panax japlcus var inhibition of proliferation of H22 cells in mice and its mechanism of action. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2597-2601
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2597.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2597
原发性肝癌(简称肝癌)是最常见的恶性肿瘤之一, 开展中医药诊治肝癌的研究, 研制和开发治疗肝癌的高效低毒药物, 具有重要的意义[1]. 珠子参[Panax japlcus var, major(Burk)C. Y. Wuetk. M. Feng]为五加科人参属植物大叶三七或羽叶三七的串珠状根茎, 具有活血散瘀、补血止血、消肿止痛之功[2]. 二十世纪八、九十年代以来对其有效成分和药理作用开展了研究, 但珠子参在治疗肿瘤方面的报道尚属空白. 根据珠子参民间应用的经验及其成分和药理作用的分析, 我们率先开展了珠子参抗肿瘤作用的实验研究, 结果显示该药具有较好的抑瘤功效. 在珠子参治疗肝癌的实验中, 观察到珠子参对体外培养的人肝癌细胞(SMMC-7721)有良好的抑制作用[3], 并且形态学观察显示该药能明显诱导肝癌细胞凋亡. 在此基础上, 我们进一步研究了珠子参对肝癌H22荷瘤小鼠的抑瘤效应和诱导肝癌细胞凋亡的作用, 并通过分析细胞周期来揭示其抑制肝癌细胞增殖和诱导肝癌细胞凋亡的可能机制.
昆明种封闭群小鼠: ♂, 体质量22±2 g, 共60只. 购自湖北省实验动物中心(许可证号: SCXK(鄂)2003-0005). H22细胞株: 华中科技大学同济医学院药学系曾凡波老师惠赠, 接种于Km小鼠腹腔内传代保存. 珠子参购于宜昌市久康药房, 经宜昌市药检所鉴定, 产地: 神农架; 批号: 2002-01. 5-氟尿嘧啶(5-FU)(天津氨基酸公司人民制药厂): 针剂, 250 mg/支, 灭菌生理盐水稀释至一定浓度, 避光常温保存, 用作阳性对照物. 肿瘤坏死因子(TNF-α)放免分析药盒: 购自北京北方生物技术研究所. Coulter DNA-Prep Reagents Kit: 购自Coulter公司, 批号: 760204K. DFM-96型10管放射免疫γ计数器; 透射电子显微镜: 日立H-7500; 流式细胞仪(EPICS型): 美国Beckman coulter公司; 自动平衡离心机(LDZ5-2型): 北京医用离心机厂; 电子天平(MP200A型): 上海良平仪器厂.
珠子参根茎烘干称质量, 研磨成粗粉, 装入圆底烧瓶内加10倍体积蒸馏水浸泡2 h, 然后将圆底烧瓶置于电子恒温水浴锅中, 恒温80℃加热8 h后, 中性滤纸过滤后弃掉药渣, 将所得的药液进一步浓缩至终浓度为660 g/L(即1 mL药液中含原生药0.66 g). 分装于灭菌试管, 4℃冰箱保存备用. 5-FU: 在超净工作台避光条件下, 无菌生理盐水稀释5-FU针剂至2.5 g/L后分装于EP管并用锡纸遮盖保存于4℃冰箱.
肝癌H22细胞株昆明小鼠体内连续传代3代后, 抽取接种7 d左右种鼠腹水, 呈乳白色, D-Hanks液洗涤离心(800 r/min×5 min)3次, 调整细胞浓度至1.0×1010 个/L, 台盼蓝拒染法检测存活率≥95%, 将细胞悬液注射至健康小鼠右腋皮下, 每只鼠0.2 mL. 全程严格无菌操作, 40 min内完成. 60只昆明小鼠分笼饲养, 自由摄食与饮水. 造模后随机分组: 模型组, 模型+珠子参组(简称珠子参组), 模型+5-FU组(简称5-FU组), 珠子参组又分为高浓度和低浓度2组(PJ高浓度组和PJ低浓度组), 每组12只小鼠. 造模后第2天起, PJ高浓度组每只小鼠按10 g生药/kg体质量ig给药, PJ低浓度组每只小鼠按5 g生药/kg体质量ig给药, 连续10 d; 同时给予模型对照组和5-FU组每只小鼠分别ig等体积生理盐水. 5-FU组每只小鼠按25 mg/kg体质量ip给药, 隔天1次, 共5次; 同时给予模型对照组和珠子参各组每只小鼠ip等体积生理盐水. 造摸7 d后, 各组小鼠腋下均可触摸到瘤块, 接种成功率100%.
1.2.1 抑瘤率和胸腺指数检测: 给药结束后第2天, 小鼠称重摘除眼球法取血处死, 完整剥离肿瘤组织和胸腺, 电子天平称质量, 计算抑瘤率和胸腺指数. 抑瘤率 = (1- )×100%, 胸腺指数 = ×10.
1.2.2 肿瘤细胞形态学改变: 取各组小鼠肿瘤组织, 40 g/L甲醛固定, 常规脱水, 石蜡包埋, 切片, HE染色, 光镜下观察肿瘤生长、坏死及对周围组织的浸润等情况. 取各组小鼠肿瘤组织, 按电镜标本常规处理, 透射电镜观察肿瘤细胞超微结构形态.
1.2.3 TNF-α活性检测: 小鼠摘除眼球取血, 37℃孵育促凝血, 1500 r/min离心数次至血清析出, 取上清送至宜昌市中心医院放免科RIA检测.
1.2.4 细胞周期分析和细胞凋亡检测: 取新鲜肿瘤组织剪碎, 用200目过滤制备单细胞悬液. 离心(800 r/min×5 min)洗涤3次后, 调整细胞浓度为1×109 个/L, 4℃ 700 mL/L的乙醇固定30 min, 用含Rnase及碘化丙啶(PI)染色液染30 min后上流式细胞仪检测DNA含量的变化, 并用Multicycle软件分析细胞周期变化.
统计学处理 数据采用单因素方差分析, 应用SPSS10.0在PC上进行处理.
与模型对照组相比, 珠子参各组和5-FU组小鼠平均肿瘤质量均显着降低(P<0.01, 表1). PJ高浓度组小鼠胸腺平均质量和胸腺指数均高于模型对照组和5-FU组(P<0.05和P<0.01, 表1). PJ低浓度组小鼠胸腺指数高于5-FU组(P<0.05, 表1).
与正常对照组相比, 珠子参组和5-FU组血清TNF-α水平升高, 但无统计学差异, 而模型对照组血清TNF-α水平显著高于其他各组(P<0.05, 表2).
光镜HE染色可见: 模型组瘤细胞排列紊乱, 大量侵入骨骼肌, 核染色深, 异型性明显, 可见较多瘤巨细胞, 部分呈大片或带状凝固性坏死; 珠子参组肿瘤细胞排列紊乱, 核染色深, 大小不一, 可见瘤巨细胞, 坏死不如模型组严重, 肿瘤细胞周围可见大量淋巴细胞及巨噬细胞浸润; 5-FU组肿瘤组织较局限, 有纤维组织包裹, 少见瘤巨细胞.
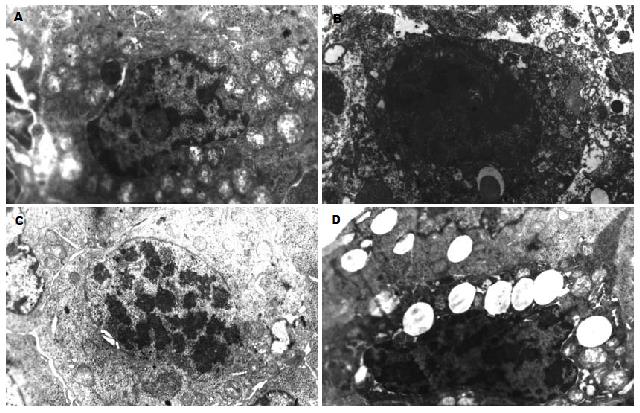
透射电镜观察肿瘤细胞超微结构形态可见: 模型组细胞生长旺盛, 线粒体多且普遍增大; 5-FU组细胞变性坏死严重, 有大量细胞崩解、死亡. 胞质中见大量肿胀线粒体, 细胞核高度异常, 可见核碎裂, 核染色质溶解, 胞质深染; 珠子参组可见: 有的瘤细胞线粒体明显减少, 线粒体脊减少; 有的瘤细胞线粒体严重受损, 空泡化严重. 同时多处细胞有核固缩, 核边移胞质浓染或者细胞核染色质碎裂浓缩成不规则团块, 出现凋亡的形态改变(图1).
FCM检测腹水中肝癌细胞的DNA含量, 细胞各期所占百分比如表3所示. 结果表明, 珠子参能诱导肝癌细胞凋亡, 其中珠子参高浓度组诱导的细胞凋亡率最高. 模型对照组细胞的凋亡为肿瘤细胞自发的凋亡. 从周期分析结果可以看出, 珠子参可使G2-M期细胞聚积, 阻止了M-G1期的转换, 从而干扰了小鼠肝癌H22细胞在细胞周期中的进程. 同时, 珠子参能使S期细胞减少, 可能与干扰了癌细胞DNA合成有关.
细胞凋亡是在一定的生理或病理条件下, 细胞受到某种信号的触发后主动参与并遵循一定程序的死亡过程, 在整个过程中发生一系列特殊基因的改变及生化、形态特征的改变[4]. 肝癌细胞的凋亡在肝癌的发生发展, 转归及治疗等方面发挥着重要的作用, 近年来, 有关中药诱导肝癌细胞凋亡的研究报道逐年增多[5-10]. 珠子参诱导肝癌细胞凋亡可能与其细胞毒作用一起发挥抗癌效应. 周期分析结果表明: 珠子参可使G2-M期细胞聚积, 阻止了M-G1期的转换, 从而干扰了小鼠肝癌H22细胞在细胞周期中的进程. 同时, 珠子参能使S期细胞减少, 可能与干扰了癌细胞DNA合成有关.
TNF-α具有抗肿瘤、抗病毒及免疫调节等广泛的生物学效应. 但实体瘤患者血清TNF-α水平异常升高, 会严重破坏细胞因子之间正向的协调作用, 造成细胞因子网络功能紊乱, 并可引起脂肪降解、血管渗漏、内源性致热等病理损伤. 因此, TNF-α的生物学作用与其体内的水平高低密切相关. 实验结果显示: 珠子参组TNF-α水平高于正常组, 但显着低于模型组, 表明珠子参具有抑制荷瘤机体TNF-α水平异常升高的作用, 使其维持在一定水平而发挥抗肿瘤、调节机体免疫功能等积极作用,至于其最佳水平范围则有待进一步探明.
本研究结果显示, 珠子参生药在5 g/kg和10 g/kg剂量下ig给药, 对小鼠移植性肝癌具有较好的抑瘤效果, 其作用机制可能与珠子参诱导肝癌细胞凋亡和影响细胞周期以及调节TNF-α水平有关.
原发性肝癌是最常见的恶性肿瘤之一, 研制和开发治疗肝癌的高效低毒药物, 具有重要的意义. 珠子参为五加科人参属植物大叶三七或羽叶三七的串珠状根茎, 具有活血散瘀、补血止血、消肿止痛之功. 但珠子参在治疗肿瘤方面的报道尚属空白.
近年来, 有关中药诱导肝癌细胞凋亡的研究报道逐年增多. 珠子参诱导肝癌细胞凋亡可能与其细胞毒作用一起发挥抗癌效应.
本文充分挖掘民间用药经验, 率先开展了珠子参抗肿瘤的研究, 并从直接细胞毒作用、诱导肿瘤细胞分化年、诱导肿瘤细胞凋亡等几个方面研究其治疗肿瘤的机制, 有一定的创新性.
本文报道了珠子参对H22肝癌小鼠的抑瘤效应及其对肿瘤细胞周期和小鼠血清中TNF-α含量的影响, 研究内容丰富, 采用的方法较得当, 结果结论较可信, 有一定的参考价值.
编辑: 张焕兰 电编:何基才
| 8. | 李 锦毅, 李 德新. 中药诱导肝癌小鼠细胞凋亡作用及细胞周期变化的实验研究. 中国中医基础医学杂志. 2002;8:29-30. |