修回日期: 2007-08-17
接受日期: 2007-08-28
在线出版日期: 2007-08-28
目的: 研究上调Smad7表达对肝星形细胞(HSC)α1(Ⅰ)和α1(Ⅲ)前胶原基因转录的作用.
方法: 应用Fugene6介导Smad7质粒转染体外培养的HSC-T6细胞. 继续培养48 h. 同时使用实时定量聚合酶链式反应(Real time-PCR), 逆转录酶链式反应(RT-PCR)方法检测Smad7质粒组和正常对照组、空载质粒对照组α1(Ⅰ)和α1(Ⅲ)前胶原mRNA水平.
结果: 与正常对照组和空载质粒对照组相比, Smad7质粒转染HSC-T6细胞48 h后, Smad7 mRNA水平显著增高(1.29±0.18 vs 0.11±0.02, 0.13±0.02, 均P<0.01), α1(Ⅰ)前胶原mRNA表达明显下降(0.10±0.01 vs 1.18±0.15, 1.07±0.12, 均P<0.01), 但α1 (Ⅲ)前胶原基因表达无明显改变(0.72±0.00 vs 0.70±0.01, 0.75±0.01, 均P>0.05).
结论: Smad7能明显抑制HSC细胞α1(Ⅰ)前胶原mRNA转录.
引文著录: 阮艺华, 刘海林. Smad7质粒转染对肝星形细胞α1(Ⅰ)和α1(Ⅲ)前胶原基因表达的影响. 世界华人消化杂志 2007; 15(24): 2593-2596
Revised: August 17, 2007
Accepted: August 28, 2007
Published online: August 28, 2007
AIM: To investigate the effects of Smad7 on expressions of procollagen α1 (Ⅰ) and α1 (Ⅲ) genes in a cultured hepatic stellate cell line (HSC-T6).
METHODS: Smad7 plasmid was transfected into the HSC-T6 cell line by Fugene6. After 48 hours, the levels of procollagen α1 (Ⅰ) and α1 (Ⅲ) mRNA were determined by real-time polymerase chain reaction and reverse transcriptase-polymerase chain reaction, respectively.
RESULTS: Compared with the normal control and empty plasmid control groups, the expression of Smad7 mRNA was significantly increased in the Smad7 plasmid group after 48 hours (1.29 ± 0.18 vs 0.11 ± 0.02, 0.13 ± 0.02, both P < 0.01), and the level of procollagen α1 (Ⅰ) mRNA declined markedly (0.10 ± 0.01 vs 1.18 ± 0.15, 1.07 ± 0.12, both P < 0.01). However, there was no statistically significant variation of procollagen α1 (Ⅲ) mRNA among the three groups (0.72 ± 0.00 vs 0.70 ± 0.01, 0.75 ± 0.01, both P > 0.05).
CONCLUSION: Smad7 may significantly inhibit the transcription of procollagen α1 (Ⅰ) mRNA. The mechanism may involve Smad7 antifibrosis.
- Citation: Ruan YH, Liu HL. Upregulation of Smad7 in the expression of procollagen α1(Ⅰ) and α1(Ⅲ) genes in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2007; 15(24): 2593-2596
- URL: https://www.wjgnet.com/1009-3079/full/v15/i24/2593.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i24.2593
肝纤维化是由于细胞外基质(extracellular matrix, ECM)在肝内过多沉积的结果. 肝星形细胞(HSC)在肝纤维化的发生、发展过程中起主导作用. 激活的HSC合成大量的ECM, 其中Ⅰ, Ⅲ型胶原为主要组成成分. Smad7能够通过抑制转化生长因子-β1(transforming growth factor-β, TGF-β1)的信号转导, 发挥抗肝纤维化作用[1-3]. 虽然有研究表明Smad7抑制a1(Ⅰ)前胶原转录[4-5], 但大多采用RT-PCR方法, 定量的准确性不高. 有关Smad7对a1(Ⅲ)前胶原表达的作用, 少有报道. 本文应用Real time-PCR定量检测了Smad7对HSC-T6 a1(Ⅰ)和a1(Ⅲ)前胶原基因表达的影响, 探讨其作用环节.
HSC-T6细胞由上海中医药大学肝病研究所提供; pcDNA3.0-人Smad7重组质粒和pcDNA3.0空载质粒由本院组织工程实验室惠赠; Fugene6转染试剂购自Roche公司; TRIzol试剂盒购自Gibco公司; 各目的基因引物由上海生工生物工程公司合成.
将HSC-T6细胞接种于6孔培养板中, 细胞浓度为1×108/L, 每孔2 mL. 37℃, 50 mL/L CO2、饱和湿度培养24 h, 随机分为正常对照组、空载质粒对照组和Smad7质粒组, 每组4个复孔. 分别加入同体积的DMEM培养基、含2 mg pcDNA3.0空载质粒或pcDNA3.0-人Smad7重组质粒的Fugene6(Roche公司)转染液, 继续培养48 h, 收集细胞进行各项相关检测. 用TRIzol试剂盒提取HSC-T6细胞总RNA. 取总RNA 2 mg根据RT试剂盒使用说明书, 逆转录为cDNA. 然后, 在Mx3000P实时荧光定量PCR仪(美国Stratagene公司)上定量检测Smad7, a1(Ⅰ)前胶原和a1(Ⅲ)前胶原mRNA水平. 各目的基因引物序列如下. Smad7: 5'-CAACTGCAGACTGTCCAGATG-3'(上游), 5'-CTGCTGCATAAACTCGTGGTC-3'(下游); a1(Ⅰ)前胶原: 5'-CCAATCTGGTTCCCTCCC-3'(上游), 5'-AGGTTGAATGCACTTTTGG-3'(下游); a1(Ⅲ)前胶原: 5'-GTACAGCTGGCCTTCCTCAG-3'(上游), 5'-GGCCTTGCGTGTTTGATATT-3'(下游); 反应体系为: ddH2O 10.125 mL, cDNA 1 mL, 2×SYBR Green QPCR master mix 12.5 mL, ROX passive reference 0.375 mL, Forward primer (10 mmol/L) 0.5 mL, Reverse primer (10 mmol/L) 0.5 mL, 总体积25 mL. 每个样品设3个复孔, 并设置无模板对照. 各目的基因反应条件为: Smad7: 95℃预变性10 min, 95℃ 2 min, 60℃ 30 s, 72℃ 1.5 min, 共40个循环; a1(Ⅰ)前胶原: 95℃预变性10 min, 94℃ 30 s, 60℃ 30 s, 72℃ 30 s, 共40个循环; a1(Ⅲ)前胶原: 95℃预变性10 min, 94℃ 30 s, 55℃ 45 s, 72℃ 30 s, 共40个循环. 循环结束后继续进行建立熔解曲线的反应, 最后用专用软件自动分析结果. mRNA水平用相对含量图表示. 同时采用PCR测定各目的基因mRNA水平. 除Smad7和a1(Ⅲ)前胶原为28个循环, a1(Ⅰ)前胶原扩增30个循环外, 引物和其他反应条件同上. PCR产物经12 g/L琼脂糖凝胶电泳后, 天能凝胶分析系统图像分析. 计算目的基因条带灰度值, 与内参β-actin条带灰度值的比值, 作为该目的基因表达的相对值.
统计学处理 数值用mean±SD表示, 多组比较用方差分析, 两组间比较用t检验.
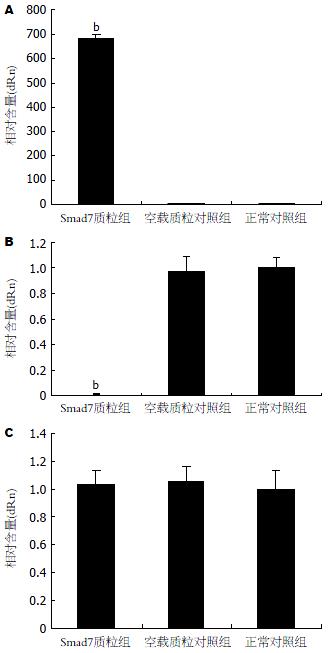
Real time-PCR结果显示, 与正常对照组和空载质粒对照组相比, Smad7质粒组Smad7 mRNA水平显著增高(P<0.01, 图1A); RT-PCR测定Smad7质粒组、正常对照组和空载质粒对照组Smad7 mRNA表达相对含量分别为: 1.29±0.18, 0.11±0.02和0.13±0.02, 与正常对照组和空载质粒对照组相比, 差异有统计学意义(P<0.01), 与Real time-PCR结果一致, 表明Smad7质粒在Fugene6介导下有效转染至HSC-T6细胞.
Real time-PCR检测Smad7质粒组a1(Ⅰ)前胶原mRNA水平较正常对照组和空载质粒对照组明显降低(P<0.01, 图1B), 但3组a1(Ⅲ)前胶原mRNA水平无显著差异(P>0.05, 图1C). RT-PCR测定Smad7质粒组、正常对照组和空载质粒对照组a1(Ⅰ)和a1(Ⅲ)前胶原mRNA表达相对含量与Real time-PCR结果一致[a1(Ⅰ): 0.10±0.01 vs 1.18±0.15, 1.07±0.12, 均P<0.01; a1(Ⅲ): 0.72±0.00 vs 0.70±0.01, 0.75±0.01, 均P>0.05].
Ⅰ型胶原由两条α1(Ⅰ)前胶原和一条α2(Ⅰ)前胶原组合而成; Ⅲ型胶原由3条α1(Ⅲ)前胶原组合而成. 肝纤维化时, 不仅总胶原含量显著增加, 而且各胶原成分的构成比与分布发生改变, 其中以Ⅰ型胶原增加为主, 使Ⅰ/Ⅲ型比例增高. TGF-β1能促进肝星形细胞活化, 使ECM合成增加, 降解减少, 是最主要的促肝纤维化细胞因子之一[6-8]. TGF-β1通过TGF-β1/Smads信号转导通路发挥作用. TGF-β1首先与其Ⅱ型受体结合, 活化的Ⅱ型受体蛋白激酶使Ⅰ型受体磷酸化, 活化的Ⅰ型受体蛋白激酶作用于Smad2, 3, 使其磷酸化, 随后Smad2, 3与4形成异源寡聚体复合物, 移入核内[9-13]. 在核内其与目的基因启动子区的Smads反应元件结合, 启动基因转录, 包括胶原基因、Smad7基因等[14].
活化的Smad2, 3和4形成的异源寡聚体复合物进入核内促进纤溶酶源激活物抑止因子-1(plasminogen activator inhibitor-1, PAI-1)和Ⅶ型胶原的表达, 进而使ECM合成增加而降解减少[15-16]. HSC合成量最大的Ⅰ型胶原需要Smad3的作用, 在HSC内, Smad3, Sp1共同结合于a2(Ⅰ)胶原基因序列-313至-255位点, 该位点有很强的增强子活性, 结合Smad3, Sp1后胶原基因表达明显增加[17-20]. 有关TGF-β1对Ⅲ型胶原合成影响的分子机制尚不明了.
Smad7是TGF-β1/Smads信号转导通路中的主要抑制性调控蛋白, 通过与R-smads(Smad2, 3)竞争性结合TGF-β1受体Ⅰ(TbRⅠ), 抑制TGF-β1/Smads的信号转导; 另一方面Smad7还可与smurfl/2结合, 通过泛素化途径降解TβRⅠ, 对TGF-β1细胞内信号转导进行负反馈调节[21-23]. Dooley et al[4]应用携带Smad7的腺病毒转染原代培养的HSC后, HSC活化被抑制, a1(Ⅰ)前胶原mRNA水平降低. 对原代培养的HSC转染Smad7, 可显著抑制TGF-β1诱导的a1(Ⅰ)前胶原基因表达[5]. 本文采用Fugene6介导Smad7质粒转染HSC-T6细胞, 使Smad7过度表达, Real time-PCR和RT-PCR检测均表明a1(Ⅰ)前胶原mRNA水平显著下降, 提示抑制HSC a1(Ⅰ)前胶原基因转录可能是Smad7抗肝纤维化的作用机制之一.
关于Smad7对a1(Ⅲ)前胶原mRNA表达的作用, 目前尚未见报道. 最近, 有人应用精氨酸-甘氨酸-天冬氨酸(RGD)三肽引物与Smad7共同构建的重组质粒转染HSC, 测定细胞上清夜中Ⅲ型胶原蛋白含量减少. 但本结果显示上调Smad7基因表达对a1(Ⅲ)前胶原mRNA水平无明显影响. 推测这可能与RGD本身的作用有关. RGD三肽可以促进HSC胶原酶的表达, 从而使胶原的降解增加[24]. 同时, 还可拮抗TGF-β1对ECM分泌的促进作用[25]. 由于从基因转录到胶原合成分泌, 涉及转录后修饰、翻译、降解等多个环节, Smad7对a1(Ⅲ)型胶原生成的作用还有待进一步研究.
总之, 通过上调Smad7表达能够显著抑制HSC a1(Ⅰ)前胶原基因转录, 为今后用于肝纤维化防治提供了实验依据.
转化生长因子-β1能促进肝星形细胞活化, 使EC M合成增加, 降解减少, 是最主要的促肝纤维化细胞因子之一. Smad7能够通过抑制TGF-β1的信号转导, 发挥抗肝纤维化作用. 研究表明Sma d7 可抑制 a1(Ⅰ) 前胶原转录, 进而减少细胞外基质的合成, 而有关Sma d7 对Ⅲ型胶原合成影响的研究甚少.
Sma d7 抗肝纤维化的机制是目前防治肝纤维化研究中的热点. 研究表明Sma d7 可抑制α1(Ⅰ) 前胶原转录, 从而发挥其抗肝纤维化的作用, 有关Smad7对Ⅲ型胶原合成的影响还鲜见报道, 且TGF-b1对Ⅲ型胶原合成影响的分子机制尚不明了.
虽然有研究表明Smad7抑制α1(Ⅰ)前胶原转录, 但大多采用RT-PCR方法, 定量的准确性不高. 有关Smad7对α1(Ⅲ) 前胶原表达的作用, 少有报道. 本文应用Real time-PCR定量检测了Sma d7对HSC-T6 α1(Ⅰ)和α1(Ⅲ) 前胶原基因表达的影响,探讨其作用环节.
本文通过Sma d7质粒转染体外培养的HSC-T6细胞, 进而来研究Sma d7 表达的上调对HSC细胞 α1(Ⅰ) 前胶原以及α1(Ⅲ) 前胶原的影响, 发现上调Sma d7 表达能够显著抑制HSC α1(Ⅰ) 前胶原基因转录, 而上调Sma d7 基因表达对α1(Ⅲ) 前胶原 mRNA水平无明显影响, 为今后用于肝纤维化防治提供了实验依据.
素化途径: 即素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP)是细胞内降解蛋白质的重要途径, 主要经细胞颗粒中的蛋白酶体降解泛素化的细胞内蛋白质, 与细胞多种生理功能调节密切相关.
本文采用定量 PCR的方法对于转染Sma d7 质粒后的肝星状细胞 α1(Ⅰ) 前胶原以及α1(Ⅲ) 前胶原 mRNA的表达进行定量的研究, 有一定的新颖性, 所采用的技术较得当, 结果结论较可信, 有一定的可读性和学术价值.
编辑: 何燕 电编:张敏
| 1. | Ten Dijke P, Goumans MJ, Itoh F, Itoh S. Regulation of cell proliferation by Smad proteins. J Cell Physiol. 2002;191:1-16. [PubMed] |
| 2. | Hayashi H, Abdollah S, Qiu Y, Cai J, Xu YY, Grinnell BW, Richardson MA, Topper JN, Gimbrone MA Jr, Wrana JL, Falb D. The MAD-related protein Smad7 associates with the TGFbeta receptor and functions as an antagonist of TGFbeta signaling. Cell. 1997;89:1165-1173. [PubMed] |
| 3. | Chen Y, Bhushan A, Vale W. Smad8 mediates the signaling of the receptor serine kinase. Proc Natl Acad Sci USA. 1997;94:12938-12943. |
| 4. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] |
| 5. | Tsukada S, Westwick JK, Ikejima K, Sato N, Rippe RA. SMAD and p38 MAPK signaling pathways independently regulate alpha1(I) collagen gene expression in unstimulated and transforming growth factor-beta-stimulated hepatic stellate cells. J Biol Chem. 2005;280:10055-10064. [PubMed] |
| 6. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-807. [PubMed] |
| 7. | Zimmerman CM, Padgett RW. Transforming growth factor beta signaling mediators and modulators. Gene. 2000;249:17-30. [PubMed] |
| 8. | Lehmann TG, Wheeler MD, Schoonhoven R, Bunzendahl H, Samulski RJ, Thurman RG. Delivery of Cu/Zn-superoxide dismutase genes with a viral vector minimizes liver injury and improves survival after liver transplantation in the rat. Transplantation. 2000;69:1051-1057. [PubMed] |
| 9. | Calabrese F, Valente M, Giacometti C, Pettenazzo E, Benvegnu L, Alberti A, Gatta A, Pontisso P. Parenchymal transforming growth factor beta-1: its type II receptor and Smad signaling pathway correlate with inflammation and fibrosis in chronic liver disease of viral etiology. J Gastroenterol Hepatol. 2003;18:1302-1308. [PubMed] |
| 10. | Dennler S, Goumans MJ, Ten Dijke P. Transforming growth factor b signal transduction. J Leuk Biol. 2002;71:731-740. |
| 11. | Varga J. Scleroderma and Smads: dysfunctional Smad family dynamics culminating in fibrosis. Arthritis Rheum. 2002;46:1703-1713. [PubMed] |
| 12. | Heldin CH, Miyazono K, ten Dijke P. TGF-beta signalling from cell membrane to nucleus through SMAD proteins. Nature. 1997;390:465-471. [PubMed] |
| 13. | Wrana JL, Attisano L, Wieser R, Ventura F, Massague J. Mechanism of activation of the TGF-beta receptor. Nature. 1994;370:341-347. [PubMed] |
| 14. | Uyama N, Shimahara Y, Okuyama H, Kawada N, Kamo S, Ikeda K, Yamaoka Y. Carbenoxolone inhibits DNA synthesis and collagen gene expression in rat hepatic stellate cells in culture. J Hepatol. 2003;39:749-755. [PubMed] |
| 15. | Vindevoghel L, Lechleider RJ, Kon A, de Caestecker MP, Uitto J, Roberts AB, Mauviel A. SMAD3/4-dependent transcriptional activation of the human type VII collagen gene (COL7A1) promoter by transforming growth factor beta. Proc Natl Acad Sci U S A. 1998;95:14769-14774. [PubMed] |
| 16. | Dennler S, Itoh S, Vivien D, ten Dijke P, Huet S, Gauthier JM. Direct binding of Smad3 and Smad4 to critical TGF beta-inducible elements in the promoter of human plasminogen activator inhibitor-type 1 gene. EMBO J. 1998;17:3091-3100. [PubMed] |
| 17. | Poncelet AC, Schnaper HW. Sp1 and Smad proteins cooperate to mediate transforming growth factor-beta 1-induced alpha 2(I) collagen expression in human glomerular mesangial cells. J Biol Chem. 2001;276:6983-6992. [PubMed] |
| 18. | Zhang W, Ou J, Inagaki Y, Greenwel P, Ramirez F. Synergistic cooperation between Sp1 and Smad3/Smad4 mediates transforming growth factor beta1 stimulation of alpha 2(I)-collagen (COL1A2) transcription. J Biol Chem. 2000;275:39237-39245. [PubMed] |
| 19. | Chen SJ, Yuan W, Lo S, Trojanowska M, Varga J. Interaction of smad3 with a proximal smad-binding element of the human alpha2(I) procollagen gene promoter required for transcriptional activation by TGF-beta. J Cell Physiol. 2000;183:381-392. [PubMed] |
| 20. | Inagaki Y, Truter S, Ramirez F. Transforming growth factor-beta stimulates alpha 2(I) collagen gene expression through a cis-acting element that contains an Sp1-binding site. J Biol Chem. 1994;269:14828-14834. [PubMed] |
| 21. | Kavsak P, Rasmussen RK, Causing CG, Bonni S, Zhu H, Thomsen GH, Wrana JL. Smad7 binds to Smurf2 to form an E3 ubiquitin ligase that targets the TGF beta receptor for degradation. Mol Cell. 2000;6:1365-1375. [PubMed] |
| 22. | Tajima Y, Goto K, Yoshida M, Shinomiya K, Sekimoto T, Yoneda Y, Miyazono K, Imamura T. Chromosomal region maintenance 1 (CRM1)-dependent nuclear export of Smad ubiquitin regulatory factor 1 (Smurf1) is essential for negative regulation of transforming growth factor-beta signaling by Smad7. J Biol Chem. 2003;278:10716-10721. [PubMed] |
| 23. | Ebisawa T, Fukuchi M, Murakami G, Chiba T, Tanaka K, Imamura T, Miyazono K. Smurf1 interacts with transforming growth factor-beta type I receptor through Smad7 and induces receptor degradation. J Biol Chem. 2001;276:12477-12480. [PubMed] |
| 24. | 王 连升, 陈 颖伟, 张 建华, 李 定国, 陆 汉明. RGD-M6P对原代肝星状细胞的影响. 上海第二医科大学学报. 2005;25:112-115. |