修回日期: 2007-08-08
接受日期: 2007-08-28
在线出版日期: 2007-08-18
目的: 探讨胃癌组织中微淋巴管的生成特点及与临床病理特征之间的关系.
方法: 对胃癌56例及相应正常胃组织12例进行双重免疫组织化学染色, 采用微淋巴管特异标记物Podoplanin标记微淋巴管, 同时采用Ki-67来检测微淋巴管内皮细胞的增殖活性, 并观察微淋巴管分布特点, 分析其与临床病理特征之间的关系.
结果: 胃癌组织中存在微淋巴管, 但分布不一致. 癌内微淋巴管数目少, 并且多呈闭锁条索状, 癌周微淋巴管数目多且多扩张, 呈管腔样, 有时可在其中发现癌栓. 胃癌癌周微淋巴管密度(11.89±3.95)与癌内微淋巴管密度(5.83±3.26)相比较, 差别有显著统计学意义(P<0.01), 与相应正常组织微淋巴管密度(6.93±1.32)相比较, 差别亦有统计学意义(P<0.05). 胃癌癌周微淋巴管内皮细胞Ki-67指数(0.04±0.02)分别与癌内微淋巴管内皮细胞Ki-67指数(0)及相应正常胃组织微淋巴管内皮细胞Ki-67指数(0)相比较, 差别均有统计学意义(P<0.05). 胃癌癌周微淋巴管密度与肿瘤的分化程度、淋巴结转移以及淋巴管受累相关(P<0.05). 胃癌癌周微淋巴管内皮细胞Ki-67指数仅与淋巴管受累相关(P<0.05).
结论: 胃癌组织中存在新生淋巴管, 且主要存在于癌周, 癌周淋巴管是发生淋巴结转移的主要途径.
引文著录: 项锋钢, 徐静, 于文娟. 胃癌组织中微淋巴管的生成特点及临床病理意义. 世界华人消化杂志 2007; 15(23): 2491-2495
Revised: August 8, 2007
Accepted: August 28, 2007
Published online: August 18, 2007
AIM: To investigate the distribution patterns and proliferative activity of lymphatic vessels in gastric cancer and their relationship with lymphatic metastasis and clinicopathological features.
METHODS: Lymphatic microvessel density (LMVD) in tumorous areas of 56 cases of gastric cancer and non-tumorous areas of 12 corresponding normal tissues were immunohistochemically evaluated using a monoclonal antibody for podoplanin. Ki-67 protein expression of the lymphatic lining cells was simultaneously detected by double-labeling immunohistochemistry. The distribution patterns and the relationship between LMVD and clinicopathological features were analyzed.
RESULTS: Intratumoral lymphatic vessels, which were not often seen, had ill-defined lumina, while peritumoral lymphatic vessels had large and open lumina. LMVD at peritumoral regions were significantly more prevalent than at intratumoral areas and normal gastric submucosa (11.89 ± 3.95 vs 5.83 ± 3.26, 6.93 ± 1.32, P < 0.01, P < 0.05). The Ki-67 labeling index of the lymphatic lining cells at peritumoral regions was significantly higher than that in normal gastric submucosa and intratumoral regions (0.04 ± 0.02 vs 0, 0, both P < 0.05). LMVD protein expression significantly correlated with the differentiation of gastric cancer, lymphatic involvement by tumor cells, and lymph nodes metastasis (P < 0.05). The peritumoral Ki-67 labeling index of lymphatic lining cells was only significantly correlated with lymphatic involvement of tumor cells (P < 0.05).
CONCLUSION: Newly formed lymphatic vessels are found in gastric cancer, especially in peritumoral regions. Peritumoral lymphatic microvessels are the main route for lymphatic metastasis.
- Citation: Xiang FG, Xu J, Yu WJ. Clinicopathological significance of lymphangiogenesis in gastric cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(23): 2491-2495
- URL: https://www.wjgnet.com/1009-3079/full/v15/i23/2491.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i23.2491
淋巴道转移是胃癌最常见和最重要的转移途径, 也是影响患者生存的重要因素之一. 然而长期以来, 由于缺乏淋巴管特异性标记物, 对肿瘤淋巴管生成、分布及其与肿瘤转移播散之间关系的研究一直较为薄弱. 肿瘤内新生淋巴管存在与否, 以及肿瘤细胞是通过原有淋巴管还是新生淋巴管进行转移等问题一直存在争议. 胃癌局部淋巴结转移十分常见, 但其淋巴管的生成、分布及与淋巴道转移之间的关系目前仍不清楚. 为此, 我们采用新近发现的淋巴管特异性标记物Podoplanin来标记胃癌组织的微淋巴管, 同时用检测细胞增殖状态的抗体Ki-67来显示微淋巴管内皮细胞的增殖状态, 即通过免疫组织化学双重标记法, 对56例胃癌及12例相应正常胃组织同时显示微淋巴管及处于增殖状态的微淋巴管内皮细胞, 从而探讨胃癌微淋巴管的生成特点以及与相关临床病理特征之间的关系.
选取青岛大学医学院附属医院病理科2005-01/12手术切除的胃癌存档蜡块56例及相应正常胃组织蜡块12例, 其中每1例胃癌蜡块均包含取自于癌中央区(即癌内)及癌组织和周围正常组织交界区(即癌周)的组织. 术前未接受过化放疗. 其中, 男31例, 女25例, 平均年龄58(42-75)岁, >58岁21例, <58岁35例; 高分化腺癌8例, 中分化腺癌20例, 低分化腺癌28例; 采用1987年国际抗癌联盟(UICC)PTNM分期标准, Ⅰ期+Ⅱ期为35例, Ⅲ期+Ⅳ期21例; 根据肿瘤浸润深度, 侵犯至黏膜及黏膜下层6例, 侵犯至肌层者18例, 侵犯至浆膜及浆膜外32例; 根据病情进展情况, 早期胃癌6例, 中晚期胃癌50例; 伴有淋巴结转移27例, 淋巴结无转移29例; 淋巴管受累35例; 肿瘤直径≥4 cm 24例, <4 cm 32例. 所有蜡块均行连续石蜡切片, 厚度为4 µm, 1张行HE染色, 由2名病理医师复核诊断, 余者行免疫组织化学双重染色.
采用免疫组织化学双重染色. 一抗分别为淋巴管内皮细胞特异性标记物Podoplanin和检测细胞增殖状态的抗体Ki-67, 分别购自Angiobio公司和北京中杉试剂公司. Histastaintm-DS双染试剂盒购自Zymed公司. 染色步骤如下: 切片脱蜡, 梯度酒精水化, 使用H2O2灭活内源性过氧化物酶, 微波修复抗原, 血清封闭, 加一抗(Podoplanin, 工作浓度为1:200), 加生物素化二抗, 加辣根过氧化物酶标记链霉卵白素, DAB显色, 显微镜下监控, 蒸馏水终止反应. 加双染增强剂, 再次微波修复抗原, 血清封闭, 加第2种一抗(Ki-67, 工作浓度为1:100), 加生物素化二抗, 加辣根过氧化物酶标记链霉卵白素, AEC显色, 显微镜下监控, 自来水终止反应, 苏木素复染, 使用水溶性封片剂封片. 以结肠癌切片作为阳性对照, 以PBS代替一抗作为阴性对照. Podoplanin染色阳性表达于微淋巴管, 以阳性着色的单个内皮细胞或内皮细胞簇计为1个阳性微淋巴管. 参照Weidner[1]报道方法进行微淋巴管密度(LMVD)计数. 在低倍镜下先选取胃癌癌周、癌内以及相应正常胃组织阳性染色微淋巴管最密集区即"热点"(hot spot), 然后在200倍视野下计数LMVD, 每例计数3个视野, 并求均值. 微淋巴管被染为棕黄色, 而具有增殖活性的微淋巴管内皮细胞核及胃癌细胞核呈鲜红色. 参考Wulff et al[2]报道的方法, 计数微淋巴管内皮细胞Ki-67指数.
统计学处理 所有实验数据均用mean±SD表示, 经过SPSS10.0统计软件分析处理, 统计方法采用方差齐性检验, 两样本均数t检验, 配对t检验, 单因素方差分析, q检验. 以P<0.05为差异有统计学意义, P<0.01为差异有高度统计学意义.
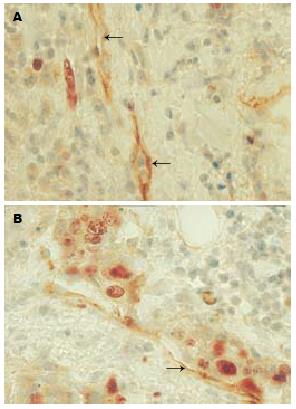
正常胃组织Podoplanin阳性染色微淋巴管在黏膜固有层、黏膜下层、肌层及浆膜层均可见到, 在黏膜下层数目最多, 且多呈扩张状, 壁薄, 形态大小不一. 其LMVD为6.93±1.32. 胃癌组织中也可见到明确的Podoplanin阳性染色微淋巴管, 微淋巴管内未见红细胞, 少数微淋巴管内可见淋巴细胞(图1A). 有淋巴结转移的胃癌中可在微淋巴管内发现癌栓, 甚至在部分淋巴结无转移的胃癌微淋巴管内也发现癌栓(图1B). 在胃癌组织中, 癌周及癌内均有微淋巴管分布, 但其形态及分布有明显的异质性, 表现为: (1)分布的差异. 癌周微淋巴管数目多, 其LMVD为11.89±3.95, 而癌内微淋巴管数目少, 其LMVD为5.83±3.26, 两者差异具有极显著统计学意义(P<0.01); (2)形态的差异: 癌周微淋巴管多扩张, 而癌内微淋巴管多为闭锁的条索状, 或呈狭长的裂隙状. 癌周、癌内LMVD与正常胃组织中相比, 差别分别具有和不具有显著性(P<0.05, P>0.05, 表1).
Podoplanin和Ki-67双标染色显示, 胃癌淋巴管内皮细胞核呈不同程度的Ki-67表达, 而相应正常组织淋巴管内皮细胞无Ki-67表达. 56例胃癌癌周及癌内淋巴管内皮细胞Ki-67指数有极显著性差异(P<0.01), 癌周与正常组织淋巴管内皮细胞Ki-67指数亦有极显著性差异(P<0.01, 表1).
胃癌癌周LMVD与肿瘤的分化程度、淋巴结转移及淋巴管受累有关. 不同分化程度腺癌的癌周LMVD差别具有显著性, 高、中、低分化腺癌之间两两比较差别均有统计学意义(P<0.05). 有淋巴结转移组癌周LMVD明显高于淋巴结无转移组癌周LMVD (P<0.01). 淋巴管受累者(即淋巴管内出现癌栓或癌细胞团)癌周LMVD也显著高于淋巴管未受累者(P<0.01). 胃癌癌周LMVD与患者的年龄、性别、肿瘤的大小、浸润深度、临床分期及病情进展情况均无关(均P>0.05). 胃癌癌周微淋巴管内皮细胞Ki-67指数仅与淋巴管受累有关, 在淋巴管受累组Ki-67指数明显高于未受累组(P<0.01), 而与患者的年龄、性别、肿瘤的大小、分化程度, 临床分期、肿瘤浸润深度及淋巴结转移均无关(均P>0.05, 表2).
| n | LMVD | 内皮细胞Ki-67指数 | |
| 年龄 | |||
| >58岁 | 21 | 10.90±3.98 | 0.04±0.02 |
| <58岁 | 35 | 12.47±3.99 | 0.04±0.03 |
| 性别 | |||
| 男 | 31 | 12.24±4.75 | 0.04±0.03 |
| 女 | 25 | 11.42±2.74 | 0.04±0.01 |
| 分化程度 | |||
| 高 | 8 | 6.5±0.71 | 0.02±0.01 |
| 中 | 20 | 10.81±1.96a | 0.03±0.01 |
| 低 | 28 | 13.73±4.18 | 0.05±0.03 |
| PTNM分期 | |||
| Ⅰ+Ⅱ | 35 | 11.37±3.15 | 0.04±0.03 |
| Ⅲ+Ⅳ | 21 | 12.79±5.21 | 0.04±0.01 |
| 浸润深度 | |||
| 黏膜及黏膜下 | 6 | 7.84±2.6 | 0.02±0.01 |
| 肌层 | 18 | 11.33±2.48 | 0.03±0.02 |
| 浆膜及浆膜外 | 32 | 12.94±4.43 | 0.05±0.03 |
| 进展 | |||
| 早期胃癌 | 6 | 7.84±2.6 | 0.02±0.01 |
| 中晚期胃癌 | 50 | 10.43±3.85 | 0.03±0.02 |
| 淋巴结转移 | |||
| 有 | 27 | 12.83±4.53b | 0.04±0.01 |
| 无 | 29 | 8.05±3.37 | 0.04±0.03 |
| 淋巴管受累 | |||
| 有 | 35 | 15.46±5.13b | 0.06±0.04b |
| 无 | 21 | 10.94±3.14 | 0.03±0.02 |
| 肿瘤直径 | |||
| ≥4 cm | 24 | 12.56±2.66 | 0.05±0.03 |
| <4 cm | 32 | 11.59±4.49 | 0.04±0.02 |
近年, 随着血管内皮生长因子C和D(VEGF-C和-D)的克隆成功及淋巴管内皮细胞特异性标记物(如Podoplanin, LYVE-1)的相继发现, 为肿瘤淋巴管生成研究提供了较为可靠的手段[3-5], 淋巴管生成与肿瘤关系的研究报道也随之增多. 但是"肿瘤内是否存在淋巴管? 即使存在, 这些淋巴管究竟是残留还是新生?"等问题一直存在争议[6-8]. 由于Podoplanin是目前最为理想的淋巴管标志物[9-11], 仅标记小的、由单层内皮衬托的微淋巴管[12-13], 阳性表达主要在淋巴管内皮细胞的腔面[14]. 因此, 我们应用免疫组化双标法在胃癌中进行了相关探讨.
许多研究提示多种恶性肿瘤组织中具有新生淋巴管[15-17]. 我们的结果显示胃癌组织内也具有新生淋巴管, 且微淋巴管在分布及形态上均具有异质性. 其中癌周微淋巴管最丰富并且多扩张, 而癌内微淋巴管较稀疏, 且多呈闭锁状或呈狭长裂隙状. 进一步检测这些微淋巴管内皮细胞核的增殖活性, 发现胃癌组织中癌周微淋巴管内皮细胞Ki-67表达较癌内显著增强, 较正常胃组织亦显著增强. 胃癌癌周微淋巴管内皮细胞Ki-67表达增强支持胃癌中存在新生淋巴管, 且以癌周区生成为显著.
"癌是通过原有的淋巴管还是通过新生的淋巴管进行转移?"尚存争议[18-19]. 肿瘤淋巴管生成是指在肿瘤原位形成新的毛细淋巴管[20-21]. 由于肿瘤新生淋巴管结构特殊[22-23], 使得肿瘤细胞便于进入淋巴管道形成转移. 这主要与分布在肿瘤组织周边的功能性淋巴管有关[24-25]. 我们的研究结果表明在胃癌癌内新生的淋巴管较稀疏, 而在癌周存在新生淋巴管, 并且其数量及其内皮细胞增殖活性均与淋巴管受累有关, 这说明癌细胞易于侵入癌周新生的淋巴管形成癌栓, 从而为其转移打下基础. 结果亦显示微淋巴管数目与淋巴结转移有关,而淋巴管内皮细胞Ki-67指数与淋巴结转移无关, 但与淋巴管受累有关, 这是由于肿瘤新生淋巴管虽然是淋巴道转移所必需的条件之一, 但是仅有淋巴管生成尚不足以导致淋巴结转移, He et al[26]发现高表达VEGF-C的人肺癌N15细胞可诱导癌周淋巴管生成, 但并不增加局部淋巴结转移. 另外一个原因可能是即使淋巴结已有肿瘤转移, 但常规病理HE切片并未发现所导致, 尤其是当淋巴结发生微转移时[27].
有研究发现LMVD的水平增高与多种肿瘤细胞的分化程度、PTNM分期及淋巴结转移有关[28-30]. 我们的结果显示胃癌癌周微淋巴管密度与肿瘤的分化程度、淋巴结转移及淋巴管受累相关. 肿瘤的分化程度越低, 其癌周微淋巴管密度越高. 提示分化程度越低的肿瘤细胞可以产生越多的促淋巴管生成因子, 从而导致癌周微淋巴管密度升高. 癌周微淋巴管越丰富, 与肿瘤细胞接触的机会就越多, 形成淋巴管道转移的机会就越多一些[31]. 通过本次研究, 我们认为胃癌存在新生淋巴管, 且多分布于癌周, 并且他是促进胃癌发生淋巴道转移的主要通道; 胃癌癌周微淋巴管密度这一指标对评价胃癌的分化程度、淋巴结转移及淋巴管受累是一有价值的指标. 随着研究微淋巴管生成的新技术、新方法的出现[32-33], 相信人们可以在将来针对性地抑制胃癌癌周微淋巴管的产生, 从而减少胃癌淋巴结转移的机率.
肿瘤淋巴管生成 (微淋巴管) 与恶性肿瘤的转移关系密切, 并成为肿瘤研究的热点. 随着淋巴管内皮细胞特异性标记物Podoplanin的发现和应用, 为肿瘤淋巴管生成的研究提供了较为可靠的手段. 然而, 胃癌中淋巴管生成的特点和作用却 鲜有报道.
Jia et al对结直肠癌淋巴管生成与淋巴结转移的关系进行了探讨; 牟江洪 et al采用免疫组织化学双重标记法系统探讨了结直肠癌淋巴管生成的特点及意义; Van et al对乳腺癌中淋巴管生成的意义进行探讨; Nakamura et al的研究揭示出胃癌中淋巴管的重要作用, 他是胃癌的预后指标和早期胃癌发生淋巴结转移的预测指标.
本文采用免疫组织化学双重标记染色法, 应用Podoplanin标记微淋巴管, 用 Ki-67检测微淋巴管内皮细胞的增殖活性, 对胃癌不同区域淋巴管生成的形态、数量及增殖状态进行系统研究, 并主要探讨与胃癌淋巴管受累及淋巴结转移的关系, 以期揭示出不同部位、不同状态的淋巴管在转移中的不同作用, 丰富了肿瘤淋巴管研究理论体系并对临床抗淋巴管生成治疗肿瘤、改善患者预后具有指导意义.
本文采用免疫组织化学双重标记染色法, 应用Podoplanin标记微淋巴管, 用 Ki-67检测微淋巴管内皮细胞的增殖活性, 对胃癌不同区域淋巴管生成的形态、数量及增殖状态进行系统研究, 并主要探讨与胃癌淋巴管受累及淋巴结转移的关系, 以期揭示出不同部位、不同状态的淋巴管在转移中的不同作用, 丰富了肿瘤淋巴管研究理论体系并对临床抗淋巴管生成治疗肿瘤、改善患者预后具有指导意义.
本文探讨了胃癌中微淋巴管的生成特点及与临床病理特征之间的关系, 立题有一定的创新性, 论文数据较可靠, 结果较可信, 有一定的理论意义和临床指导价值.
编辑: 何燕 电编:何基才
| 1. | Weidner N. Tumor angiogenesis: review of current applications in tumor prognostication. Semin Diagn Pathol. 1993;10:302-313. [PubMed] |
| 2. | Wulff C, Dickson SE, Duncan WC, Fraser HM. Angiogenesis in the human corpus luteum: simulated early pregnancy by HCG treatment is associated with both angiogenesis and vessel stabilization. Hum Reprod. 2001;16:2515-2524. [PubMed] |
| 4. | Mohammed RA, Green A, El-Shikh S, Paish EC, Ellis IO, Martin SG. Prognostic significance of vascular endothelial cell growth factors -A, -C and -D in breast cancer and their relationship with angio- and lymphangiogenesis. Br J Cancer. 2007;96:1092-1100. [PubMed] |
| 5. | Cardones AR, Leitner WW, Fang L, Murakami T, Kapoor V, Udey MC, Hwang ST. Genetic immunization with LYVE-1 cDNA yields function-blocking antibodies against native protein. Microvasc Res. 2006;71:32-39. [PubMed] |
| 6. | Renyi-Vamos F, Tovari J, Fillinger J, Timar J, Paku S, Kenessey I, Ostoros G, Agocs L, Soltesz I, Dome B. Lymphangiogenesis correlates with lymph node metastasis, prognosis, and angiogenic phenotype in human non-small cell lung cancer. Clin Cancer Res. 2005;11:7344-7353. [PubMed] |
| 7. | Agarwal B, Saxena R, Morimiya A, Mehrotra S, Badve S. Lymphangiogenesis does not occur in breast cancer. Am J Surg Pathol. 2005;29:1449-1455. [PubMed] |
| 10. | Cimpean AM, Raica M, Izvernariu DA, Tatucu D. Lymphatic vessels identified with podoplanin. Comparison of immunostaining with three different detection systems. Rom J Morphol Embryol. 2007;48:139-143. [PubMed] |
| 11. | Chilosi M, Doglioni C, Dei Tos AP. New diagnostic markers: podoplanin-d2-40. Pathologica. 2005;97:158-159. [PubMed] |
| 12. | Omachi T, Kawai Y, Mizuno R, Nomiyama T, Miyagawa S, Ohhashi T, Nakayama J. Immunohistochemical demonstration of proliferating lymphatic vessels in colorectal carcinoma and its clinicopathological significance. Cancer Lett. 2007;246:167-172. [PubMed] |
| 13. | Nisato RE, Harrison JA, Buser R, Orci L, Rinsch C, Montesano R, Dupraz P, Pepper MS. Generation and characterization of telomerase-transfected human lymphatic endothelial cells with an extended life span. Am J Pathol. 2004;165:11-24. [PubMed] |
| 14. | Reis-Filho JS, Schmitt FC. Lymphangiogenesis in tumors: what do we know? Microsc Res Tech. 2003;60:171-180. [PubMed] |
| 15. | Beasley NJ, Prevo R, Banerji S, Leek RD, Moore J, van Trappen P, Cox G, Harris AL, Jackson DG. Intratumoral lymphangiogenesis and lymph node metastasis in head and neck cancer. Cancer Res. 2002;62:1315-1320. [PubMed] |
| 16. | Shields JD, Borsetti M, Rigby H, Harper SJ, Mortimer PS, Levick JR, Orlando A, Bates DO. Lymphatic density and metastatic spread in human malignant melanoma. Br J Cancer. 2004;90:693-700. [PubMed] |
| 18. | Nakamura Y, Yasuoka H, Tsujimoto M, Kurozumi K, Nakahara M, Nakao K, Kakudo K. Importance of lymph vessels in gastric cancer: a prognostic indicator in general and a predictor for lymph node metastasis in early stage cancer. J Clin Pathol. 2006;59:77-82. [PubMed] |
| 19. | Hinojar-Gutierrez A, Fernandez-Contreras ME, Gonzalez-Gonzalez R, Fernandez-Luque MJ, Hinojar-Arzadun A, Quintanilla M, Gamallo C. Intratumoral lymphatic vessels and VEGF-C expression are predictive factors of lymph node relapse in T1-T4 N0 laryngopharyngeal squamous cell carcinoma. Ann Surg Oncol. 2007;14:248-257. [PubMed] |
| 21. | Van der Auwera I, Colpaert C, Van Marck E, Vermeulen P, Dirix L. Lymphangiogenesis in breast cancer. Am J Surg Pathol. 2006;30:1055-1056; author reply 1056-1057. [PubMed] |
| 22. | Ji RC. Lymphatic endothelial cells, tumor lymphangiogenesis and metastasis: New insights into intratumoral and peritumoral lymphatics. Cancer Metastasis Rev. 2006;25:677-694. [PubMed] |
| 23. | Blacker HA, Tsopelas C, Orgeig S, Daniels CB, Chatterton BE. How regenerating lymphatics function: lessons from lizard tails. Anat Rec (Hoboken). 2007;290:108-114. [PubMed] |
| 24. | Padera TP, Kadambi A, di Tomaso E, Carreira CM, Brown EB, Boucher Y, Choi NC, Mathisen D, Wain J, Mark EJ. Lymphatic metastasis in the absence of functional intratumor lymphatics. Science. 2002;296:1883-1886. [PubMed] |
| 25. | Padera TP, Boucher Y, Jain RK. Correspondence re: S. Maula et al., intratumoral lymphatics are essential for the metastatic spread and prognosis in squamous cell carcinoma of the head and neck. Cancer Res., 63: 1920-1926, 2003. Cancer Res. 2003;63:8555-8556; author reply 8558. [PubMed] |
| 26. | He Y, Kozaki K, Karpanen T, Koshikawa K, Yla-Herttuala S, Takahashi T, Alitalo K. Suppression of tumor lymphangiogenesis and lymph node metastasis by blocking vascular endothelial growth factor receptor 3 signaling. J Natl Cancer Inst. 2002;94:819-825. [PubMed] |
| 27. | Matsumoto M, Natsugoe S, Okumura H, Arima H, Yanagita S, Uchikado Y, Yokomakura N, Setoyama T, Ishigami S, Takao S. Overexpression of vascular endothelial growth factor-C correlates with lymph node micrometastasis in submucosal esophageal cancer. J Gastrointest Surg. 2006;10:1016-1022. [PubMed] |
| 28. | Schoppmann SF, Birner P, Studer P, Breiteneder-Geleff S. Lymphatic microvessel density and lymphovascular invasion assessed by anti-podoplanin immunostaining in human breast cancer. Anticancer Res. 2001;21:2351-2355. [PubMed] |
| 31. | Jia YT, Li ZX, He YT, Liang W, Yang HC, Ma HJ. Expression of vascular endothelial growth factor-C and the relationship between lymphangiogenesis and lymphatic metastasis in colorectal cancer. World J Gastroenterol. 2004;10:3261-3263. [PubMed] |
| 33. | Kowanetz M, Ferrara N. Vascular endothelial growth factor signaling pathways: therapeutic perspective. Clin Cancer Res. 2006;12:5018-5022. [PubMed] |