修回日期: 2007-07-28
接受日期: 2007-07-28
在线出版日期: 2007-08-18
目的: 探讨三叶因子2(TFF2)在幽门螺杆菌(H. pylori)感染胃体腺黏膜中表达的意义.
方法: 选择有H. pylori感染的胃手术切除标本29例(92个蜡块), 其中胃及十二指肠溃疡5例,胃癌24例, 用免疫组织化学方法检测TFF2的分布和表达.
结果: 在H. pylori感染胃黏膜中, TFF2主要在胃体腺的颈黏液细胞和假幽门腺化生细胞中表达; 在正常黏膜中TFF2主要分布在胃固有腺的上1/3-2/3; 在轻度萎缩黏膜中, 腺底部仅见少量阳性细胞, 随着萎缩程度的加重, 在腺底部出现的阳性细胞增多; 在轻、中度萎缩黏膜中其强阳性率分别为18.0%和42.9%, 而在重度萎缩中达90.5%. 在轻、中度和重度萎缩之间有显著性差异(P<0.01).
结论: H. pylori感染增加在腺底部的TFF2表达, 并与黏膜的萎缩程度有关.
引文著录: 金仁顺, 方贞花, 朴东明. TFF2在幽门螺杆菌感染胃体部黏膜中的表达. 世界华人消化杂志 2007; 15(23): 2487-2490
Revised: July 28, 2007
Accepted: July 28, 2007
Published online: August 18, 2007
AIM: To investigate the protein expression of the trefoil factor family 2 (TFF2) in fundic glands with Helicobacter pylori infection.
METHODS: Protein expression of TFF2 was detected by immunohistochemistry in paraffin-embedded samples from 29 (92 blocks) surgical specimens from five patients gastric ulcer and 24 with gastric carcinoma.
RESULTS: Expression of TFF2 was found in mucous neck cells and cells with pseudopylori gland metaplasia. Positive cells were distributed above the 1/2 to 2/3 portions of fundic glands in normal gastric mucosa. The ratio of TFF2-positive cells in the basal portion of the fundic glands was 18.0, 42.9 and 90.5% in mild, moderate and severe glandular atrophy, respectively, and these differences were significant (P < 0.01).
CONCLUSION: H. pylori infection increases the expression of TFF2 in deeper parts of the fundic gland, and is also associated with the degree of glandular atrophy. The expression of TFF2 is related to mucosal protection and repair processes.
- Citation: Jin RS, Fang ZH, Piao DM. Expression of trefoil factor family 2 in fundic glands with Helicobacter pylori infection. Shijie Huaren Xiaohua Zazhi 2007; 15(23): 2487-2490
- URL: https://www.wjgnet.com/1009-3079/full/v15/i23/2487.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i23.2487
H. pylori感染性慢性胃炎伴有的化生性病变除了肠上皮化生以外还有胃体腺区的颈黏液细胞增生(mucous neck cell, MNC)和假幽门腺化生(pseudopylori gland metaplasia, PPGM), 但目前为止没有得到足够的重视. Takizawa et al[1]曾报道过慢性萎缩性胃炎除了肠上皮化生为主型胃炎外, 还有假幽门腺化生为主型的胃炎的存在. 我们利用全切胃标本研究了H. pylori与化生性病变分布, 结果发现了肠上皮化生轻度而颈黏液细胞增生和假幽门腺化生为主的病例[2-3], 认为H. pylori感染性胃炎中黏液细胞的增生和假幽门腺化生同肠上皮化生一样重要.
研究表明, 当在胃体腺黏膜部位诱发溃疡或糜烂时, 出现假幽门腺化生细胞, 认为与黏膜的修复有关. 另外, 胃体腺的固有腺细胞有缺损时颈黏液细胞反应性增多, 转变成假幽门腺化生细胞, 说明颈黏液细胞不仅是由干细胞转化成主细胞的中间型移行细胞, 而且他的增殖与假幽门腺化生细胞与损伤黏膜的修复机制有关. 近年的研究发现颈黏液细胞分泌黏液成分的同时分泌三叶因子[4], 在正常胃黏膜中, TFF2在贲门腺和幽门腺以及颈黏液细胞中有表达[5-6]. 颈黏液细胞的增生和假幽腺化生以及TFF2的表达可能在H. pylori感染胃炎中起到很重要的作用, 因此, 我们探讨了TFF2在H. pylori感染胃炎中的表达以及与颈黏液细胞和假幽门腺化生细胞的相关性.
外科手术切除的胃标本按常规方法取材做蜡块, 在HE染色上观察有无幽门H. pylori感染, 然后选择标本保存及固定好、有幽门螺杆H. pylori感染的标本29例, 其中, 胃十二指肠溃疡5例, 早期胃癌14例, 进展期胃癌10例. 男15例, 女14例, 年龄38-79(平均57.3)岁. 在每个病例的胃体部取4-5块组织, 按常规方法40 g/L甲醛中固定48-72 h后制作蜡块, 共92块, 做连续切片, 行苏木素-伊红常规染色和TFF2免疫组织化学染色.
脱蜡至水后, 330 mL/L H2O2室温孵育10 min, 灭活内源性过氧化物酶, 蒸馏水冲洗3次, 用苦味酸缓冲液Autoclave(高压锅)120℃、3 min进行抗原修复, 冷却至室温, PBS冲洗3-5次, 滴加正常血清封闭液10 min, 倾去血清, 滴加TFF2抗体(clone: GE16c, 稀释倍数1:25, Novocastra Laboratories Newcastle, UK), 室温2 h, PBS冲洗3-5次, 滴加二抗1 h, PBS冲洗3-5次, DAB显色, 苏木素复染, 脱水、透明、封片后显微镜下观察. 萎黏膜的萎缩程度根据Updated Sydney System[7]标准来判断轻度, 中度和重度. TFF2的表达: 在细胞质内出现棕黄色颗粒为阳性, 在固有腺底部出现的TFF2阳性细胞≤10%定为+(阳性), >10%为++(强阳性).
统计学处理 采用Scheffe's F方法, P<0.01为有差异.
胃黏膜29例均见中性粒细胞及淋巴-浆细胞浸润, 呈慢性活动性胃炎的表现, 并可见黏膜的萎缩, 而每个病例的萎缩程度不同, 胃癌的病例较胃十二指肠溃疡病例萎缩程度重. 在萎缩的胃黏膜中见不同程度的颈黏液细胞的增生和假幽门腺化生. 在胃黏膜的黏液层或在胃黏膜的表层上皮中均能观察到H. pylori感染.
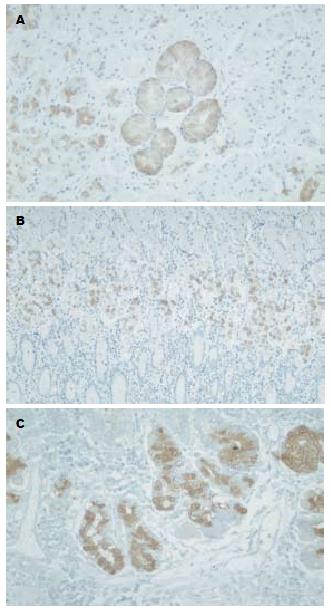
在正常胃黏膜, TFF2主要在幽门腺和贲门腺及腺颈部的部分颈黏液细胞中表达, 表面上皮和胃固有腺未见表达. 在本研究中TFF2在胃体腺黏膜颈部的颈黏液细胞和假幽门腺化生细胞中均有表达(图1A). 在正常黏膜中TFF2阳性细胞从腺颈部至固有腺的1/3-2/3中分布(图1B); 而在萎缩黏膜中, 腺底部可见阳性细胞, 其表达程度与黏膜的萎缩程度有关, 随着萎缩程度的加重, TFF2阳性细胞在固有腺底部出现的比例增高(图1C), 在轻度、中度和重度萎缩黏膜中其阳性率和强阳性率分别为, +: 82.0%, 57.1%和9.5%; ++: 18.0%, 42.9%和90.5%. 在轻度、中度萎缩与重度萎缩之间有显著性差异(P<0.01).
三叶因子2(Trefoitrefoil factor, TFF2)又称解痉多肽(spasmolytic polypeptide, SP), 在胃体腺黏膜中其阳性细胞主要分布在黏膜的腺颈部, 在本研究中TFF2在腺颈部的颈黏液细胞和假幽门腺化生细胞中均有表达. 在萎缩黏膜中TFF2阳性细胞不仅分布在腺颈部, 且在腺底部也有分布, 其分布与胃体腺的黏膜萎缩程度有关. 即在轻度萎缩黏膜中TFF2主要在胃黏膜颈部表达, 在腺底部仅有少量表达, 但随着黏膜萎缩程度加重, 在腺底部出现的阳性细胞增多. 提示H. pylori感染增加TFF2在固有腺底部的表达, 并TFF2阳性表达与黏膜的萎缩程度有关. Wright et al[8]在消化道再生结构机制研究中提出UACL(ulcer-associated cell lineage)概念, 消化道黏膜受损伤之后, 在黏膜的修复过程中可以观察到UACL, 而这种细胞TFF呈阳性[9-10]. 动物实验已证实对胃体腺黏膜诱发溃疡或糜烂性损伤时, 溃疡或糜烂黏膜边缘出现颈黏液细胞的增加和假幽门腺化生, 认为与黏膜的损伤修复有关. 在本研究中H. pylori感染性萎缩性胃炎黏膜中出现颈黏液细胞的增生和假幽门腺化生, 并且TFF2呈阳性表达. 根据Wright理论, 推测在H. pylori感染胃黏膜中TFF2表达阳性的细胞可能是UACL的一种, 与H. pylori感染及其引起的炎症性损伤黏膜的防御与修复有关.
Wang et al[11]在H. pylori感染C57BL/6大鼠研究中发现在H. pylori感染大鼠的胃体腺黏膜中, 出现与人类H. pylori感染性萎缩缩性胃炎相似的病变, 即壁细胞和主细胞减少的同时腺颈部的颈黏液细胞增加, 这种细胞TFF2呈阳性表达, 称之SP阳性黏膜细胞系(SP-positive mucous cell lineage), 随后Schmidt et al[12]在H. pylori感染胃体腺黏膜研究中, 观察到TFF2阳性细胞在电子显微镜下与Wang et al[11]的SP阳性黏膜细胞系相似, 把他称为解痉多肽表达性化生细胞系(SP-expressing metaplasia mucous cell lineage), 简称SPEM. 之后研究者们发现在胃癌的癌旁黏膜及异型增生黏膜中可以观察到SPEM, 考虑与胃癌的发生有关[13-17]. 在本研究中, 认为癌前期病变的萎缩性黏膜中可见TFF2的表达, 且随着胃体腺萎缩程度的加重, 在黏膜固有层及其底部的TFF2阳性细胞分布增多. 而在这些病例中胃癌黏膜的萎缩程度明显比胃十二指肠溃疡黏膜重, 从此考虑在萎缩胃体黏膜中的TFF2阳性表达可能与胃癌的发生有关.
总之, TFF2阳性表达(SPEM)与H. pylori感染胃炎的胃体腺黏膜的萎缩程度有关, 在H. pylori感染引起的胃黏膜损伤的保护和修复中起重要的作用[18-19], 这对H. pylori感染引起的消化性溃疡及胃炎等黏膜损伤性疾病的预防和治疗提供新的理论依据[20]. 另外, SPEM可能与胃癌的发生有关, 但SPEM在胃癌的发生机制中作用还不很清楚, 有待进一步研究.
H. pylori感染性慢性胃炎除了肠上皮化生以外还有胃体腺区的颈黏液细胞增生(MNC)和假幽门腺化生(PPGM),但目前为止没有得到足够的重视,在正常胃黏膜中 TFF2在贲门腺和幽门腺以及颈黏液细胞中有表达.MNC和PPGM以及TFF 2的表达可能在H. pylori感染胃炎中起很重要的作用, 因此有必要进行深入的研究.
H. pylori感染增加在腺底部的TFF2表达, 并与黏膜的萎缩程度有关, 提示TFF2的表达与H. pylori感染胃黏 膜的保护和修复有关, 另外, 还可能与胃癌的发生有关.
本文提示了TEF2 的表达与幽门螺杆菌感染胃黏膜的保护有关, 全文逻辑性较强, 结构紧凑, 论证有据, 文字通顺, 对临床应用有很大的意义
编辑: 何燕 电编:郭海丽
| 1. | Takizawa T, koike M. Chronic gastric from patho-logical changes of corpus gland mucosa. I to Cho (Stomach and intestine). 1985;20:611-624. |
| 2. | Jin RS, Ban SI, Takahama MH. Immuno-histochemical study on the relationship between the distribution of Helicobacter pylori and metaplastic lesions using whole-mucosal step sectioning of resected stomachs. J Saitama Med School. 2001;28:81-88. |
| 4. | Hanby AM, Poulsom R, Playford RJ, Wright NA. The mucous neck cell in the human gastric corpus: a distinctive, functional cell lineage. J Pathol. 1999;187:331-337. [PubMed] |
| 5. | Hanby AM, Poulsom R, Singh S, Elia G, Jeffery RE, Wright NA. Spasmolytic polypeptide is a major antral peptide: distribution of the trefoil peptides human spasmolytic polypeptide and pS2 in the stomach. Gastroenterology. 1993;105:1110-1116. [PubMed] |
| 6. | Katoh M. Trefoil factors and human gastric cancer (review). Int J Mol Med. 2003;12:3-9. [PubMed] |
| 7. | Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994. Am J Surg Pathol. 1996;20:1161-1181. [PubMed] |
| 8. | Wright NA, Pike C, Elia G. Induction of a novel epidermal growth factor-secreting cell lineage by mucosal ulceration in human gastrointestinal stem cells. Nature. 1990;343:82-85. [PubMed] |
| 9. | Pera M, Heppell J, Poulsom R, Teixeira FV, Williams J. Ulcer associated cell lineage glands expressing trefoil peptide genes are induced by chronic ulceration in ileal pouch mucosa. Gut. 2001;48:792-796. [PubMed] |
| 10. | Longman RJ, Douthwaite J, Sylvester PA, Poulsom R, Corfield AP, Thomas MG, Wright NA. Coordinated localisation of mucins and trefoil peptides in the ulcer associated cell lineage and the gastrointestinal mucosa. Gut. 2000;47:792-800. [PubMed] |
| 11. | Wang TC, Goldenring JR, Dangler C, Ito S, Mueller A, Jeon WK, Koh TJ, Fox JG. Mice lacking secretory phospholipase A2 show altered apoptosis and differentiation with Helicobacter felis infection. Gastroenterology. 1998;114:675-689. [PubMed] |
| 12. | Schmidt PH, Lee JR, Joshi V, Playford RJ, Poulsom R, Wright NA, Goldenring JR. Identification of a metaplastic cell lineage associated with human gastric adenocarcinoma. Lab Invest. 1999;79:639-646. [PubMed] |
| 13. | Yamaguchi H, Goldenring JR, Kaminishi M, Lee JR. Association of spasmolytic polypeptide-expressing metaplasia with carcinogen administration and oxyntic atrophy in rats. Lab Invest. 2002;82:1045-1052. [PubMed] |
| 14. | Oshima M, Oshima H, Matsunaga A, Taketo MM. Hyperplastic gastric tumors with spasmolytic polypeptide-expressing metaplasia caused by tumor necrosis factor-alpha-dependent inflammation in cyclooxygenase-2/microsomal prostaglandin E synthase-1 transgenic mice. Cancer Res. 2005;65:9147-9151. [PubMed] |
| 15. | Hu GY, Yu BP, Dong WG, Li MQ, Yu JP, Luo HS, Rang ZX. Expression of TFF2 and Helicobacter pylori infection in carcinogenesis of gastric mucosa. World J Gastroenterol. 2003;9:910-914. [PubMed] |
| 16. | Halldorsdottir AM, Sigurdardottrir M, Jonasson JG, Oddsdottir M, Magnusson J, Lee JR, Goldenring JR. Spasmolytic polypeptide-expressing metaplasia (SPEM) associated with gastric cancer in Iceland. Dig Dis Sci. 2003;48:431-441. [PubMed] |
| 17. | Nomura S, Baxter T, Yamaguchi H, Leys C, Varta-petian AB, Fox JG, Lee JR, Wang TC, Goldenring JR. Spasmolytic polypeptide expressing metaplasia to preneoplasia in H. felis-infected mice. Gastroen-terology. 2004;127:582-594. [PubMed] |
| 18. | Suzuki K, Hayama M, Nakamura M, Yamauchi K, Maruta F, Miyagawa S, Ota H. Trefoil factor 2 in gland mucous cell mucin in the mucous gel covering normal or damaged gastric mucosa using the Mongolian gerbil model. Scand J Gastroenterol. 2006;41:1390-1397. [PubMed] |
| 19. | Kurt-Jones EA, Cao L, Sandor F, Rogers AB, Whary MT, Nambiar PR, Cerny A, Bowen G, Yan J, Takaishi S. Trefoil family factor 2 is expressed in murine gastric and immune cells and controls both gastrointestinal inflammation and systemic immune responses. Infect Immun. 2007;75:471-480. [PubMed] |