修回日期: 2007-07-18
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 构建隐源性肝炎相关新基因CHBP2原核表达载体, 在大肠杆菌中进行表达, 并纯化CHBP2融合蛋白.
方法: 应用逆转录聚合酶链反应(RT-PCR), 以提取的Huh7细胞mRNA为模板, 扩增获得CHBP2基因片段, 连接到pGEM-T载体, 测序正确后插入至原核表达载体pET-32a(+)中, 构建原核表达载体pET-32a(+)-CHBP2, 转化大肠杆菌BL21, 以异丙基-β-D-硫代半乳糖苷(IPTG)诱导, 获得CHBP2融合蛋白的可诱导性表达, 通过SDS-PAGE电泳、Western blot免疫印迹分析证实蛋白表达的特异性. 超声破碎表达细菌, SDS-PAGE分析. 利用镍离子亲和柱对表达蛋白进行纯化及柱上复性.
结果: 成功构建原核表达载体pET-32a(+)-CHBP2, 并将CHBP2融合蛋白成功表达, 通过Western blot免疫印迹, 证实了蛋白表达的特异性. SDS-PAGE分析表明其为包涵体表达, 并对蛋白成功进行了纯化和复性, 获得了表达蛋白的纯品.
结论: 成功表达、纯化CHBP2蛋白, 为研究CHBP2蛋白的生物学功能打下了基础.
引文著录: 李锟, 叶进, 肖凡, 李国力, 洪源, 魏红山. 隐源性肝炎相关新基因CHBP2的原核表达及蛋白纯化. 世界华人消化杂志 2007; 15(22): 2394-2398
Revised: July 18, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To construct a prokaryotic cell expression vector for a new gene, CHBP2, associated with cryptogenic hepatitis, and to abundantly express and purify CHBP2 protein.
METHODS: The open reading frame (ORF) of CHBP2 was amplified by reverse transcriptase-polymerase chain reaction (RT-PCR), in which an mRNA template was extracted from Huh7 cells and ligated into the pGEM-T cloning vector. After sequencing, the correct DNA fragment was inserted into inducible Escherichia coli BL21. After the CHBP2 protein was induced with Isopropyl-beta-d-thiogalactopyranoside (IPTG), it was analyzed by SDS-PAGE and western blotting. Expressed bacteria were atomized by ultrasound and analyzed with SDS-PAGE. The expressed product was purified and renatured by Ni+ affinity column chromatography.
RESULTS: The prokaryotic cell expression vector pET-32a(+)-CHBP2 was successfully constructed and CHBP2 protein was abundantly expressed. The protein's specificity was verified by western blotting. Protein production was mainly in the inclusion body, as shown by SDS-PAGE analysis, and was purified and renatured by Ni+ affinity column chromatography. Purified protein was successfully obtained.
CONCLUSION: Expression and purification of CHBP2 protein will be useful for studying the biological functions of CHBP2.
- Citation: Li K, Ye J, Xiao F, Li GL, Hong Y, Wei HS. Expression and purification of new gene CHBP2 associated with cryptogenic hepatitis in prokaryote cells. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2394-2398
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2394
隐源性肝炎是一组异质性疾病, 又称未分类肝炎、特发性肝炎[1], 占暴发性肝炎的24%-47%[2], 急性肝炎的10%-20%[3-4], 慢性肝炎的5%[5], 其病因和发病机制隐匿, 肝组织学特征不明显. 关于隐源性肝炎病因及发病机制的研究较多, 但至今尚未有某种学说得到公认. 陈京龙 et al[6]用噬菌体表面展示技术筛选隐源性肝炎血清蛋白结合蛋白, 得到相应基因序列, 我们对其筛到的新基因进行原核表达, 并将所表达的蛋白纯化和复性, 为进一步研究蛋白功能, 探讨隐源性肝炎发病的分子生物学机制提供了条件.
肝瘤细胞系Huh7及大肠杆菌DH5α, BL21为本室保存, Taq酶, T4DNA连接酶、pGEM-T, IPTG及X-Gal购于Promega公司, 玻璃奶回收试剂盒购自博大泰克公司, 限制性核酸内切酶XhoⅠ, BamHⅠ购自TaKaRa生物公司, 质粒提取试剂盒, BCA蛋白分析试剂盒购自Sigma公司. 抗His mAb、HRP标记羊抗鼠IgG均购自北京中杉金桥生物公司, ECL化学反光试剂盒购自GE公司. AKTA purifier、His Trap-FF 5亲和层析柱为GE公司产品. 引物合成由上海生工生物技术公司完成, 测序由奥科生物公司完成.
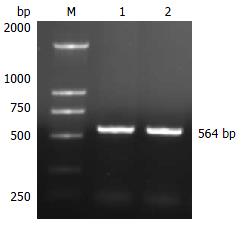
1.2.1 新基因CHBP2的PCR扩增: 陈京龙 et al[6]用噬菌体表面展示技术筛选隐源性肝炎相关基因, 挑选克隆测序, 与GenBank数据库进行初步比较, 发现一个新基因, 将该未知功能基因命名为CHBP2, 发现其开放读码框长564 bp, 编码164个氨基酸残基. 根据CHBP2的全长编码基因, 设计2条引物, 有义链引物5'-GGATCCATGAAGCATTCAAAGAAGAC-3', 引入BamHⅠ酶切位点, 反义链引物5'-CTCGAGATTTCCTCGCAGCTTT-3', 引入XhoⅠ酶切位点, 提取Huh7细胞的总RNA, 进行反转录, 以反转录产物cDNA为模板进行PCR, PCR参数如下: 95℃ 5 min预变性, 95℃ 30 s变性, 58℃ 30 s退火, 72℃ 40 s延伸, 共35个循环, 72℃延伸10 min. 获得该基因的PCR产物.
1.2.2 重组表达质粒的构建: 将PCR产物在10 g/L琼脂糖凝胶中电泳, 切取目的片段, 玻璃奶法回收PCR产物, 与pGEM-T载体连接, 转化DH5a感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37℃培养12-16 h, 挑取在培养板上生长的白色菌落提取质粒, 经酶切(BamHⅠ/XhoⅠ)及测序鉴定. BamHⅠ/XhoⅠ双酶切重组质粒pEGM-T-CHBP2, 玻璃奶纯化回收酶切产物, 定向克隆至pET-32a(+)载体, 构建成重组质粒pET-32a(+)-CHBP2, 小量提取质粒酶切鉴定.
1.2.3 重组蛋白的表达和纯化: 将鉴定为阳性的质粒转化大肠杆菌BL21, 挑取单菌落, 37℃振摇培养12 h, 37℃转摇, 至A600 = 0.6, 加入IPTG至终浓度1 mmo1/L. 同时设阴性对照, 继续37℃振摇培养2, 4 h. 对经SDS-PAGE电泳证实的表达菌株, 进行大量诱导, 超声裂解破碎, 分别收集裂解上清和沉淀. 将沉淀用包涵体洗液洗涤, 溶于8 mol/L尿素(pH8)中.
1.2.4 融合蛋白的柱上复性和纯化: 配制尿素浓度分别为0.5, 1, 2, 3 mol/L的包涵体洗液(其余成分为20 mmol/L Tris-HCl pH8.0, 5 mmol/L EDTA, 100 mmol/L NaCl, 10 g/L Triton), 探索最佳洗液条件并依此条件洗涤沉淀3次. 离心收集洗涤后包涵体. A液(8 mol/L尿素, 0.5 mol/L NaCl, 20 mmol/L PB, 20 mmol/L咪唑)充分溶解包涵体(置摇床低速转摇助溶). 离心收集上清, 经0.22 µm滤膜滤过后进行复性和纯化. 具体步骤如下: 样品上经5个柱床体积A液洗涤的亲和层析柱, 然后用B液(20 mmol/L咪唑, 0.5 mol/L NaCl, 20 mmol/L PB)逐渐按线性梯度降低尿素浓度至零进行蛋白柱上复性(共40 mL复性液, 流速为5 mL/min), 最后以20-500 mmol/L的咪唑线性梯度洗脱已经复性的融合蛋白, 分别收集洗脱峰, 得到融合蛋白纯品. 蛋白分析试剂盒测定纯化蛋白浓度, SDS-PAGE分析蛋白纯度.
1.2.5 Western blot检测: SDS-PAGE电泳后将凝胶按常规方法转膜(45 V, 1.5 h), 50 g/L脱脂奶粉封闭1 h, 抗His mAb(1:200)孵育3 h, TBST洗膜3次(10 min/次); HRP标记羊抗鼠IgG(1:2500)孵育1 h, TBST洗膜3次(10 min/次), 最后加入显色液, X光片曝光.
应用PCR技术扩增新基因CHBP2(图1), 其CDS共564 bp,将该序列上传美国国立医学图书馆(NLM)国立生物工程中心(NCBI)建立的核苷酸序列数据库(GenBank)并被收录, 编号为EF413023, 编码187个氨基酸残基, 经检索, 未发现该基因功能的相关研究.
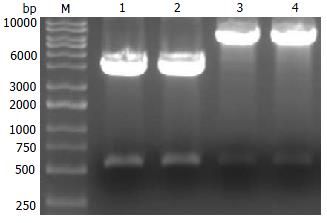
CHBP2的PCR扩增产物连接至pGEM-T载体, 经测序及酶切鉴定正确后, 插入表达载体pET-32a(+)相应的酶切位点上, BamHⅠ/XhoⅠ酶切鉴定表明原核表达载体pET-32a(+)-CHBP2构建成功(图2).
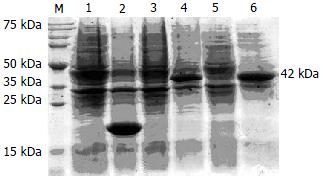
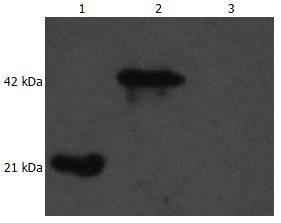
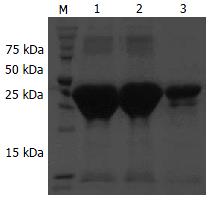
pET-32a(+)-CHBP2重组质粒转化大肠埃希菌BL21, 经1 mmol/L IPTG诱导2, 4 h后进行SDS-PAGE电泳, 发现在约42 kDa处有一特异条带, 与预测的蛋白分子量一致, 并随着时间增加蛋白表达量呈增多趋势(图3). Western blot结果表明, CHBP2蛋白特异性强且条带清晰(图4).
经IPTG 37℃诱导4 h后, 离心集菌. 超声破碎菌体, 1 mL超声产物离心分离上清及沉淀, 分别常规制样后取10 µL进行SDS-PAGE. 结果表明, 融合蛋白大量诱导表达成功, 表达物基本都存在于沉淀中, 即为包涵体形式. 蛋白沉淀电泳显示明显融合蛋白条带, 分子量约42 kDa(图5).
超声后离心分离沉淀, 不同浓度的包涵体洗液洗涤沉淀, 发现尿素浓度为0.5 mol/L时洗涤效果最好. 收集充分洗涤后的包涵体, 再用包涵体溶解液充分溶解, 上清经Ni+亲和层析柱纯化、复性. 取10 µL纯化融合蛋白进行SDS-PAGE, 软件分析显示纯化融合蛋白纯度在95%左右(图5). BCA蛋白分析试剂盒测定蛋白浓度为0.5 g/L.
隐源性肝炎的诊断, 首先需排除甲-戊型病毒性肝炎. 这也使人们有理由猜测, 应该还有新型的嗜肝病毒存在. 随着1997年TT病毒(TTV)[7]及随后SEN病毒(SENV)、TTV样微小病毒(TTV-like-mini virus, TLMV)等相关病毒的发现, 国内外关于新型肝炎病毒的研究和争论就没有停止过. TTV在献血员的感染率为1.9%-62%, 各国报道差距较大[8-14]. 有研究者发现, TTV在各种肝病患者中的检出率要高于献血员[14-15], 有的研究则从临床或病理方面证实了TTV的致病性[7,16-18]. 但近年来持相反意见的研究者占了多数, 有人认为TTV的感染率在献血员和肝病患者之间无明显差异[19-20], TTV感染与血清转氨酶的升高及肝脏组织学损伤无明显相关性[21-26], TTV与其他肝炎病毒无相互作用[27]. 其他几种新病毒的情况也类似. 另外, 有研究证实, 在乙型肝炎高流行区, 隐匿性乙型肝炎病毒感染在隐源性肝炎患者中占比例较高[28-29], 而在中低流行区所占比例则较低[30-31]. 研究者均认为, 仍有比例不等的隐源性肝炎患者病因不明, 需进一步研究.
本研究将陈京龙 et al[6]应用噬菌体表面展示技术筛选得到的隐源性肝炎相关新基因进行原核表达, 并将所表达的蛋白纯化和复性. 我们采用柱上复性法对所表达的蛋白包涵体进行复性. 首先, 带有His标签的已融于高浓度变性剂的蛋白包涵体与固定化镍离子相结合, 杂蛋白因为不带有His标签而被除去; 随后, 结合于柱上的融合蛋白在变性剂浓度降低过程中逐渐复性; 最后, 通过增加咪唑浓度或降低pH值将复性蛋白从柱上洗脱下来, 从而完成蛋白纯化和复性的双重过程. 这也为研究蛋白功能创造了条件. 发现一种新的基因, 同时把其编码的新蛋白的结构与生物学功能、与生物学和临床医学之间的相互关系、以及新基因表达调节的机制阐明, 是目前基因的分子生物学研究领域中最具挑战性的工作[32]. 有研究指出, 病毒等病原体基因组编码的蛋白与宿主肝细胞之间相互作用, 可能是病原体致病的重要分子机制[33]. 某种致病因素导致了新基因CHBP2的异常表达, 或者该基因的表达导致了隐源性肝炎的发病, 均值得进一步探讨. 我们将隐源性肝炎相关新基因CHBP2编码蛋白成功表达、纯化、复性, 为进一步研究蛋白功能, 探讨隐源性肝炎发病的分子生物学机制, 打下了坚实的基础.
隐源性肝炎是一组异质性疾病, 又称未分类肝炎、特发性肝炎, 其病因和发病机制隐匿, 肝组织学特征不明显. 目前关于隐源性肝炎病因及发病机制的研究较多, 但存在诸多争议.
本文所表达的新基因CHBP2, 经检索, 尚未有人对其进行功能研究. 某种致病因素导致了该基因的异常表达, 或者该基因导致了隐源性肝炎的发病, 均是一个新的领域, 值得探讨. 蛋白的复性是蛋白功能研究中的难点. 该研究应用镍离子亲和层析柱, 完成了蛋白纯化和复性的双重过程. 这也为研究蛋白功能创造了条件.
本研究成功表达了隐源性肝炎相关新基因, 为进一步制备该基因的多克隆抗体、单克隆抗体以及研究该基因的功能,探索隐源性肝炎的发病机制及新的治疗方案, 打下坚实的基础.
本文从隐源性肝炎的发病与肝细胞某些基因的相关性入手, 将隐源性肝炎相关新基因成功表达, 方法先进, 结果可靠, 为进一步研究隐源性肝炎的发病机制打下了基础.
编辑: 程剑侠 电编:郭海丽
| 2. | Detre K, Belle S, Beringer K, Daily OP. Liver transplantation for fulminant hepatic failure in the United States: October 1987 through December 1991. Clin Transplant. 1994;8:274-280. [PubMed] |
| 3. | Alter MJ, Margolis HS, Krawczynski K, Judson FN, Mares A, Alexander WJ, Hu PY, Miller JK, Gerber MA, Sampliner RE. The natural history of community-acquired hepatitis C in the United States. The Sentinel Counties Chronic non-A, non-B Hepatitis Study Team. N Engl J Med. 1992;327:1899-1905. [PubMed] |
| 4. | Alter HJ, Bradley DW. Non-A, non-B hepatitis unrelated to the hepatitis C virus (non-ABC). Semin Liver Dis. 1995;15:110-120. [PubMed] |
| 5. | Kodali VP, Gordon SC, Silverman AL, McCray DG. Cryptogenic liver disease in the United States: further evidence for non A, non-B, and non-C hepatitis. Am J Gastroenterol. 1994;89:1836-1839. [PubMed] |
| 7. | Nishizawa T, Okamoto H, Konishi K, Yoshizawa H, Miyakawa Y, Mayumi M. A novel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology. Biochem Biophys Res Commun. 1997;241:92-97. [PubMed] |
| 8. | Niel C, de Oliveira JM, Ross RS, Gomes SA, Roggendorf M, Viazov S. High prevalence of TT virus infection in Brazilian blood donors. J Med Virol. 1999;57:259-263. [PubMed] |
| 9. | Tanaka H, Okamoto H, Luengrojanakul P, Chainuvati T, Tsuda F, Tanaka T, Miyakawa Y, Mayumi M. Infection with an unenveloped DNA virus (TTV) associated with posttransfusion non-A to G hepatitis in hepatitis patients and healthy blood donors in Thailand. J Med Virol. 1998;56:234-238. [PubMed] |
| 10. | Simmonds P, Davidson F, Lycett C, Prescott LE, MacDonald DM, Ellender J, Yap PL, Ludlam CA, Haydon GH, Gillon J. Detection of a novel DNA virus (TTV) in blood donors and blood products. Lancet. 1998;352:191-195. [PubMed] |
| 11. | Desai SM, Muerhoff AS, Leary TP, Erker JC, Simons JN, Chalmers ML, Birkenmeyer LG, Pilot-Matias TJ, Mushahwar IK. Prevalence of TT virus infection in US blood donors and populations at risk for acquiring parenterally transmitted viruses. J Infect Dis. 1999;179:1242-1244. [PubMed] |
| 13. | Zhong S, Yeo W, Lin CK, Lin XR, Tang MW, Johnson PJ. Quantitative and genotypic analysis of TT virus infection in Chinese blood donors. Transfusion. 2001;41:1001-1007. [PubMed] |
| 14. | Tuveri R, Jaffredo F, Lunel F, Nalpa B, Pol S, Feray C, Marcellin P, Thibault V, Delagneau JF, Opolon P. Impact of TT virus infection in acute and chronic, viral- and non viral-related liver diseases. J Hepatol. 2000;33:121-127. [PubMed] |
| 15. | Al-Moslih MI, Abuodeh RO, Hu YW. Detection and genotyping of TT virus in healthy and subjects with HBV or HCV in different populations in the United Arab Emirates. J Med Virol. 2004;72:502-508. [PubMed] |
| 16. | Tomasiewicz K, Modrzewska R, Lyczak A, Polz-Dacewicz M, Rajtar B. TT virus (TTV)--etiologic agent of acute hepatitis? Ann Univ Mariae Curie Sklodowska [Med]. 2004;59:539-542. [PubMed] |
| 17. | Kasirga E, Sanlidag T, Akcali S, Keskin S, Aktas E, Karakoc Z, Helvaci M, Sozen G, Kuzu M. Clinical significance of TT virus infection in children with chronic hepatitis B. Pediatr Int. 2005;47:300-304. [PubMed] |
| 19. | Masia G, Ingianni A, Demelia L, Faa G, Manconi PE, Pilleri G, Ciancio A, Rizzetto M, Coppola RC. TT virus infection in Italy: prevalence and genotypes in healthy subjects, viral liver diseases and asymptomatic infections by parenterally transmitted viruses. J Viral Hepat. 2001;8:384-390. [PubMed] |
| 20. | Erensoy S, Sayiner AA, Turkoglu S, Canatan D, Akarca US, Sertoz R, Ozacar T, Batur Y, Badur S, Bilgic A. TT virus infection and genotype distribution in blood donors and a group of patients from Turkey. Infection. 2002;30:299-302. [PubMed] |
| 21. | Dai CY, Yu ML, Hou C, Lu SN, Wang JH, Huang JF, Chen SC, Lin ZY, Hsieh MY, Tsai JF. Clinical characteristics and distribution of genotypes of TT virus infection in a hepatitis C virus-hyperendemic township of a hepatitis B virus-endemic country (Taiwan). J Gastroenterol Hepatol. 2002;17:1192-1197. [PubMed] |
| 22. | Dai CY, Yu ML, Chuang WL, Sung MH, Lin ZY, Chen SC, Hsieh MY, Wang LY, Tsai JF, Chang WY. Epidemiology and clinical significance of chronic hepatitis-related viruses infection in hemodialysis patients from Taiwan. Nephron. 2002;90:148-153. [PubMed] |
| 23. | Hsu HY, Ni YH, Chen HL, Kao JH, Chang MH. TT virus infection in healthy children, children after blood transfusion, and children with non-A to E hepatitis or other liver diseases in Taiwan. J Med Virol. 2003;69:66-71. [PubMed] |
| 24. | Komatsu H, Inui A, Sogo T, Kuroda K, Tanaka T, Fujisawa T. TTV infection in children born to mothers infected with TTV but not with HBV, HCV, or HIV. J Med Virol. 2004;74:499-506. [PubMed] |
| 25. | Kheradpezhouh M, Taremi M, Gachkar L, Aghabozorgi S, Khoshbaten M. Presence and significance of transfusion-transmitted virus infection in Iranian patients on maintenance hemodialysis. J Microbiol Immunol Infect. 2007;40:106-111. [PubMed] |
| 26. | Das K, Kar P, Gupta RK, Das BC. Role of transfusion-transmitted virus in acute viral hepatitis and fulminant hepatic failure of unknown etiology. J Gastroenterol Hepatol. 2004;19:406-412. [PubMed] |
| 27. | Irshad M, Sharma Y, Dhar I, Singh J, Joshi YK. Transfusion-transmitted virus in association with hepatitis A-E viral infections in various forms of liver diseases in India. World J Gastroenterol. 2006;12:2432-2436. [PubMed] |
| 28. | Chan HL, Tsang SW, Leung NW, Tse CH, Hui Y, Tam JS, Chan FK, Sung JJ. Occult HBV infection in cryptogenic liver cirrhosis in an area with high prevalence of HBV infection. Am J Gastroenterol. 2002;97:1211-1215. [PubMed] |
| 29. | 何 忠平, 庄 辉, 宋 淑静, 王 雪萍, 王 融冰, 刘 庄. 临床诊断为非甲-戊型肝炎患者的病原学研究. 中华实验和临床病毒学杂志. 2002;16:7-10. |
| 30. | Marrero JA, Lok AS. Occult hepatitis B virus infection in patients with hepatocellular carcinoma: Innocent bystander, cofactor, or culprit? Gastroenterology. 2004;126:347-350. [PubMed] |
| 31. | Kaviani MJ, Behbahani B, Mosallaii MJ, Sari-Aslani F, Taghavi SA. Occult hepatitis B virus infection and cryptogenic chronic hepatitis in an area with intermediate prevalence of HBV infection. World J Gastroenterol. 2006;12:5048-5050. [PubMed] |
| 33. | Kao JH, Chen PJ, Lai MY, Chen DS. Basal core promoter mutations of hepatitis B virus increase the risk of hepatocellular carcinoma in hepatitis B carriers. Gastroenterology. 2003;124:327-334. [PubMed] |