修回日期: 2007-07-03
接受日期: 2007-07-28
在线出版日期: 2007-08-08
目的: 研究livin特异性小分子干扰RNA (siRNA)沉默胃癌SGC-7901细胞livin基因及对促胃癌细胞凋亡的影响.
方法: 设计针对人源livin基因的两条SiRNA: si-livin1和si-livin2, 分别转染至对数生长期的胃癌SGC-7901细胞; 逆转录酶链式反应(RT-PCR)检测转染前后胃癌SGC-7901细胞livin基因表达的变化, MTT法检测转染前后该细胞对5-FU、顺铂的半数抑制浓度(IC50)的变化以及检测转染前后细胞增殖能力的变化, PI染色后流式细胞仪检测转染前后细胞凋亡的变化.
结果: livin特异性siRNA转染胃癌SGC-7901细胞48 h后, si-livin1组livin α mRNA(灰度值表示)表达较空白对照组和阴性对照组显著减少(livin α: 0.167±0.013 vs 0.403±0.036, 0.389±0.053; livin β: 0.181±0.028 vs 0.413±0.041, 0.404±0.029, 均P<0.01). 而si-livin2组livin mRNA表达相比于空白对照组和阴性对照无显著差异; 转染siRNA后, si-livin1组胃癌细胞生长缓慢, 生长曲线较对照组平缓; si-livin1组细胞对5-FU和顺铂半数抑制浓度IC50较空白对照组和阴性对照组显著降低(5-FU: 34.07±2.98 vs 74.39±4.91, 69.85±4.57; 顺铂: 4.56±0.35 vs 9.07±0.44, 7.96±0.64, 均P<0.01); 转染siRNA后, si-livin1组胃癌细胞自发凋亡率较空白对照组和阴性对照组增加(11.07±1.36 vs 3.54±2.89, 6.72±1.77, P<0.01, P<0.05). 5-FU和顺铂作用后, si-livin1组胃癌细胞凋亡率较空白对照组和阴性对照组显著增加(5-FU: 34.90±1.76 vs 11.54±0.83, 13.54±2.55; 顺铂: 48.14±2.70 vs 14.51±0.35, 15.71±0.34, 均P<0.01).
结论: RNA干扰可有效沉默livin基因表达从而抑制胃癌SGC-7901细胞生长及增加该细胞凋亡敏感性, livin可能成为胃癌凋亡治疗途径的一个分子靶点.
引文著录: 王同杉, 游思洪, 葛红梅, 刘平. SiRNA沉默livin基因表达促进胃癌细胞凋亡. 世界华人消化杂志 2007; 15(22): 2377-2381
Revised: July 3, 2007
Accepted: July 28, 2007
Published online: August 8, 2007
AIM: To explore the feasibility of small interfering RNA (siRNA) for inhibiting livin gene expression, and to investigate the apoptotic susceptibility of SGC-7901 cells to siRNA-mediated silencing of the livin gene.
METHODS: Two siRNAs (si-livin1 and si-livin2) that specifically target the livin gene were designed based on their coding regions and were synthesized in vitro. They were then transfected into gastric cancer SGC-7901 cells. Expression level of livin mRNA was assayed by RT-PCR. Apoptosis was assessed by flow cytometry. Growth of SGC-7901 cells and 50% inhibitory concentration (IC50) of 5-fluorouracil (5-FU) and cisplatin for cell growth were analyzed by the MTT method.
RESULTS: The expression level of livin mRNA treated for 48 hours by si-livin1 was significantly decreased in SGC7901 cells (livin α, 0.167 ± 0.013 vs 0.403 ± 0.036, 0.389 ± 0.053; livin β, 0.181 ± 0.028 vs 0.413 ± 0.041, 0.404 ± 0.029, all P < 0.01) with an inhibited cell growth state, but not in si-livin2-treated cells. IC50 of 5-FU and cisplatin in SGC-7901 cells treated by si-livin1 was decreased (5-FU, 34.07 ± 2.98 vs 74.39 ± 4.91, 69.85 ± 4.57; cisplatin, 4.56 ± 0.35 vs 9.07 ± 0.44, 7.96 ± 0.64, all P < 0.01). The spontaneous apoptosis rate of cells was increased when they were treated by si-livin1 (11.07 ± 1.36 vs 3.54 ± 2.89, 6.72 ± 1.77, P < 0.01, P < 0.05), and cells treated by si-livin1 were more susceptible to proapoptotic stimuli (5-FU and cisplatin) than control groups (5-FU, 34.90 ± 1.76 vs 11.54 ± 0.83, 13.54 ± 2.55; cisplatin, 48.14 ± 2.70 vs 14.51 ± 0.35, 15.71 ± 0.34, all P<0.01).
CONCLUSION: siRNA can silence livin gene expression in SGC-7901 cells and induce cell apoptosis; thus, livin might serve as a new target for apoptosis-inducing therapy against gastric cancer.
- Citation: Wang TS, You SH, Ge HM, Liu P. Induction of apoptosis in SGC-7901 cells by small interfering RNA-mediated silencing of the livin gene. Shijie Huaren Xiaohua Zazhi 2007; 15(22): 2377-2381
- URL: https://www.wjgnet.com/1009-3079/full/v15/i22/2377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i22.2377
细胞凋亡过程调控异常与肿瘤发生发展密切相关[1-2], 随着对凋亡研究不断深入, 人们发现许多抗肿瘤药物是通过诱导细胞凋亡而发挥作用的[3-4], 诱导细胞凋亡已成为开发新的抗癌药物的研究热点之一. livin是近年来发现的人类凋亡抑制蛋白(inhibitor of apoptosis protein family, IAP)家族的新成员[5-7], 特异的分布于多种肿瘤组织[8-13], 并能抑制多种凋亡刺激剂诱发的细胞凋亡[14], 阻断凋亡抑制蛋白后可以促进癌细胞的凋亡[15-16]. 本实验室的前期研究发现, livin基因在部分胃癌组织中表达上调, 因此我们设计了以livin为靶标的siRNA, 观察RNA干扰对胃癌细胞系SGC-7901 livin基因mRNA的抑制作用及对胃癌细胞凋亡敏感性的影响.
胃腺癌细胞SGC-7901由本实验室保存; RPMI-1640培养基及小牛血清购自美国Hyclone公司; RT-PCR试剂盒购自美国Promega公司, RNA抽提试剂盒TRIzol购自美国Invitrogen公司、PCR仪为美国MJ Research公司PTC-200型; PCR引物、siRNA和荧光标记的阴性对照及转染用的RNAi-mate试剂来自上海吉玛生物公司; 二甲基亚枫(DMSO)、MTT试剂购自南京生兴生物技术有限公司; 5-FU(250 g/L)和顺铂(20mg/支)购自齐鲁制药厂. livin siRNA的设计: 同时设计两条siRNA的异构体, 首先自Genbank下载livin序列, 避开头尾非编码区及两条异构体有差异的部分, 采用麻省理工学院Whitehead研究所的设计程序设计livin siRNA序列, 即寻找到"NA"(N代表任一碱基)开头的序列, 连续取其3'端19个碱基, 经同源性比较分析唯一后, 将末尾再加上dTdT, 委托上海吉玛生物技术公司合成, 其正义链序列及起始位点分别为si-livin1: 5'-GGUGCUUCUUCUGCUAUGGdTdT-3'(539), si-livin2: 5'-GAGAGGUCCAGUCUGAAAGdTdT-3'(788).
将呈指数生长的SGC-7901细胞接种于细胞板上(96孔板每孔5×103细胞, 用于MTT试验, 12孔板每孔细胞数5×104, 用于流式细胞仪检测, 6孔板每孔细胞数1.5×105, 用于RT-PCR检测).
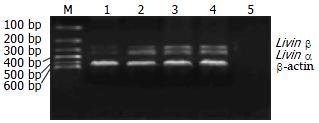
1.2.1 SiRNA转染及RT-PCR检测转染效果: 细胞培养24 h后进行2条siRNA转染, 96孔板每孔在总量200 μL液体中加入0.6 μg siRNA, 12孔板在1 mL液体中加入2 μg siRNA; 6孔板中2 mL液体中加5 μg. 应用RNAi-Mate转染试剂, 按说明优化转染条件. 设未转染的空白对照组及转染带荧光标记的无效siRNA做为阴性对照组, 同时在荧光显微镜下观察和判断转染效果(本实验转染效率65%). RT-PCR检测转染前后livin两条异构体mRNA的表达水平. 6孔板内各孔接种细胞数1.5×105培养24 h后, 设4组(si-livin1组、si-livin2组、空白对照组和阴性对照组), 每组设3复孔, siRNA转染48 h后收获细胞提取总RNA. RT-PCR方法及所需引物参照文献[17]. 以β-actin为内参照, 实验重复3次. 获得PCR扩增实验所需livin和β-actin基因的扩增引物. 根据GenBank提供的mRNA序列, 应用引物设计软件Primer Premier 5.0自行设计, 序列见表1. 用美国Promega公司的PCR扩增试剂盒进行PCR. PCR反应条件: 94℃预变性5 min, 94℃变性30 s, 59℃退火30 s, 72℃延伸30 s, 循环32次, 72℃终末延伸5 min, 目的和内参引物同时加入, 同管扩增. PCR反应后取5 μL PCR产物进行15 g/L琼脂糖凝胶电泳, 紫外照相并进行扫描分析, 以livin/β-actin进行livin基因表达水平半定量分析. 细胞转染前后livin/β-actin之差与转染前livin/β-actin之比结合转染率计算抑制效率.
| 基因 | 引物序列 | 扩增片段长度(bp) |
| livin α和livin β | 上游: 5'-TCCACAGTGTGCAGGAGACT-3' | 312和258 |
| 下游: 5'-ACGGCACAAAGACGATGGAC-3' | ||
| β-actin | 上游: 5'-AGCGCAAGTACTCCGTGTG-3' | 501 |
| 下游: 5'-AAGCAATGCTATCACCTCCC-3' |
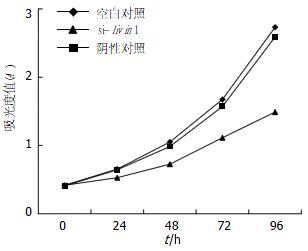
1.2.2 MTT法测定细胞生长曲线、顺铂和5-FU的半数抑制浓度(IC50): 取状态良好的对数生长期的细胞, 消化后用含小牛血清的培养液配成单细胞悬液, 每孔5×103接种于96孔板, 设3组(si-livin1组、空白对照组和阴性对照组)每组设6个复孔, 培养24 h后, 按照上述方法转染, 分别于转染后0, 24, 48, 72和96 h各孔加入5 g/L的MTT液20 μL, 继续培养4 h, 弃上清, 每孔加入DMSO 150 μL溶解, 492 nm波长测定各孔吸光度值(A), 描绘时间-吸光度值曲线, 吸光度与活细胞数呈正相关. 将未转染及经siRNA转染48 h后的各组SGC-7901细胞, 调整细胞浓度, 在96孔板每孔中加入5×103细胞数和不同浓度的5-FU和顺铂稀释液, 终体积200 μL, 培养48 h后, 同样以MTT法测定各孔吸光度值(A), 每组设3个复孔, 重复实验3次, 绘出浓度-抑制率曲线, 计算出半数抑制浓度(IC50), 比较各组差异.
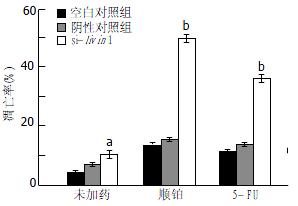
1.2.3 流式细胞仪检测各组细胞凋亡率: 将未转染及经siRNA转染48 h后的各组SGC-7901细胞, 调整细胞浓度按每孔5×104细胞数接种至12孔板, 分为未加药组、顺铂组(终浓度为4 g/L)和5-FU(终浓度为20 g/L)组, 培养48 h后, 收集细胞, 700 mL/L的乙醇(乙醇溶于PBS中)固定(-4℃保存备用), 送本校基础公用实验室进行PI染色后流式细胞仪检测. 每份标本计数10 000个细胞, 位于G0-G1亚二倍体峰为凋亡峰, 所占的比率为凋亡率, 重复实验3次.
统计学处理 用SPSS13.0进行统计学处理, 各组内比较用LSD检验, 组间比较采用方差分析, 所有数据用mean±SD表示, 以P<0.05为有统计学显著性.
SGC-7901细胞经siRNA处理48 h后, si-livin1组livin表达水平显著下调(P<0.01), si-livin2和阴性对照组则下调不明显(P>0.05), si-livin1对livin α抑制率为83.7%, 对livin β抑制率为80.2%(图1, 表2).
由于si-livin2对livin mRNA抑制效果不明显, 故以下实验不再对si-livin2进行研究. 实验结果显示si-livin1对细胞增殖有抑制作用, si-livin1生长曲线较空白和阴性对照组平缓(图2).
胃癌SGC-7901细胞对5-FU和顺铂的IC50值, si-livin1组低于空白对照组和阴性对照组(P<0.01)(表3).
在不加化疗药的情况下si-livin1组凋亡率高于空白对照组和阴性对照组(P<0.05), 而加入5-FU和顺铂后, si-livin1组细胞凋亡率比空白对照组和阴性对照组更为明显(P<0.01)(图3).
细胞凋亡过程调控异常不仅与肿瘤发生相关, 而且随着近年来对细胞凋亡研究的不断深入, 人们发现许多抗肿瘤药物是通过诱导细胞凋亡而发挥作用的[3-4], 诱导细胞凋亡已成为开发新的抗癌药物的研究热点之一. 胃癌是我国常见的恶性肿瘤之一, 发现时多属中晚期, 除手术外, 化疗是胃癌的重要治疗手段, 肿瘤细胞对化疗药物产生抵抗可导致治疗失败, 其原因是多方面的, 癌细胞对药物诱导凋亡的抵抗可能是原因之一[18-19]. 凋亡抑制蛋白(inhibitor of apoptosis protein family, IAP)家族在凋亡缺陷中的重要作用已受到人们重视. livin是IAP家族的新成员, 特异的分布于多种肿瘤组织, 参与了凋亡过程的调节, 能抑制多种凋亡刺激剂诱发的细胞凋亡, 有望成为肿瘤肿瘤治疗的一个新靶点[20]. 初步研究结果显示, 通过各种手段阻断凋亡抑制蛋白livin表达后可以促进癌细胞的凋亡[15-16]. 2001年, Elbashir et al[21]首次报道siRNA在体外培养的哺乳动物细胞内成功诱导基因特异阻抑以后, siRNA是否可应用于人类疾病的治疗受到了广泛的关注. 相继有人用靶向多药耐药蛋白1(mdr1)的siRNA转染人耐药肿瘤细胞(乳腺癌MCF27/AdrR细胞[22]、胰腺癌EPP85-181RDB细胞、胃癌EPG85-257RDB细胞[23]等), 研究结果显示, 靶向mdr1的siRNA对内外源的mdr1基因均有沉默作用, 并恢复细胞对化疗药物的敏感性, 为siRNA应用于人类疾病治疗积累了基础研究经验. 目前研究RNA干扰在胃癌中的应用主要集中在RNA干扰沉默胃癌靶基因及耐药基因等方面[24]. 本实验室前期研究结果显示livin在人胃癌组织中过表达, 尤其在淋巴结阳性的胃癌组织有较高表达率[17], 因此我们针对livin基因设计了2条siRNA序列(si-livin1, si-livin2), 分别转染SGC-7901细胞. RT-PCR检测发现其中一条siRNA(si-livin1)能够有效的抑制livin两条异构体的表达, 抑制效果在80%左右. 同时细胞经si-livin1作用后细胞增殖受到抑制, 自发凋亡及对5-FU和顺铂凋亡敏感性均增加, 对5-FU和顺铂的半数抑制浓度(IC50)则降低. 本研究结果与Crnkovic-Mertens et al[15]及国内孙建国 et al[25]在Hela细胞和SPC-A1细胞所获得结果相似. 本实验结果显示RNAi技术操作简单, 基因沉默效率高, 序列特异性好, 是肿瘤基因干预治疗的良好工具, 但本实验所采用化学合成法合成的siRNA在细胞内存在时间较短, 不能长期稳定表达, 长期的沉默效果不确定, 而采用以病毒为siRNA表达载体进行RNAi可获得长期稳定的表达而产生持久的作用. siRNAs在哺乳动物的作用目前尚不十分清楚, 其主要的作用机制可能是介导同源RNA降解. 最近有两个研究小组报道直接将siRNA注射至小鼠体内抑制基因表达获得成功[26-27], 提示siRNA用于临床治疗将成为可能. 我们将进一步进行体内实验研究, 以了解RNAi在体内发挥的效果. 另外由于肿瘤细胞的凋亡缺陷形成除了livin表达上调外, 尚可能有survivin及bcl-2等多种基因参与, 如有研究显示siRNA或反义核酸作用于survivin可使胃癌细胞增殖受到抑制和凋亡率增加[28-30]. 因此联合应用针对各种不同凋亡缺陷机制的siRNAs, 将可能更有效地逆转肿瘤细胞的凋亡缺陷, 促进和增强对恶性肿瘤的临床治疗效果.
细胞凋亡过程调控异常与肿瘤发生发展以及对药物的抵抗密切相关. livin是近年来发现的人类凋亡抑制蛋白(IAP)家族的新成员, 在多种肿瘤组织中表达, 能抑制凋亡诱导剂诱发的细胞凋亡, 因此抑制 IAP表达可以促进癌细胞凋亡, 增加肿瘤对化疗药物的敏感性.
许多抗肿瘤药物是通过诱导细胞凋亡而发挥作用的, 肿瘤细胞对药物诱导的凋亡产生抵抗可能是耐药的重要原因之一. 因此, 肿瘤凋亡诱导治疗研究将是克服肿瘤耐药的研究热点, 探索各种诱导肿瘤细胞凋亡的途径是亟待研究的问题.
2001年Elbashir et al首次报道siRNA在体外培养的哺乳动物细胞内成功诱导基因特异阻抑, 相继有人用靶向mdr1的siRNA转染人耐药肿瘤细胞, 结果表明靶向mdr1的siRNA对内外源的mdr1 基因均有沉默作用, 并可以恢复细胞对化疗药物的敏感性. Crnkovic-Mertens I及国内孙建国et al在 Hela细胞和肺癌SPC-A1细胞中阻断凋亡抑制蛋白livin表达后可以促进癌细胞的凋亡.
目前研究RNA干扰在胃癌中的应用主要集中在沉 默胃癌靶基因及耐药基因等方面, 用RNA干扰沉默 胃癌细胞livin基因的表达尚未见报道. 本研究结果表明, siRNA能够有效沉默livin基因, 抑制胃癌SGC-7901细胞生长及增加该细胞对化疗药物的敏感性.
本研究目前还处于体外研究阶段,但最近有研究报道直接将siRNA注射至小鼠体内抑制基因表达获得成功, 本文为进一步了解RNAi在体内发挥的效果提供了实验依据.
本文采用siRNA的技术研究了 livin基因及其对胃癌细胞凋亡的影响, 选题先进, 设计合理, 实验数据较详实, 证据充足; 论文科学结论较明确, 对进一步的临床基础研究有一定的指导作用. 反映了我国或国际胃肠病学临床和基础研究的先进水平.
编辑: 张焕兰 电编:何基才
| 1. | Cross M, Dexter TM. Growth factors in development, transformation, and tumorigenesis. Cell. 1991;64:271-280. [PubMed] |
| 2. | Lowe SW, Lin AW. Apoptosis in cancer. Carcinogenesis. 2000;21:485-495. [PubMed] |
| 3. | Nachmias B, Ashhab Y, Ben-Yehuda D. The inhibitor of apoptosis protein family (IAPs): an emerging therapeutic target in cancer. Semin Cancer Biol. 2004;14:231-243. [PubMed] |
| 4. | Johnstone RW, Ruefli AA, Lowe SW. Apoptosis: a link between cancer genetics and chemotherapy. Cell. 2002;108:153-164. [PubMed] |
| 5. | Kasof GM, Gomes BC. Livin, a novel inhibitor of apoptosis protein family member. J Biol Chem. 2001;276:3238-3246. [PubMed] |
| 6. | Lin JH, Deng G, Huang Q, Morser J. KIAP, a novel member of the inhibitor of apoptosis protein family. Biochem BiophysRes Commun. 2000;279:820-831. [PubMed] |
| 7. | Vucic D, Stennicke HR, Pisabarro MT, Salvesen GS, Dixit VM. ML-IAP, a novel inhibitor of apoptosis that is preferentially expressed in human melanomas. Curr Biol. 2000;10:1359-1366. [PubMed] |
| 8. | Carrington CB, Gaensler EA, Coutu RE, Fitzgerald MX, Gupta RG. Usual and desquamative interstitial pneumonia. Chest. 1976;69:261-263. [PubMed] |
| 9. | Yagihashi A, Ohmura T, Asanuma K, Kobayashi D, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of autoantibodies to survivin and livin in sera from patients with breast cancer. Clin Chim Acta. 2005;362:125-130. [PubMed] |
| 10. | Tanabe H, Yagihashi A, Tsuji N, Shijubo Y, Abe S, Watanabe N. Expression of survivin mRNA and livin mRNA in non-small-cell lung cancer. Lung Cancer. 2004;46:299-304. [PubMed] |
| 11. | Choi J, Hwang YK, Sung KW, Lee SH, Yoo KH, Jung HL, Koo HH, Kim HJ, Kang HJ, Shin HY. Expression of Livin, an antiapoptotic protein, is an independent favorable prognostic factor in childhood acute lymphoblastic leukemia. Blood. 2007;109:471-477. [PubMed] |
| 12. | Xiang Y, Yao H, Wang S, Hong M, He J, Cao S, Min H, Song E, Guo X. Prognostic value of Survivin and Livin in nasopharyngeal carcinoma. Laryngoscope. 2006;116:126-130. [PubMed] |
| 13. | Crnkovic-Mertens I, Muley T, Meister M, Hartenstein B, Semzow J, Butz K, Hoppe-Seyler F. The anti-apoptotic livin gene is an important determinant for the apoptotic resistance of non-small cell lung cancer cells. Lung Cancer. 2006;54:135-142. [PubMed] |
| 14. | Ashhab Y, Alian A, Polliack A, Panet A, Ben Yehuda D. Two splicing variants of a new inhibitor of apoptosis gene with different biological properties and tissue distribution pattern. FEBS Lett. 2001;495:56-60. [PubMed] |
| 15. | Crnkovic-Mertens I, Hoppe-Seyler F, Butz K. Induction of apoptosis in tumor cells by siRNA-mediated silencing of the livin/ML-IAP/KIAP gene. Oncogene. 2003;22:8330-8336. [PubMed] |
| 16. | Crnkovic-Mertens I, Semzow J, Hoppe-Seyler F, Butz K. Isoform-specific silencing of the Livin gene by RNA interference defines Livin beta as key mediator of apoptosis inhibition in HeLa cells. J Mol Med. 2006;84:232-240. [PubMed] |
| 17. | 王 同杉, 游 思洪, 葛 红梅, 陈 子庆, 丁 小健, 刘 平. 凋亡抑制蛋白livin在人胃癌中的表达以及和survivin表达的关系. 南京医科大学学报(自然科学版). 2006;26:39-43. |
| 18. | Herr I, Debatin KM. Cellular stress response and apoptosis in cancer therapy. Blood. 2001;98:2603-2614. [PubMed] |
| 19. | Zhivotovsky B, Orrenius S. Defects in the apoptotic machinery of cancer cells: role in drug resistance. Semin Cancer Biol. 2003;13:125-134. [PubMed] |
| 21. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] |
| 22. | Wu H, Hait WN, Yang JM. Small interfering RNA-induced suppression of MDR1 (P-glycoprotein) restores sensitivity to multidrug-resistant cancer cells. Cancer Res. 2003;63:1515-1519. [PubMed] |
| 23. | Nieth C, Priebsch A, Stege A, Lage H. Modulation of the classical multidrug resistance (MDR) phenotype by RNA interference (RNAi). FEBS Lett. 2003;545:144-150. [PubMed] |
| 25. | 孙 建国, 廖 荣霞, 陈 正堂, 王 志新, 张 青, 胡 义德, 王 东林, 粟 永萍. livin异构体特异性siRNA表达载体的构建及其在SPC-A1细胞中的稳定表达. 肿瘤. 2006;26:139-147. |
| 26. | Lewis DL, Hagstrom JE, Loomis AG, Wolff JA, Herweijer H. Efficient delivery of siRNA for inhibition of gene expression in postnatal mice. Nat Genet. 2002;32:107-108. [PubMed] |
| 27. | McCaffrey AP, Meuse L, Pham TT, Conklin DS, Hannon GJ, Kay MA. RNA interference in adult mice. Nature. 2002;418:38-39. [PubMed] |
| 30. | Miao GY, Lu QM, Zhang XL. Downregulation of survivin by RNAi inhibits growth of human gastric carcinoma cells. World J Gastroenterol. 2007;13:1170-1174. [PubMed] |