修回日期: 2007-07-15
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 探讨抑癌基因RASSF1A启动子在胃癌组织及胃良性病变中甲基化的发生情况及与临床特征的关系.
方法: 采用甲基化特异性聚合酶链反应(MS-PCR)方法检测32例胃癌组织及32例相应的癌旁组织, 以及46例胃良性病变中RASSF1A基因甲基化发生情况.
结果: 在32例胃癌DNA标本中, RASSF1A基因甲基化发生率为62.5%(20/32). 而在32例癌旁组织中, 只有1例存在甲基化, 占3.1%(1/32), 二者之间比较差异有统计学意义(P<0.05). 在胃良性病变, 浅表性胃炎和萎缩性胃炎中甲基化发生频率分别为3.3%和37.5%. RASSF1A基因甲基化发生率与胃癌分化程度、肿瘤大小及淋巴结转移之间无显著相关性.
结论: RASSF1A基因启动子区甲基化在胃癌的发生发展中起重要作用.
引文著录: 李学彦, 傅宝玉. 胃癌组织RASSF1基因启动子区甲基化的意义. 世界华人消化杂志 2007; 15(21): 2354-2357
Revised: July 15, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To investigate the methylation status of the suppressor gene RASSF1A promoter in gastric carcinoma and benign gastric disease, and its clinicopathological significance.
METHODS: Methylation status of the RASSF1A promoter was detected by methylation specific-polymerase chain reaction (MS-PCR) in 32 patients with gastric carcinoma, adjacent non-carcinomatous gastric tissues, and 46 patients with benign gastric disease.
RESULTS: The frequency of RASSF1A promoter methylation in gastric carcinoma was 62.5% (20/32), and in adjacent non-carcinomatous gastric tissues, it was 3.1% (1/32), while in chronic shallow gastritis and chronic atrophic gastritis, it was 3.3% (1/30) and 37.5% (6/16), respectively. The rates of RASSF1A promoter methylation in gastric carcinoma and adjacent non-carcinomatous gastric tissues were significantly correlated (P < 0.01). Methylation of RASSF1A promoter in gastric carcinoma had no relationship with differentiation grade, lymph node metastasis and tumor size.
CONCLUSION: Methylation of RASSF1A promoter in gastric carcinoma may be an important molecular change and contribute to the development of gastric carcinoma.
- Citation: Li XY, Fu BY. Methylation of the RASSF1A gene promoter in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2354-2357
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2354.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2354
胃癌是全世界最常见的肿瘤, 我国是胃癌高发区. 对胃癌的发生发展的研究一直是学者们关注的焦点. RASSF1(ras-association domain family 1)即ras相关区域家族1基因, 是2000 年从肺癌细胞株3号染色体短臂克隆的新型候选抑癌基因[1-2]. 它有多种不同mRNA剪接体, RASSF1A是其中主要的一种. 研究发现, RASSF1A基因在正常组织中广泛表达, 而在肿瘤组织中表达经常缺失, RASSF1A基因是人类肿瘤中经常失活的抑癌基因[3]. 随着表观遗传学研究的发展, 发现基因启动子区域的异常甲基化是抑癌基因失活的主要机制之一. 我们采用巢式甲基化特异性逆转录聚合酶链反应法, 观察RASSF1A在胃癌及胃良性病变中甲基化发生情况及与临床特征的关系, 为胃癌早期诊断提供有价值的依据.
2004-06/2005-06手术切除胃癌组织及相应的癌旁组织各32例. 2004-06/2005-06间胃镜下活检标本46例, 包括浅表性胃炎30例, 萎缩性胃炎16例. 离体后迅速放入液氮中冻存, 后转入-80℃冰箱保存备用. 所有患者术前均未经放化疗. 高分化腺癌12例, 中分化腺癌9例, 低分化腺癌11例. 有淋巴结转移25例, 无淋巴结转移7例, 全部病例均经两位病理科医生确诊. 根据美国Medlin国立图书馆基因库检索基因全序列, 电脑软件Primer 5.0版自行设计, RASSF1A测定甲基化(m)和非甲基化(u)程度引物由北京三博远志生物技术有限公司Primer合成. RT-PCR试剂盒购于TaKaRa大连宝生物. PCR反应体系购于上海生工生物技术服务有限公司.
组织标本约0.1 g剪碎, 置于DNA裂解液中, 按照DNA试剂盒说明提取基因组DNA, UV-1201型(日本)紫外分光光度计测定DNA浓度, 浓度A260约等于1.6, -20℃保存备用. 取5 μg DNA(10 μL)加3 mmol/L的NaOH 15.5 μL, 再加超纯水24.5 μL, 37℃放置15 min. 向碱变性的DNA中加入新鲜配制的3 mmol/L亚硫酸氢钠(NaHSO3 pH5.0)280 μL和10 mmol/L氢醌(C6H6O2)15 μL, 以矿物油2滴覆盖液面, 50℃保温放置16-20 h. 利用Wizard DNA纯化试剂盒纯化修饰后的DNA. 加入3 mmol/LNaOH 5.5 μL, 室温下放置10-20 min脱硫. 加入6 mmol/L 乙酸氨(NH4AC)40 μL, 再加预冷的无水乙醇沉淀DNA, 以超纯水30 μL溶解, -20℃过夜. RASSF1A甲基化特异性聚合酶链反应(MS-PCR)共设计了2对引物, 分别用来扩增RASSF1A基因启动子5' CpG位点处于m状态和u状态的等位基因. RASSF1A-m-F 5'-GTGTTAACGCGTTGCGTATC-3'; RASSF1A-m-R 5'-AACCCCGCGAACTAAAAACGA-3', 扩增长度128 bp, RASSF1A-u-F 5'-TTTGGTTGGAGTGTGTTAATGTG-3'; RASSF1A-u-R 5'-CAAACCCCACAAACTAAAAACAAA-3', 扩增长度109 bp. PCR反应体积25 μL. 取DNA-Na 5 μL, dd.H2O 13.3 μL, 10×buffer 2.5 μL, dNTPs(2.5 mmol/L)2 μL, Tag酶0.2 μL, 分别取RASSF1A-m上下游引物、RASSF1A-u上下游引物各1 μL. 反应条件为: 95℃预变性5 min, 95℃变性60 s, 55℃ 60 s, 74℃延伸2 min, 共30个循环, 最后一个循环74℃补延伸5 min. 取上述PCR产物15 μL经20 g/L琼脂糖凝胶电泳鉴定. 电泳成像拍照并用Kodak 3.5专用软件进行图象分析. 随机选取2例胃癌标本, RASSF1A基因甲基化和未甲基化PCR产物, 送北京三博远志生物技术有限公司测序仪测序分析.
统计学处理 采用卡方检验, 检验水准为: 双侧α = 0.05, 结果用SPSS9.0统计软件处理.
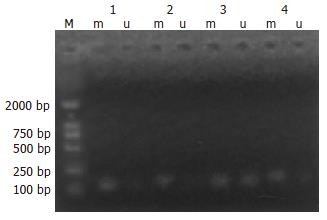
在胃癌全部32例标本中, 有20例(62.5%)发生了RASSF1A基因启动子区甲基化, 其中, 少数为纯甲基化, 大部分为甲基化和非甲基化并存, 即部分甲基化, 而在32例癌旁组织中, 存在RASSF1A基因启动子区甲基化的只有1例(3.1%). 在胃良性病变中, 浅表性胃炎甲基化发生率3.3%低, 而萎缩性胃炎甲基化发生率37.5%高, 胃癌甲基化发生率与癌旁组织及浅表性胃炎发生率比较差异有显著性(P<0.05), 其余各组之间比较差异无显著性(图1, 图2). 在RASSF1A甲基化胃癌标本中, 其基因启动子CpG岛的16个CpG位点有14个发生了甲基化, 而未甲基化胃癌标本中, CpG岛的胞嘧啶(C)全部转变成尿嘧啶(T).
在病理分型之间高分化、中分化胃癌组织RASSF1A基因启动子区甲基化发生率低于低分化胃癌, 分别为33.3%, 55.6%, 63.6%, 但各类型标本中甲基化发生率各组间比较差异无显著意义(P>0.05). 胃癌中有淋巴结转移组甲基化发生率为64%(16/25), 无淋巴结转移组甲基化发生率42.8%(3/7), 两组之间比较差异无显著性.
RASSF1基因是一种抑癌基因, 全长1873 bp, 包含2个启动子及6个外显子, 在其启动子区域存在16个CpG位点. RASSF1基因由于使用了不同的剪接和启动子, 形成3个主要的转录本, 即: RASSF1A, RASSF1B, RASSF1C. RASSF1A作为一种肿瘤抑制基因, 其功能失活将导致对肿瘤的抑制作用丧失. 现已发现在肺癌、乳腺癌、胰腺癌、胃癌等多种肿瘤组织中有RASSF1A基因频繁转录失活[4-5]. 现已明确, RASSF1A在多种肿瘤中表达失活的机制是由于其启动子区CpG岛的特异性高甲基化所致. 并可见到DNA甲基化转移酶Ⅰ的异常增高. 由此可见, 高甲基化介导抑癌基因表达沉寂, 在肿瘤的发生中起到重要作用[6]. 非癌组织中的RASSF1A基因未见或仅见极低频率的甲基化. RASSF1A基因启动子区发生高甲基化的比率在胃癌中是35%-60%, 在原发性非小细胞肺癌、乳腺癌中的比率分别是72%-78%, 49%-61%[7-8]. RASSF1A的失活还可由于突变引起, 但突变率小于10%. 失活的RASSF1A可经甲基化抑制剂5-氮-2脱氧胞苷(5-aza-dC)处理后重新活化[9]. 这给临床治疗提供了理论依据.
目前国外有许多RASSF1A甲基化状态的报道. Kang et al[10]应用特异性PCR检查方法, 检测了268例胃组织标本中RASSF1A甲基化程度, 其中包括急性胃炎、慢性胃炎, 肠上皮化生(IM), 胃癌(GC)等. 结果发现, RASSF1A高甲基化发生在胃癌中, 而在其它病变, 如胃腺瘤、肠上皮化生及慢性胃炎中该基因的甲基化率极低[11]. 另一些研究应用甲基化特异性PCR检查方法检测胃肠上皮化生与甲基化发生率状态关系的结果也证实了这一点[12-13]. 我们采用巢式MSP法, 使扩增倍数更高,灵敏度更高, 对胃癌组织及胃良性病变中RASSF1A启动子存在甲基化状态进行检测. 结果发现, 在32例胃癌组织中, 有62.5%(20/32)的标本中存在RASSF1A基因启动子区甲基化, 而癌旁胃组织, 存在甲基化的比率只有3.1%, 二者之间比较差异有显著意义(P<0.05). 表明RASSF1A启动子区甲基化参与了胃癌的发生发展. 在胃良性病变中, 浅表性胃炎甲基化发生率低3.3%, 而萎缩性胃炎甲基化程度略高为37.5%, 但二者之间比较差异无显著性, 可能因为病例少的原因. 胃癌甲基化发生率与癌旁组织及浅表性胃炎发生率比较差异有显著性(P<0.01). 在胃癌病理组织分化中高分化、中分化胃癌RASSF1A甲基化发生率低于低分化胃癌, 但各组之间比较差异无显著性. 本研究表明胃癌中有淋巴结转移和无淋巴结转移组甲基化发生率者分别为64%(16/25)和42.8%(3/7), 两组之间比较差异无显著性. 说明RASSF1A甲基化与病理分化程度及淋巴结转移无明显相关性. 本实验PCR产物测序结果显示, RASSF1A甲基化胃癌标本中基因启动子区CpG岛的16个CpG位点有14个发生了甲基化, 而未甲基化胃癌标本中, CpG岛的胞嘧啶(C)全部转变成尿嘧啶(T). 说明在胃癌组织中, RASSF1A基因启动子区确实存在CpG位点被甲基化现象. 与文献研究结果一致[14-15].
根据已被广泛证实的启动子区域的DNA甲基化胞嘧啶的密度和基因转录活性的相互关系[16], 可以认为启动子区域CpG位点甲基化是RASSF1A失活的主要机制, 在胃癌的发生过程中发挥主要作用.
RASSF1是一种新型候选抑癌基因, RASSF1A基因是人类肿瘤中经常失活的抑癌基因, 研究发现基因启动子区域的异常甲基化是其失活的主要机制之一.
本文检测RASSF1 A在胃癌及胃良性病变中甲基化发生率, 比较良性病变与恶性病变甲基化发生不同情况, 为临床诊断治疗提供依据.
本文观察RASSF1A在胃癌中失活情况, 进一步研究可应用甲基化抑制剂5-氮-2脱氧胞苷(5-aza-dC)处理后使RASSF1A重新活化,观察其抑癌作用, 为临床治疗提供数据.
本文研究了RAS-SF1A在胃癌的发生发展中起重要作用是由于其基因启动子区甲基化, 立题新颖, 方法成熟, 数据可信, 对临床指导有重要意义.
编辑:程剑侠 电编:何基才
| 1. | Lerman MI, Minna JD. The 630-kb lung cancer homozygous deletion region on human chromosome 3p21.3: identification and evaluation of the resident candidate tumor suppressor genes. The International Lung Cancer Chromosome 3p21.3 Tumor Suppressor Gene Consortium. Cancer Res. 2000;60:6116-6133. [PubMed] |
| 2. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] |
| 3. | Chen H, Suzuki M, Nakamura Y, Ohira M, Ando S, Iida T, Nakajima T, Nakagawara A, Kimura H. Aberrant methylation of RASGRF2 and RASSF1A in human non-small cell lung cancer. Oncol Rep. 2006;15:1281-1285. [PubMed] |
| 4. | Schagdarsurengin U, Seidel C, Ulbrich EJ, Kolbl H, Dittmer J, Dammann R. A polymorphism at codon 133 of the tumor suppressor RASSF1A is associated with tumorous alteration of the breast. Int J Oncol. 2005;27:185-191. [PubMed] |
| 5. | Dammann R, Schagdarsurengin U, Liu L, Otto N, Gimm O, Dralle H, Boehm BO, Pfeifer GP, Hoang-Vu C. Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma. Oncogene. 2003;22:3806-3812. [PubMed] |
| 6. | Grote HJ, Schmiemann V, Geddert H, Bocking A, Kappes R, Gabbert HE, Sarbia M. Methylation of RAS association domain family protein 1A as a biomarker of lung cancer. Cancer. 2006;108:129-134. [PubMed] |
| 7. | Dammann R, Strunnikova M, Schagdarsurengin U, Rastetter M, Papritz M, Hattenhorst UE, Hofmann HS, Silber RE, Burdach S, Hansen G. CpG island methylation and expression of tumour-associated genes in lung carcinoma. Eur J Cancer. 2005;41:1223-1236. [PubMed] |
| 8. | Honorio S, Agathanggelou A, Schuermann M, Pankow W, Viacava P, Maher ER, Latif F. Detection of RASSF1A aberrant promoter hypermethylation in sputum from chronic smokers and ductal carcinoma in situ from breast cancer patients. Oncogene. 2003;22:147-150. [PubMed] |
| 9. | Zhang X, Yashiro M, Ohira M, Ren J, Hirakawa K. Synergic antiproliferative effect of DNA methyltransferase inhibitor in combination with anticancer drugs in gastric carcinoma. Cancer Sci. 2006;97:938-944. [PubMed] |
| 10. | Kang GH, Shim YH, Jung HY, Kim WH, Ro JY, Rhyu MG. CpG island methylation in premalignant stages of gastric carcinoma. Cancer Res. 2001;61:2847-2851. [PubMed] |
| 11. | To KF, Leung WK, Lee TL, Yu J, Tong JH, Chan MW, Ng EK, Chung SC, Sung JJ. Promoter hypermethylation of tumor-related genes in gastric intestinal metaplasia of patients with and without gastric cancer. Int J Cancer. 2002;102:623-628. [PubMed] |
| 12. | Kang GH, Lee S, Kim JS, Jung HY. Profile of aberrant CpG island methylation along the multistep pathway of gastric carcinogenesis. Lab Invest. 2003;83:635-641. [PubMed] |
| 13. | Kang GH, Lee HJ, Hwang KS, Lee S, Kim JH, Kim JS. Aberrant CpG island hypermethylation of chronic gastritis, in relation to aging, gender, intestinal metaplasia, and chronic inflammation. Am J Pathol. 2003;163:1551-1556. [PubMed] |
| 14. | Umetani N, de Maat MF, Sunami E, Hiramatsu S, Martinez S, Hoon DS. Methylation of p16 and Ras association domain family protein 1a during colorectal malignant transformation. Mol Cancer Res. 2006;4:303-309. [PubMed] |
| 15. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |
| 16. | Chen YJ, Tang QB, Zou SQ. Inactivation of RASSF1A, the tumor suppressor gene at 3p21.3 in extrahepatic cholangiocarcinoma. World J Gastroenterol. 2005;11:1333-1338. [PubMed] |