修回日期: 2007-07-23
接受日期: 2007-07-28
在线出版日期: 2007-07-28
目的: 研究高脂血症、高脂血症性脂肪肝大鼠血浆及肝组织ADM2/IMD的变化, 探讨ADM2/IMD在高脂血症、高脂血症性脂肪肝病理过程中的意义.
方法: 雄性SD大鼠16只, 随机均分为对照组与高脂组. 大鼠被高脂喂食造模4 wk后, 观察大鼠肝脏病理学变化, 测定血脂(TG, TC, HDL-C, LDL-C)及肝功能(ALT, AKP); 放免法测定血浆及肝组织匀浆ADM2/IMD含量.
结果: 高脂组体质量、肝质量及肝指数(肝质量/体质量)均显著高于对照组(P<0.01)肝组织呈轻中度脂肪变. 高脂组TG、TC、LDL-C、ALT及AKP均显著高于对照组(0.29±0.05 mmol/L vs 0.18±0.09 mmol/L, 2.49±0.35 mmol/L vs 1.25±0.16 mmol/L, 1.69±0.18 mmol/L vs 0.49±0.06 mmol/L, 25.46±5.14 kU/L vs 13.15±2.83 kU/L, 416.1±42.7 U/L vs 281.2±47.3 U/L; P<0.01). HDL-C则低于对照(0.65±0.11 mmol/L vs 0.75±0.10 mmol/L, P<0.01). 血浆ADM2/IMD水平两组间差异无统计学意义(P>0.05); 但高脂组肝组织匀浆ADM2/IMD水平较对照组高115%(26.21±11.2 pg/mg•pro vs 12.18±2.9 pg/mg•pro, P<0.01).
结论: ADM2/IMD可能与大鼠饮食性高脂血症和高脂血症性脂肪肝病理进程有关.
引文著录: 张玉青, 黄卡特, 毛孙忠, 吴小脉, 黄萍, 范小芳, 龚永生. 高脂血症和高脂血症性脂肪肝大鼠肾上腺髓质素2的变化. 世界华人消化杂志 2007; 15(21): 2341-2344
Revised: July 23, 2007
Accepted: July 28, 2007
Published online: July 28, 2007
AIM: To investigate changes in adrenomedullin 2/intermedin (ADM2/IMD) in plasma and hepatic tissues of rats with hyperlipidemia and its possible role in the development of hyperlipidemic fatty liver.
METHODS: Sixteen male Sprague-Dawley rats were randomly divided into normal control and hyperlipidemia model groups (n = 8 each). The model was established by feeding a high-fat diet for 4 wk. Liver histology, liver index (liver weight/body weight), liver function alanine aminotransferase (ALT) and alkaline phosphatase (AKP) and blood lipids were assayed. The levels of ADM2/IMD in plasma and liver were measured by radioimmunoassay.
RESULTS: Body and liver weights and liver index increased in the hyperlipidemia model group compared with controls (P < 0.01). Liver histology showed mild to moderate fatty denaturation in the hyperlipidemia model group. Triglyceride, total cholesterol, low-density lipoprotein cholesterol, ALT and AKP in the hyperlipidemia model group were higher than in the controls (0.29 ± 0.05 mmol/L vs 0.18 ± 0.09 mmol/L, 2.49 ± 0.35 mmol/L vs 1.25 ± 0.16 mmol/L, 1.69 ± 0.18 mmol/L vs 0.49 ± 0.06 mmol/L, 25.46 ± 5.14 kU/L vs 13.15 ± 2.83 kU/L, and 416.1 ± 42.7 U/L vs 281.2 ± 47.3 U/L, respectively; P < 0.01), and high-density lipoprotein cholesterol was lower than in the control group (0.65 ± 0.11 mmol/L vs 0.75 ± 0.10 mmol/L, P < 0.01). The ADM2/IMD level in hepatic tissues increased 115% in the hyperlipidemia model group compared with the controls (26.21 ± 11.2 pg/mg•pro vs 12.18±2.9 pg/mg•pro, P<0.01), while the plasma concentration of ADM2/IMD was no different between the two groups (P > 0.05).
CONCLUSION: ADM2/IMD appears to be correlated with the development of hyperlipidemia and hyperlipidemic fatty liver in rats.
- Citation: Zhang YQ, Huang KT, Mao SZ, Wu XM, Huang P, Fan XF, Gong YS. Changes in adrenomedullin 2 in rats with hyperlipidemia and hyperlipidemic fatty liver. Shijie Huaren Xiaohua Zazhi 2007; 15(21): 2341-2344
- URL: https://www.wjgnet.com/1009-3079/full/v15/i21/2341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i21.2341
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是遗传-环境-代谢应激相关因素所致的、以肝细胞内脂肪堆积为主的临床病理综合征, 高脂血症性脂肪肝是NAFLD的一种. NAFLD的发病机制至今尚未完全明确, 目前认为脂质在肝细胞中的沉积是NAFLD的发病前提, 脂质过氧化和炎症反应在NAFLD发生发展中起重要的作用[1-2]. 研究已表明肾上腺髓质素(ADM)与脂质代谢有着密切的关系[3], 肾上腺髓质素2(adrenomedullin2, ADM2)或中介素(intermedin, IMD)是ADM的横向同源物, 为新近分别由日本和美国学者发现的降钙素基因相关肽(calcitonin gene-related peptide, CGRP)家族的新成员, 经比较认为ADM2与IMD实为同一多肽[4-5]. 研究发现, ADM2/IMD具有抗氧化损伤、抗炎、调节免疫等广泛的生物学效应, 是新的内源性心血管、肾脏保护因子[6-8]. 而有关ADM2/IMD在代谢综合征如高脂血症、脂肪肝、糖尿病等发病过程中的作用尚知之甚少. 本工作拟在饮食性高脂血症大鼠模型上, 观察血浆和肝组织ADM2/IMD水平的变化, 旨在初步探讨IMD/ADM2这一新的活性多肽与高脂血症和高脂血症性脂肪肝病理过程的关系.
清洁级标准健康♂SD大鼠, 由温州医学院实验动物中心提供(温医动字号220030002号). 血浆总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)试剂盒购自北京中生生物工程高技术公司. 谷丙转氨酶(ALT)及碱性磷酸酶(AKP)试剂盒购自南京建成生物工程研究所. ADM2/IMD放免试剂盒由美国Phoenix Pharmaceuticals, Inc.公司提供. 日立7600全自动生化分析仪, WALLAC r计数仪.
1.2.1 高脂血症动物模型的建立: 16只清洁级SD大鼠正常喂养1 wk后, 随机均分为2组: 对照组和高脂组. 对照组给予基础饲料饲养; 高脂组给予高脂饲料(胆固醇2%, 猪油10%, 基础饲料88%), 按每100 g体质量20 g, 分早、中、晚三餐, 定时定量分别给予. 大鼠单笼饲养, 均自由饮水及摄食. 4 wk后, 取血及肝组织, 检测各项指标.
1.2.2 观察指标及测定方法: (1)观察大鼠的食欲、体质量、行为、状态、毛发等情况, 实验结束处死动物时, 称体质量、肝质量及计算肝指数(肝质量mg/体质量g). (2)生物化学指标: 用酶法测定TC、TG、LDL-C、HDL-C及AKP的含量, 用赖氏法测定ALT的含量. (3)血浆及肝组织IMD/ADM2测定: 采用放免法, 按放免药盒说明书操作. ADM2/IMD(人)试剂盒与大鼠、小鼠的ADM2/IMD及IMD-53(大鼠)、ADM2/IMD(8-47)的交叉反应100%; 与人及大鼠的肾上腺髓质素(ADM), 人的Prepro-IMD(25-56)、Prepro-IMD(57-92)及人、大鼠的CGRP无交叉反应. 其IC50为55.45 pg/管, Binding为26%.
1.2.3 组织病理学检查: 取右叶部分肝组织用40 g/L多聚甲醛固定, 石蜡包埋, HE染色, 光镜下观察肝组织学的改变.
统计学处理 实验数据均以均数±标准差( mean±SD)表示. 组间比较采用SPSS11.0统计软件进行非配对t检验.
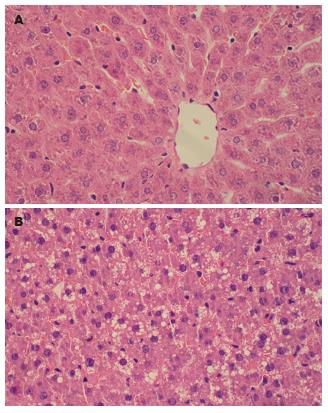
高脂组大鼠体质量、肝重及肝指数均显著高于对照组(P均<0.01, 表1). 肝脏组织学改变: 高脂组大鼠肝脏肉眼观体积增大、颜色呈浅黄、切面油腻感. 光镜下对照组大鼠肝小叶清晰, 肝细胞索排列整齐, 偶见小泡性脂肪滴(图1A); 高脂组可见中度脂肪变, 肝细胞变大, 胞浆内可见大小不一小泡性脂肪滴, 细胞核居中, 肝窦略狭窄, 小叶内和汇管区可见炎细胞浸润并伴有肝细胞坏死(图1B).
高脂组血浆TG、TC、LDL-C明显高于对照组, 同时HDL-C水平显著降低(P均<0.01), 见表2. 高脂组大鼠肝功能异常, 血浆ALT和AKP显著高于对照组(P均<0.01)(表3).
血浆IMD/ADM2水平两组间差异无统计学意义(P>0.05); 而肝组织匀浆中IMD/ADM2含量高脂组较对照组高115%(P<0.01)(表3).
随着人们生活条件的提高,饮食结构的改变, 高脂血症和脂肪肝已成为当今社会的常见病和多发病. 高脂血症可诱发高脂血症性脂肪肝、动脉粥样硬化(As)、冠心病等临床常见疾病. 高脂血症和高脂血症性脂肪肝的病因学、预防和治疗已经成为目前的研究热点. 高脂血症性脂肪肝是NAFLD的一种, NAFLD的发病机制复杂, 确切发病机制目前尚不清楚, 现在比较接受的发病机制学说是"二次打击学说", 该学说认为: 一次打击主要是胰岛素抵抗(IR)引起肝脏脂肪沉积, 使肝细胞对损害因子的敏感性增高; 二次打击是肝内脂质沉积可加强氧化应激和脂质过氧化反应, 导致线粒体解偶联蛋白、细胞因子及Fas配体被诱导活化, 从而引起炎症和纤维化的发生[9-10].
ADM2/IMD是近期发现的CGRP多肽家族新成员, 系ADM的横向同源物(paralog, 即指起源于同一祖先, 在同一生物体中由同一基因复制而产生的多个蛋白质的基因). 在不同哺乳动物间, ADM2/IMD序列高度保守, 其mRNA的组织分布十分广泛, 在胰腺、胸腺、卵巢等组织中均存在ADM2/IMD mRNA的表达. 研究发现, ADM2/IMD与高血压、心肌缺血、低氧性肺动脉高压和肾功能衰竭等疾病的发生发展密切相关. 已知ADM在能量代谢、水盐平衡、内分泌激素释放调控中发挥十分重要的作用[11], 与脂质代谢也有着密切的关系-ADM可抑制胰岛素的分泌[3], 而后者可诱导胆固醇生物合成限速酶羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的合成. 近来发现ADM2/IMD能抑制动物水和食物摄取的行为[12]; 此外, ADM2在中枢系统主要表达于垂体中叶, 与一些应激激素如促黑色素细胞激素(α-MSH)、催乳素(PRL)、促肾上腺皮质激素(ACTH)的表达部位相似, 提示ADM2/IMD可作为旁分泌因子调节垂体前叶激素的分泌[13]. 据此推测, 和其横向同源物ADM一样, ADM2/IMD可能在维持机体自稳态如内分泌、代谢应激等的调控中发挥重要的生物学效应.
我们采用了高脂膳食建立的高脂血症大鼠模型, 观察了血浆及肝脏组织ADM2/IMD水平的变化. 结果提示, 高脂组大鼠在血脂明显异常、肝脏脂肪浸润及肝功能受损的同时, 肝组织匀浆IMD/ADM2浓度显著高于对照组. 已知脂质自稳态受多种因子调控, 如胰岛素可诱导羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的合成, 氧化应激、炎性细胞因子如IL-1β、TNF-α等在脂质代谢紊乱对靶器官的损害中也起重要作用[14-15]. 有研究表明, ADM可抑制胰岛素分泌[10], 而氧化应激、TNF-α、IL-1等刺激ADM表达上调[16-18]. 据此推测, 大鼠高脂血症、脂肪肝病理过程中, ADM2/IMD在肝脏组织浓度的增加可能与上述因素有关, 可能在肝组织病理损害中发挥保护性调控作用. 但高脂组大鼠循环血液中ADM2/IMD浓度较对照组并无显著变化. 这是否提示在大鼠高脂血症发生发展中, IMD/ADM2仅以旁分泌/自分泌形式在局部发挥作用? 这尚待进一步的研究.
总之, 我们研究提示, ADM2/IMD可能与大鼠饮食性高脂血症和高脂血症性脂肪肝病理进程有关, 在脂质代谢紊乱对靶器官的损害中可能扮演重要角色. 但其确切的作用机制及与其他蛋白因子(基质金属蛋白酶、环氧合酶-2、脂联素)、细胞因子(TNF-α、IL-1、细菌脂多糖)等之间的相互作用和影响, 均有待更为深入的研究和探讨.
研究表明肾上腺髓质素(ADM)与脂质代谢有着密切的关系. ADM2/IMD是ADM的横向同源物, 有关其在代谢综合征如高脂血症、脂肪肝等发病过程中的作用尚知之甚少.
高脂血症可诱发高脂血症性脂肪肝、动脉粥样硬化、冠心病等临床常见疾病. 高脂血症和高脂血症性脂肪肝的病因学、预防和治疗已经成为目前的研究热点, 但其确切发病机制目前尚不清楚.
理论上的横向推测并经实 验 证实: 与其横向同源物ADM一样, ADM2/IMD可能与大鼠饮食性高脂血症和高脂血症性脂肪肝病理进程有关.
本文首次发现ADM2/IMD可能与大鼠饮食性高脂血症和高脂血症性脂肪肝病理进程有关, 在脂质代谢紊乱对靶器官的损害中可能扮演重要角色, 为以后高脂血症性脂肪肝的发病机制及防治的研究提供一个新的靶点.
横向同源物(para-log), 即指起源于同一祖先, 在同一生物体中由同一基因复制而产生的多个蛋白质的基因.
本文探讨了ADM2/IMD可能与大鼠饮食性高脂血症和高脂血症性脂肪病理进程有关, 结构清楚, 立意新颖, 对进一步的基础和临床研究有参考价值.
编辑:程剑侠 电编:何基才
| 1. | Yu AS, Keeffe EB. Nonalcoholic fatty liver disease. Rev Gastroenterol Disord. 2002;2:11-19. [PubMed] |
| 3. | Zudaire E, Cuttitta F, Martinez A. Regulation of pancreatic physiology by adrenomedullin and its binding protein. Regul Pept. 2003;112:121-130. [PubMed] |
| 4. | Roh J, Chang CL, Bhalla A, Klein C, Hsu SY. Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activity-modifying protein receptor complexes. J Biol Chem. 2004;279:7264-7274. [PubMed] |
| 5. | Takei Y, Inoue K, Ogoshi M, Kawahara T, Bannai H, Miyano S. Identification of novel adrenomedullin in mammals: a potent cardiovascular and renal regulator. FEBS Lett. 2004;556:53-58. [PubMed] |
| 6. | Jia YX, Yang JH, Pan CS, Geng B, Zhang J, Xiao Y, Zhao J, Gerns H, Yang J, Chang JK. Intermedin1-53 protects the heart against isoproterenol-induced ischemic injury in rats. Eur J Pharmacol. 2006;549:117-123. [PubMed] |
| 7. | Fujisawa Y, Nagai Y, Miyatake A, Miura K, Nishiyama A, Kimura S, Abe Y. Effects of adrenomedullin 2 on regional hemodynamics in conscious rats. Eur J Pharmacol. 2007;558:128-132. [PubMed] |
| 8. | Hashimoto H, Hyodo S, Kawasaki M, Shibata M, Saito T, Suzuki H, Otsubo H, Yokoyama T, Fujihara H, Higuchi T. Adrenomedullin 2 (AM2)/intermedin is a more potent activator of hypothalamic oxytocin-secreting neurons than AM possibly through an unidentified receptor in rats. Peptides. 2007;28:1104-1112. [PubMed] |
| 9. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] |
| 11. | Beltowski J, Jamroz A. Adrenomedullin--what do we know 10 years since its discovery? Pol J Pharmacol. 2004;56:5-27. [PubMed] |
| 12. | Taylor MM, Bagley SL, Samson WK. Intermedin/adrenomedullin-2 acts within central nervous system to elevate blood pressure and inhibit food and water intake. Am J Physiol Regul Integr Comp Physiol. 2005;288:R919-927. [PubMed] |
| 13. | Lin Chang C, Roh J, Park JI, Klein C, Cushman N, Haberberger RV, Hsu SY. Intermedin functions as a pituitary paracrine factor regulating prolactin release. Mol Endocrinol. 2005;19:2824-2838. [PubMed] |
| 14. | Engelking LJ, Kuriyama H, Hammer RE, Horton JD, Brown MS, Goldstein JL, Liang G. Overexpression of Insig-1 in the livers of transgenic mice inhibits SREBP processing and reduces insulin-stimulated lipogenesis. J Clin Invest. 2004;113:1168-1175. [PubMed] |
| 15. | Matsuda M, Korn BS, Hammer RE, Moon YA, Komuro R, Horton JD, Goldstein JL, Brown MS, Shimomura I. SREBP cleavage-activating protein (SCAP) is required for increased lipid synthesis in liver induced by cholesterol deprivation and insulin elevation. Genes Dev. 2001;15:1206-1216. [PubMed] |
| 16. | Isumi Y, Kubo A, Katafuchi T, Kangawa K, Minamino N. Adrenomedullin suppresses interleukin-1beta-induced tumor necrosis factor-alpha production in Swiss 3T3 cells. FEBS Lett. 1999;463:110-114. [PubMed] |
| 17. | Wu R, Zhou M, Wang P. Adrenomedullin and adrenomedullin binding protein-1 downregulate TNF-alpha in macrophage cell line and rat Kupffer cells. Regul Pept. 2003;112:19-26. [PubMed] |