修回日期: 2007-04-01
接受日期: 2007-04-13
在线出版日期: 2007-07-18
目的: 研究胃癌组织中β-catenin和Tiam-1的表达及二者与胃癌分化程度及转移的关系.
方法: 收集胃癌40例及慢性浅表性胃炎(CSG)组织30例, 利用逆转录酶链式反应(RT-PCR)方法分别检测组织中β-catenin和Tiam-1 mRNA的表达情况.
结果: 在胃癌组织40例中24例有β-catenin mRNA表达(60.0%), β-catenin mRNA的表达与胃癌分化程度及淋巴结转移无关(P>0.05), 在CSG 30例中16例有β-catenin mRNA表达(53.3%), 2组比较, 差异无统计学意义(2 = 0.3111, P>0.05). 在胃癌组织40例中27例有Tiam-1 mRNA的表达(67.5%), 在CSG 30例中8例有Tiam-1 mRNA的表达(26.7%), 胃癌组织中Tiam-1的阳性率明显高于CSG组(2 = 11.4333, P<0.01), 低分化组及淋巴结转移阳性组Tiam-1的阳性率高于高分化组及淋巴结转移阴性组(85.0% vs 50.0%, 82.6% vs 47.1%, 均P<0.05).
结论: β-catenin mRNA表达与胃癌分化程度及转移无关, Tiam-1 mRNA表达与胃癌分化程度及淋巴结转移有关.
引文著录: 王轶淳, 黄玉红, 孙明军, 傅宝玉. 胃癌组织中β-catenin及Tiam-1 mRNA表达的意义. 世界华人消化杂志 2007; 15(20): 2268-2271
Revised: April 1, 2007
Accepted: April 13, 2007
Published online: July 18, 2007
AIM: To investigate the expression of β-catenin and T-cell lymphoma invasion and metastasis 1 (Tiam-1) mRNA in gastric carcinoma and its clinicopathological significance in the differentia-tion and metastasis of gastric carcinoma.
METHODS: mRNA expression of β-catenin and Tiam-1 was determined by reverse transcriptase- polymerase chain reaction in 40 patients with gastric carcinoma, and 30 cases of chronic superficial gastritis (CSG) selected as controls.
RESULTS: Positive expression of β-catenin mRNA was seen in gastric carcinoma (60.0%) and CSG tissue (53.3%), and there was no significant difference between the two groups. The expression of β-catenin mRNA had no correlation with differentiation of gastric carcinoma and metastasis. The rate of Tiam-1 expression in gastric carcinoma was 67.5%, and was markedly higher than that in CSG (26.7%). The expression of Tiam-1 in poorly differentiated gastric carcinoma or that with lymph node metastasis was higher than that in well-differentiated gastric carcinoma or that without lymph node metastasis (85.0% vs 50.0%, 82.6% vs 47.1%, both P < 0.05).
CONCLUSION: Expression of β-catenin mRNA has no correlation with differentiation of gastric carcinoma and metastasis. Expression of Tiam-1 is associated with differentiation and lymph node metastasis of gastric carcinoma. Tiam-1 may promote the invasion and metastasis of gastric carcinoma.
- Citation: Wang YC, Huang YH, Sun MJ, Fu BY. Clinicopathological significance of β-catenin and T-cell lymphoma invasion and metastasis 1 mRNA expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2268-2271
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2268.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2268
肿瘤细胞的侵袭、转移与其运动能力密不可分, 因细胞骨架结构的特性导致运动能力的不同, 是肿瘤细胞与正常细胞以及不同转移潜能肿瘤细胞间生物遗传素质差异的具体表现. 细胞骨架在维持细胞形态和运动的同时, 还可以整合内、外源信号, 参与细胞分泌、接触抑制、增殖和凋亡等多种生物活动[1]. Tiam-1(T-cell lymphoma invasion and metastasis 1)是一个细胞骨架调节因子, 而β-catenin基因编码的蛋白质是一种多功能蛋白质, 具有细胞黏附和信号转导功能. 我们探讨β-catenin与Tiam-1与胃癌的侵袭、转移的关系, 为临床胃癌转移的有效防治提供依据.
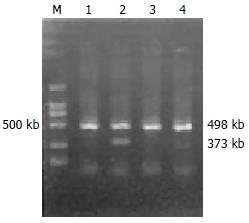
2003-2005年胃癌术后标本40例术前未行化放疗, 男28例, 女12例, 年龄26-72(平均55)岁, 高分化腺癌20例, 低分化腺癌20例. 内镜科活检CSG标本30例, 男22例, 女8例, 年龄25-68(平均46)岁. 所有的标本离体后半小时内取材, 剪成小块立即放入液氮, 并转入-80℃冰箱保存. TRIzol总RNA抽提纯化及RT-PCR试剂盒购自宝生物工程(大连)有限公司. β-catenin及Tiam-1的引物经GenBank检索, 利用Primer5.0软件设计, 引物购自北京三博远志生物技术有限公司. β-catenin引物序列为: 上游: 5'-GGG CGG CAC CTT CCT ACT TC-3', 下游: 5'-AGC TCC CTC GCG GTT CAT-3', 产物长度为128 bp, Tiam-1引物序列为: 上游: 5'-GTT TCG TTT CCG CTG TTA-3', R: 5'-TTT CTC CCT CTT GCC ATC-3', 产物长度为373 bp, β-actin引物序列为: 上游: 5'-GTG GGG CGC CCC AGG CAC CA-3', 下游: 5'-CTC CTT AAT GTC ACG CAC GAT TTC-3', 产物长度为498 bp.
采用RT-PCR法检测胃癌及CSG组织β-catenin和Tiam-1 mRNA的表达. 总RNA提取严格按照TRIzol总RNA抽提纯化试剂盒说明书进行. 冻存的胃癌及CSG组织在液氮中研成粉末, TRIzol匀浆后进行RNA提取, 所得RNA进行浓度、纯度及完整性的检测, RNA纯度: A260/A280 = 1.65-1.96. 逆转录cDNA: RNA 3 mL, 反应体系: 2×Buffer 15 mL, MgSO4 (25 mmol/L) 6 mL, AMV (22 MU/L) 1.5 mL, dNTPs (10 mmol/L) 1.5 mL, oligodT (50 mmol/L) 1.5 mL, RNase-inhibitor (40 MU/L) 0.75 mL, RNaseFreeH2O 0.75 mL, 按以下条件进行逆转录反应: 65℃ 1 min, 30℃ 5 min, 30 min内匀速升温, 65℃ 30 min, 98℃ 5 min, 5℃ 5 min. PCR反应体系: cDNA 3 mL, 2×Buffer 2.5 mL, MgSO4 (25 mmol/L) 6 mL, dNTPs (2.5 mmol/L) 2 mL, Taq酶(83.35 nkat/L) 0.2 mL, RNaseFreeH2O 17.1 mL, β-catenin及Tiam-1引物各0.1 mL(浓度5 mmol/L). β-catenin扩增按以下条件进行反应: 94℃预变性3 min, 94℃变性40 s, 57℃退火1 min, 72℃延伸1 min, 共35个循环, 最后72℃延长7 min. Tiam-1扩增按以下条件进行反应: 94℃预变性3 min, 94℃变性40 s, 53℃退火1 min, 72℃延伸1 min, 共35个循环, 最后72℃延长7 min. β-actin作为内参照. PCR产物加样于20 g/L琼脂糖凝胶中, 电泳后在紫外灯下观察电泳条带, 并进行光密度扫描及拍照.
统计学处理 应用SPSS12.0软件, 采用χ2检验进行统计学分析.
胃癌组织40例中, β-catenin阳性24例(60.0%), 其中, 高分化组阳性11例(55.0%), 低分化组阳性13例(65.0%), 两组比较, 差异无统计学意义(χ2 = 0.4167, P>0.05); 淋巴结转移阳性组b-catenin阳性14例(60.9%), 淋巴结转移阴性组β-catenin阳性10例(58.8%), 两组比较, 差异无统计学意义(χ2 = 0.0171, P>0.05). CSG 30例中, β-catenin阳性16例(53.3%), 胃癌组与CSG组比较, 差异无统计学意义(χ2 = 0.3111, P>0.05)(表1).
胃癌组织中40例, Tiam-1阳性27例(67.5%), 其中, 高分化组阳性10例(50.0%), 低分化组阳性17例(85.0%), 两组比较, 差异有统计学意义(χ2 = 5.5840, P<0.05); 淋巴结转移阳性组Tiam-1阳性19例(82.6%), 淋巴结转移阴性组Tiam-1阳性8例(47.1%), 两组比较, 差异有统计学意义(χ2 = 5.6313, P<0.05). CSG 30例中, Tiam-1阳性8例(26.7%), 胃癌组与CSG组比较, 差异有统计学意义(χ2 = 11.4333, P<0.01, 图1)(表1).
肿瘤转移是一个多步骤、多阶段、多途径、涉及多基因变化的一系列复杂过程, 包括肿瘤细胞从原发灶脱落, 侵入血管或淋巴管, 迁移、黏附于适宜部位, 诱导肿瘤血管形成, 对抗宿主抗肿瘤免疫, 最终在远处形成转移灶. β-catenin的基因CTNNB1位于第3号染色体短臂3p21, 含有4个外显子, 其突变多发生于外显子3上, β-catenin的异常表达在肿瘤发展中的效应可能不同. 对肝癌[2]和不同分期卵巢癌[3]中β-catenin的表达与预后的关系的研究就提出了相反的结论. 有研究指出, Wnt信号传导通路与G蛋白通路等其他通路之间有交互作用, 可以形成复杂的网络, 提示β-catenin的异常表达在肿瘤发展过程中有多重效应[4-7]. 本研究中, β-catenin mRNA在胃癌及CSG中均有表达, 而二者之间比较, 差异无统计学意义. 在胃癌低分化组及高分化组以及淋巴结转移阳性组及阴性组之间比较, 差异均无统计学意义. 提示β-catenin mRNA的表达与胃癌的分化程度及淋巴结转移无关.
Tiam-1基因是一种原癌基因, 在人的肝细胞、肾小管上皮细胞、支气管上皮细胞、心肌细胞中低度表达, 在平滑肌细胞中呈中度表达, 在其他正常组织中不表达. Tiam-1蛋白是鸟氨酸转换因子, 有多个比较重要的结构区域, 如参与GDP-GTP转换的Dbl同源(DH)功能区, 参与细胞质相互作用的pleckstrin同源(PH)功能区等, 这些功能区在肿瘤的侵袭、转移及信号传导方面具有重要的作用[8-9]. Tiam-1基因能够调节E-cadherin介导的细胞黏附, 并与Rho一起参与黏附复合物的组装. 细胞间黏附复合物中的任一结构发生变化时, 都会影响细胞间的正常连接, 从而使肿瘤细胞的黏附能力下降, 获得侵袭、转移的能力. Tiam-1作为Rho GEFs家族成员之一, 主要参与调节Rho类蛋白的活性, 连接细胞外信号与细胞骨架的通讯, 参与转录活化及细胞周期调控. Tiam-1可以活化GTP酶, 活化的GTP酶与整合素信号通路相互作用调节细胞的增殖, 还可以增加细胞周期蛋白D1的表达、抑制p21和p27的表达, 加速细胞周期的进展, 促进细胞的增殖[10]. 细胞间的黏附在肿瘤的转移过程中起非常重要的作用. 肿瘤细胞间的同质性黏附可以由E-cadherin等黏附分子介导, 抑制细胞侵袭、转移. 肿瘤细胞与宿主细胞或细胞外基质之间的异质性黏附可以由整合素、CD44等黏附分子介导, 促进细胞侵袭、转移. 在正常MDCK犬肾上皮细胞中, Tiam-1的低度表达可以增强E-cadherin介导的同质性黏附, 抑制肝细胞生长因子诱导的细胞离散, 并逆转Ras诱导的上皮细胞恶性转化和侵袭表型呈现[11]. 而对Tiam-1表达的乳腺癌SP-1细胞系的研究[12]发现, Tiam-1与细胞骨架蛋白锚蛋白形成复合体, 实现细胞骨架重塑, 促进乳腺癌细胞侵袭、转移. 有研究报道, 在人肾癌细胞株中Tiam-1通过促进E-cadherin介导的细胞间黏附而显著抑制细胞迁移[13]. 而对人肾癌细胞株中Tiam-1的表达水平与体外侵袭的研究发现, Tiam-1的表达水平与体外侵袭呈负相关[14]. 在一些肿瘤细胞中, 过量表达的Tiam-1通过三磷酸激醇激酶相关信号途径, 激活Rac1, 既可以诱使整合素a6β1迁移到肿瘤细胞周边特异的黏着部位, 促进异质性黏附, 又可以将整合素a6β1募集于细胞头部和伪足处, 传递调节信号至细胞骨架, 影响肌动蛋白微丝组配, 增强肿瘤细胞的运动和侵袭[15]. 利用生物信息学方法分析发现, Tiam-1与结直肠癌转移高度相关[16]. 本研究中, 胃癌组织Tiam-1 mRNA的阳性率明显高于CSG, 而且低分化组及淋巴结转移阳性组的阳性率高于高分化组及淋巴结转移阴性组, 提示在胃癌的恶性转化过程中, Tiam-1起促进作用. 由此推断, Tiam-1在胃癌中没有发挥增强E-cadherin介导的细胞黏附作用而抑制转移. 虽然Tiam-1能够与E-cadherin在膜连接处形成功能上的耦联, 但是β-catenin的异常表达[17]导致细胞间的Cadherin-catenin正常连接出现异常, 而Tiam-1的促进肿瘤细胞迁移以及参与基因表达调控和细胞增殖的作用尤显突出, 导致肿瘤细胞的恶性转化及侵袭、转移.
胃癌是发病率非常高的恶性肿瘤, 其侵袭和转移是一个复杂过程. Tiam-1是一个细胞骨架调节因子,而β-catenin基因编码的蛋白质具有细胞黏附和信号转导功能, 本文探讨了两者在胃癌组织中的表达.
本文通过对胃癌组织中β-catenin和Tiam-1表达的研究, 探讨其在胃癌的侵袭及转移中的相互作用, 以求为开发新的抗癌药物及寻求新的基因治疗的靶点提供新的思路.
本研究利用 RT-PCR方法分别检测胃癌组织中 b-cateni n和 Tiam-1的表达及二者与胃癌分化程度及转移的关系. 文章方法先进, 实验数据及统计方法合理可信, 得出的结果为胃癌的发生、侵袭、转移防治提供了实验依据, 有一定的学术价值.
编辑: 何燕 电编:张敏
| 1. | Pawlak G, Helfman DM. Cytoskeletal changes in cell transformation and tumorigenesis. Curr Opin Genet Dev. 2001;11:41-47. [PubMed] |
| 2. | Nhieu JT, Renard CA, Wei Y, Cherqui D, Zafrani ES, Buendia MA. Nuclear accumulation of mutated beta-catenin in hepatocellular carcinoma is associated with increased cell proliferation. Am J Pathol. 1999;155:703-710. [PubMed] |
| 3. | Gamallo C, Palacios J, Moreno G, Calvo de Mora J, Suarez A, Armas A. beta-catenin expression pattern in stage I and II ovarian carcinomas: relationship with beta-catenin gene mutations, clinicopathological features, and clinical outcome. Am J Pathol. 1999;155:527-536. [PubMed] |
| 4. | Gleason JE, Korswagen HC, Eisenmann DM. Activa-tion of Wnt signaling bypasses the requirement for RTK/Ras signaling during C. elegans vulval induction. Genes Dev. 2002;16:1281-1290. [PubMed] |
| 5. | Tsukashita S, Kushima R, Bamba M, Nakamura E, Mukaisho K, Sugihara H, Hattori T. Beta-catenin expression in intramucosal neoplastic lesions of the stomach. Comparative analysis of adenoma/dysplasia, adenocarcinoma and signet-ring cell carcinoma. Oncology. 2003;64:251-258. [PubMed] |
| 6. | Li YJ, Ji XR. Relationship between expression of E-cadherin-catenin complex and clinicopathologic characteristics of pancreatic cancer. World J Gastroenterol. 2003;9:368-372. [PubMed] |
| 7. | Qiang YW, Endo Y, Rubin JS, Rudikoff S. Wnt signaling in B-cell neoplasia. Oncogene. 2003;22:1536-1545. [PubMed] |
| 8. | Habets GG, van der Kammen RA, Stam JC, Michiels F, Collard JG. Sequence of the human invasion-inducing TIAM1 gene, its conservation in evolution and its expression in tumor cell lines of different tissue origin. Oncogene. 1995;10:1371-1376. [PubMed] |
| 9. | Michiels F, Collard JG. Rho-like GTPases: their role in cell adhesion and invasion. Biochem Soc Symp. 1999;65:125-146. [PubMed] |
| 10. | Welsh CF. Rho GTPases as key transducers of proliferative signals in g1 cell cycle regulation. Breast Cancer Res Treat. 2004;84:33-42. [PubMed] |
| 11. | Hordijk PL, ten Klooster JP, van der Kammen RA, Michiels F, Oomen LC, Collard JG. Inhibition of invasion of epithelial cells by Tiam1-Rac signaling. Science. 1997;278:1464-1466. [PubMed] |
| 12. | Bourguignon LY, Zhu H, Shao L, Chen YW. Ankyrin-Tiam1 interaction promotes Rac1 signaling and metastatic breast tumor cell invasion and migration. J Cell Biol. 2000;150:177-191. [PubMed] |
| 13. | Engers R, Springer E, Michiels F, Collard JG, Gabbert HE. Rac affects invasion of human renal cell carcinomas by up-regulating tissue inhibitor of metalloproteinases (TIMP)-1 and TIMP-2 expression. J Biol Chem. 2001;276:41889-41897. [PubMed] |
| 14. | Engers R, Zwaka TP, Gohr L, Weber A, Gerharz CD, Gabbert HE. Tiam1 mutations in human renal-cell carcinomas. Int J Cancer. 2000;88:369-376. [PubMed] |