修回日期: 2007-04-01
接受日期: 2007-04-28
在线出版日期: 2007-07-18
目的: 探讨射频消融对大鼠肝肿瘤血管内皮生长因子(VEGF)及其受体Flk-1(fetal liver kinase 1)表达的影响.
方法: 采用Walker-256细胞株构建大鼠肝脏种植瘤模型, 肿瘤接种后9-10 d开腹, 分为对照组与射频组. 治疗后射频组再随机平均分为2组, 分别于1, 3 d处死大鼠取肝脏标本. 采用Elivision法对标本免疫组化染色, 根据VEGF与Flk-1在胞质内染色强度与阳性细胞数, 对不同分组的肿瘤组织、癌旁组织进行半定量评分.
结果: 射频后1, 3 d组癌旁和残留组织VEGF表达与治疗前癌旁(P = 0.014, P = 0.013)和肿瘤组织相比(P = 0.015, P = 0.013), 有统计学差异, 癌旁组织VEGF表达高于治疗前, 而残留组织低于治疗前. 射频后1 d Flk-1表达与治疗前癌旁组织相比有统计学差异(P = 0.008), 较治疗前增加.
结论: 射频对残余肿瘤细胞VEGF表达有抑制作用, 但可促进癌旁组织的VEGF表达上调. 射频对Flk-1的影响有待进一步研究.
引文著录: 孔文韬, 陈骏, 仇毓东, 张炜炜. 射频消融对鼠肝肿瘤血管内皮生长因子及其受体Flk-1表达的影响. 世界华人消化杂志 2007; 15(20): 2255-2259
Revised: April 1, 2007
Accepted: April 28, 2007
Published online: July 18, 2007
AIM: To study the influence of radiofrequency ablation (RFA) on vascular endothelial growth factor (VEGF) and fetal liver kinase 1 (Flk-1) in a rat transplanted liver cancer model.
METHODS: A rat liver cancer model was established by injecting Walker carcinosarcoma 256 tumor cells into the livers of the rats. After tumor growth had proceeded for about 9 or 10 days, we surgically treated the rats with RFA. Rats were randomly divided into control and RFA groups. After treatment, rats were randomly divided into two groups, and were killed after 1 or 3 days to obtain liver specimens. Expression of VEGF and Flk-1 was observed in the tumor and adjacent tissues by an immunohistochemical Elivision method at 1 and 3 days after RFA.
RESULTS: The expression of VEGF in adjacent tissues was higher (P = 0.014, and P = 0.013) and the expression of VEGF in remnant tumors was lower at 1 and 3 days after RFA than that before RFA (P = 0.015, P = 0.013). The expression of Flk-1 1 day after RFA in the adjacent tissues was higher than that in controls (P = 0.008).
CONCLUSION: RFA can repress the expression of VEGF in carcinoma near areas of necrosis, but this treatment may also induce expression of VEGF in adjacent tissues. The effect of RFA on Flk-1 needs further investigation.
- Citation: Kong WT, Chen J, Qiu YD, Zhang WW. Influence of radiofrequency ablation on vascular endothelial growth factor and fetal liver kinase 1 in transplanted liver cancer in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2255-2259
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2255.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2255
肝细胞性肝癌是富血供肿瘤, 血管新生对肿瘤的发生与进展有着重要的作用. 射频后疗效在一定程度上取决于血管新生的变化情况. VEGF是目前被认为参与血管新生过程中最重要的调节因子, 通过特异性与其受体Flk-1结合, 促进血管新生起始[1-3]. 我们在构建的大鼠肝脏种植瘤射频模型基础上, 通过免疫组化染色, 观测癌旁组织与残余肿瘤组织内VEGF和Flk-1表达情况, 初步探讨射频治疗对局部血管新生的影响.
清洁级♂SD大鼠40只, 体质量250±50 g, 南京军区总医院动物实验中心提供; Walker256细胞株, 中国医学科学院肿瘤医院肿瘤所提供; 冷循环射频治疗仪(Cool-tip RF system, CC-1-B型), 美国Radionics公司制造; VEGF与Flk-1 Ab均购自Santa Cruz公司. 采用直接注射法制作大鼠肝脏种植瘤模型[4], 接种肿瘤后9-10 d开腹, 将肿瘤大小接近的大鼠随机分为对照组与射频组, 对照组不做任何治疗, 取肝脏标本. 射频组在直视下将射频针插入肿瘤中心部位, 手动调节功率为10 w, 时间设定5 min, 可形成约1 cm左右的毁损灶[5]. 治疗后随机平均分为2组, 分别于术后1, 3 d处死取肝脏标本. 取出肝脏后常规中性甲醛固定, 石蜡切片4 µm, HE染色, 光镜下形态学观察.
石蜡切片于二甲苯中脱腊, 梯度酒精至水; 30 mL/L H2O2室温孵育10 min, 以消除内源性过氧化物酶的活性; 100 mL/L山羊血清封闭, 室温孵育15 min; 滴加适当比例稀释(1:100)的VEGF与Flk-1的抗体, 4℃过夜; 滴加二抗, 37℃孵育20 min; DAB显色, 显微镜下观察, 控制反应时间; 自来水充分冲洗, 苏木素衬染, 脱水, 封片. 以上步骤间均用PBS冲洗3次, 每次1 min. 每张切片在镜下对肿瘤组织(包括对照组与射频后残存肿瘤细胞), 癌旁组织(邻近肿瘤细胞或毁损灶周边1 cm的正常肝组织)进行免疫组化评分, 在细胞质中出现棕黄色或褐色颗粒为阳性细胞. VEGF与Flk-1的表达根据染色强度与阳性细胞数分为4级: 阴性(-): 无阳性细胞; 弱阳性(+): 细胞轻度着色染成淡黄色, 阳性细胞数<25%; 阳性(++): 细胞着色成黄色, 阳性细胞数25%-50%; 强阳性(+++): 细胞明显着色, 呈棕黄色, 阳性细胞数>50%.
统计学处理 采用SPSS11.5统计学软件进行分析, VEGF与Flk-1的表达差异采用秩和检验, P<0.05具有统计学意义.
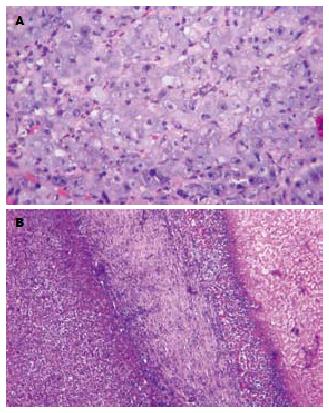
对照组肿瘤细胞呈巢状、片状分布, 排列紧密, 杂乱. 细胞形态不规则, 胞质轻度嗜碱性, 核大深染, 核仁明显(图1A). 治疗后镜下呈现3个区带(图1B), 原肿瘤区域经射频后变为大片坏死组织, 表现为凝固性坏死. 周边可见界限清晰的炎性反应带, 其中可见中性粒细胞、淋巴细胞以及成纤维细胞聚集. 炎症细胞的外围可见一层明显肉芽组织, 其内有多量新生的毛细血管. 毁损灶周围的肝组织结构正常, 但肝细胞可发生变性, 以水肿, 胞质疏松化常见. 在治疗不充分的标本中毁损区周边或内部可见残留的肿瘤细胞.
| 分组 | n | VEGF表达情况分级 | Flk-1表达情况分级 | ||||||
| - | + | ++ | +++ | - | + | ++ | +++ | ||
| 对照组(A组) | |||||||||
| 肿瘤组织 | 12 | 0 | 5 | 6 | 1 | 1 | 5 | 6 | 0 |
| 癌旁组织 | 12 | 0 | 5 | 4 | 3 | 1 | 4 | 7 | 0 |
| 射频后1 d(B组) | |||||||||
| 残存肿瘤组织 | 9 | 2 | 6 | 1 | 0 | 1 | 3 | 5 | 0 |
| 癌旁组织 | 12 | 0 | 1 | 2 | 9 | 0 | 0 | 10 | 2 |
| 射频后3 d(C组) | |||||||||
| 残存肿瘤组织 | 4 | 2 | 2 | 0 | 0 | 1 | 0 | 3 | 0 |
| 癌旁组织 | 12 | 0 | 1 | 5 | 6 | 0 | 5 | 5 | 2 |
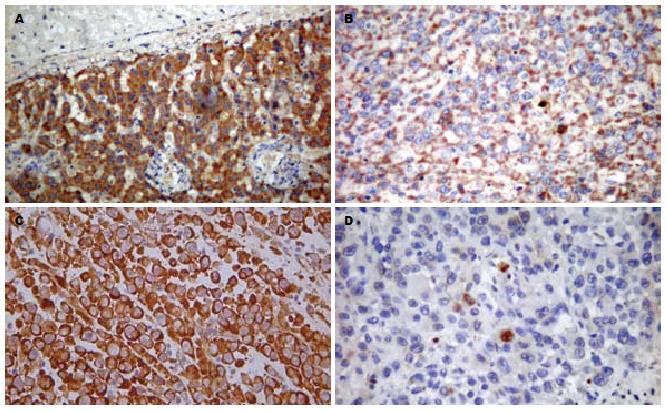
射频后1 d组癌旁组织内VEGF表达弱阳性(+)1例, 阳性(++)2例, 强阳性(+++)9例, Flk-1表达阳性(++)10例, 强阳性(+++)2例, 与治疗前癌旁组织相比, 两者的表达有统计学差异(P值分别为0.014, 0.008). 射频后1 d癌旁组织VEGF及其受体Flk-1的表达高于对照组(图2A-B). 射频后3 d组癌旁组织内VEGF表达弱阳性(+)1例, 阳性(++)5例, 强阳性(+++)6例, 与治疗前癌旁组织相比有统计学差异(P = 0.013); Flk-1表达弱阳性(+)5例, 阳性(++)5例, 强阳性(+++)2例, 与治疗前癌旁组织相比, 表达无统计学差异(P = 0.545).
镜下观察, 射频后1 d组有9张存在残余肿瘤细胞(75%), VEGF的表达阴性(-)2例, 弱阳性(+)6例, 阳性(++)1例; 3 d组有4张存在残余肿瘤细胞(33%), VEGF的表达阴性(-)2例, 弱阳性(+)2例. 与治疗前肿瘤组织相比, 两者的表达有统计学差异(P值分别为0.015, 0.013). 射频后残存肿瘤细胞的VEGF表达低于对照组(图2C-D). 射频后1 d组残存肿瘤组织Flk-1的表达阴性(-)1例, 弱阳性(+)3例, 阳性(++)5例; 3 d组Flk-1表达阴性(-)1例, 阳性(++)3例, 与治疗前肿瘤组织相比, 表达无统计学差异(P值分别为0.874, 0.634).
肿瘤的生长与转移依赖于血管新生, 根据血管新生平衡开关学说[6-7], 在肿瘤生长的过程中, 肿瘤中心缺氧, 导致缺氧诱导因子的表达, 从而改变了血管新生促进因子与抑制因子的平衡, 使其向促进血管新生方向发展. VEGF是其中一种重要的血管新生促进因子[8]. VEGF由肿瘤细胞产生并分泌, 作用于表达其受体的内皮细胞, 具有增加微血管通透性、促进不同来源的内皮细胞分裂增殖和血管构建、促使内皮细胞迁移等多种作用, 在肿瘤的生长、发展和转移过程中起重要作用[9]. VEGF主要通过两种细胞表面的酪氨酸激酶受体起作用, 也就是Flt-1 (VEGFR-1)与KDR/Flk-1(调节血管新生主要是通过Flk-1). 这些受体, 尤其是Flk-1在肿瘤血管的内皮细胞上都有表达. VEGF与相应受体结合后, 发生二聚作用并激活酪氨酸激酶, 然后受体发生自身磷酸化, 在该部位结合并激活其下游的配体诱导一系列信号转导机制, 从而发挥生物学效应.
射频作为肝癌的一种局部灭活治疗技术, 术后肿瘤的血管新生情况与预后有着重要的关联. 射频治疗肿瘤的基本机制是利用肿瘤的不耐热性, 但对于肿瘤微血管亦有影响. 有文献表明, 射频可以通过有效的破坏肿瘤微血管, 抑制血管新生, 减少肿瘤的血液供应, 从而降低术后转移复发的几率[10]. 但目前尚无射频后癌旁血管新生情况的相关研究报道. 在我们的实验中构建了大鼠肝脏种植瘤的射频治疗模型, 采用Walker256瘤株构建的肝脏种植瘤是一种较好的肝癌研究模型, 该肿瘤生长迅速, 属富血供肿瘤. 可以近似模拟肝癌的血供特点, 有研究发现, 该肿瘤在生长过程中具有诱导新生血管的能力[11], 适宜于进行有关血管新生方面的研究.
本研究结果显示, 射频后1 d组有75%存在残余肿瘤细胞, 3 d组有33%存在残存肿瘤细胞. 通过对残存肿瘤细胞VEGF表达的统计学分析, 显示其表达明显低于对照组. 小动物模型中, 射频时对毁损范围不易把握是导致肿瘤残留的主要原因. 而残留肿瘤细胞中VEGF的表达明显下调, 其机制考虑是热效应导致肿瘤细胞坏死或失活, 或蛋白的变性与分解. 也可能是大量坏死组织诱导炎症免疫反应, 从而间接抑制了肿瘤VEGF的表达[12]. 射频术后的肿瘤残余一直是影响治疗效果的重要因素, 尤其对于较大体积的肝癌或多发肝癌在所难免[13-14]. 因此, 残余肿瘤细胞的生物学特性变化值得进一步研究与探讨. 我们的研究显示对于坏死区内或邻近坏死区的残余肿瘤细胞, 射频对VEGF的表达有一定抑制作用.
与上述现象相反的是, 射频术后癌旁组织VEGF与Flk-1的表达均显著高于对照组. 通过光镜观察, 我们发现在坏死灶周围存在炎症反应带, 可见多量毛细血管和炎症细胞聚集. 血管新生的原因可能有2个: (1)射频术后的坏死与肿瘤自发性坏死不同. 后者主要见于病灶中心, 炎症反应不明显. 而射频后坏死灶周边可出现炎症反应带. 炎症细胞可以释放促血管新生因子, 因而VEGF等可以是炎症细胞释放的; (2)射频后组织坏死, 局部乏氧, 产生缺氧诱导因子(hypoxia-inducible factor 1, HIF-1)[15], 可能对血管新生产生正向促进作用, 从而使VEGF表达上调.
总之, 射频对于邻近毁损灶的残余肿瘤细胞的VEGF表达有抑制作用. 而射频后癌旁组织的VEGF与Flk-1表达有上调现象. 癌旁新生血管是否对残留肿瘤组织的生长有促进作用, 有待进一步研究.
射频消融是肝癌的一种重要治疗手段, 该技术具有创伤性小, 可重复性强的优点, 在临床上应用日益广泛. 由于肝细胞性肝癌是富血供肿瘤, 血管新生对肿瘤的发生与进展有着重要的作用, 因而, 射频后疗效在很大程度上取决于术后血管新生的变化情况.
射频作为肝癌的一种局部灭活治疗技术, 术后肿瘤的血管新生情况与预后有着重要的关联. 射频治疗肿瘤的基本机制是利用肿瘤的不耐热性, 但对于肿瘤微血管亦有影响. 有文献表明, 射频可以通过有效的破坏肿瘤微血管, 抑制血管新生, 减少肿瘤的血液供应, 从而降低术后转移复发的几率. 但目前尚无射频后癌旁血管新生情况的相关研究报道.
血管内皮生长因子 (VEGF ) 是目前被认为参与血管新生过程中最重要的调节因子, 在肿瘤的生长、发展和转移过程中起重要作用, VEGF由肿瘤细胞产生并分泌, 通过特异性与其受体Flk-1结合, 促进血管新生起始. 本研究在构建的大 鼠肝脏种植瘤射频模型基础上, 通过免疫组化方法, 观测癌旁组织与残余肿瘤组织内VEGF和Flk-1表达情况, 初步探讨射频治疗对局部血管新生的影响.
射频消融后, 邻近毁损灶的残存肿瘤细胞由于热效应的影响, 以及炎症免疫反应等因素, 肿瘤细胞的 VEGF表达受到抑制. 但射频对癌旁组织的VEGF表达有一定促进作用, 提示射频消融后的乏氧区对肿瘤的血管新生有一定的促进作用, 这可能是射频消融术后肿瘤局部复发的机制之一. 文章的研究结果有助于深入理解射频治疗的机制, 进一步改进治疗策略, 从而降低射频术后转移复发的几率.
本文通过研究射频消融对鼠肝肿瘤血管内皮生长因子及其受体Flk-1表达的影响,得出了一些有意义的结果, 选题具有一定先进性, 文字流畅, 研究方案较合理, 有一定的参考价值.
编辑: 程剑侠 电编:张敏
| 1. | Sun HC, Tang ZY. Angiogenesis in hepatocellular carcinoma: the retrospectives and perspectives. J Cancer Res Clin Oncol. 2004;130:307-319. [PubMed] |
| 2. | Tanaka S, Arii S. Current status and perspective of antiangiogenic therapy for cancer: hepatocellular carcinoma. Int J Clin Oncol. 2006;11:82-89. [PubMed] |
| 3. | Zacharoulis D, Hatzitheofilou C, Athanasiou E, Zacharoulis S. Antiangiogenic strategies in hepatocellular carcinoma: current status. Expert Rev Anticancer Ther. 2005;5:645-656. [PubMed] |
| 6. | Sugimachi K, Tanaka S, Terashi T, Taguchi K, Rikimaru T, Sugimachi K. The mechanisms of angiogenesis in hepatocellular carcinoma: angiogenic switch during tumor progression. Surgery. 2002;131:S135-141. [PubMed] |
| 7. | Tanaka S, Sugimachi K, Yamashita Y, Shirabe K, Shimada M, Wands JR, Sugimachi K. Angiogenic switch as a molecular target of malignant tumors. J Gastroenterol. 2003;38 Suppl 15:93-97. [PubMed] |
| 8. | Semela D, Dufour JF. Angiogenesis and hepatocellular carcinoma. J Hepatol. 2004;41:864-880. [PubMed] |
| 9. | Ribatti D, Vacca A, Nico B, Sansonno D, Dammacco F. Angiogenesis and anti-angiogenesis in hepatocellular carcinoma. Cancer Treat Rev. 2006;32:437-444. [PubMed] |
| 12. | 张 盟辉, 孔 宪炳, 王 巧玲, 阴 红卫, 轩 诗进. 射频消融联合亚砷酸局部治疗对兔肝VX2肿瘤MVD和VEGF表达的影响. 中国普外基础与临床杂志. 2007;14:19-22. |
| 13. | Sakr AA, Saleh AA, Moeaty AA, Moeaty AA. The combined effect of radiofrequency and ethanol ablation in the management of large hepatocellular carcinoma. Eur J Radiol. 2005;54:418-425. [PubMed] |
| 14. | Kim YS, Rhim H, Cho OK, Koh BH, Kim Y. Intrahepatic recurrence after percutaneous radiofrequency ablation of hepatocellular carcinoma: analysis of the pattern and risk factors. Eur J Radiol. 2006;59:432-441. [PubMed] |
| 15. | Myung SJ, Yoon JH. Hypoxia in hepatocellular carcinoma. Korean J Hepatol. 2007;13:9-19. [PubMed] |