修回日期: 2007-05-01
接受日期: 2007-05-11
在线出版日期: 2007-07-18
目的: 探讨新疆哈萨克族人群TNF-α-308G/A基因多态性的分布与食管鳞状细胞癌(ESCC)的相关性.
方法: 应用聚合酶链式反应-限制性片段长度多态性PCR-RFL方法检测212例ESCC石蜡包埋组织及200名正常对照血样标本的TNF-α-308G/A多态性分布情况, 并检验基因型的分布.
结果: TNF-α-308G/A 3种基因型为: G/G, A/G, A/A. 在新疆哈萨克族ESCC组所占比例分别为70.8%, 26.9%, 2.4%, 对照组分别为70.0%, 29.0%, 1.0%, 两组中3种基因型总构成比差异无统计学意义(χ2 = 1.228, P>0.05); TNF-α-308G/A 3种基因型在食管癌不同病理分级中所占的比例分别为: 高分化43.3%, 24.5%, 0; 中分化46.3%, 60.4%, 60.0%; 低分化10.4%, 15.1%, 40.0%; 在无淋巴结转移分布分别为64.7%, 49.1%, 20.0%; 有转移为35.3%, 50.9%, 80.0%; 3种基因型在食管癌不同病理分级中的分布和淋巴结转移中差异均有统计学意义(χ2 = 10.630, P = 0.019; χ2 = 7.203, P = 0.025). G/A型和A/A型的食管癌患者分别较G/G基因型癌趋于中低分化、易转移(OR = 2.642; OR = 2.083).
结论: TNF-α-308G/A基因多态性与新疆哈萨克族ESCC的发生无关, 与其病理组织分级和淋巴结转移相关.
引文著录: 张海洋, 张会敏, 陈玲, 杨兰, 李洪安, 蒋金芳, 秦江梅, 杨磊, 张国昌, 李锋. 新疆哈萨克族食管鳞癌与TNF-α基因多态性的相关性. 世界华人消化杂志 2007; 15(20): 2236-2241
Revised: May 1, 2007
Accepted: May 11, 2007
Published online: July 18, 2007
AIM: To investigate the polymorphisms of tumor necrosis factor-α-308G/A (TNF-α-308G/A) and its association with susceptibility to Kazakh esophageal squamous cell carcinoma (ESCC) in Xinjiang.
METHODS: TNF-α-308G/A genotypes were analyzed by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) in 212 paraffin-embedded tissues from Kazakh patients with ESCC and 200 blood samples from a population of cancer-free controls resident in the same area. The concordance of TNF-α-308G/A genotypes with Hardy-Weinberg equilibrium was checked.
RESULTS: The genotypes of TNF-α-308G/A were G/G, A/G and A/A. The frequencies of these TNF-α-308G/A genotypes were 70.8, 26.9 and 2.4%, respectively, in Kazakh ESCC and 70, 29 and 1%, respectively in controls. There were no significant differences among them (χ2 = 1.228, P > 0.05). The frequencies of G/G, A/G and A/A were 43.3, 24.5 and 0% in well-differentiated esophageal carcinoma (EC), 46.3, 60.4 and 60.0% in moderately differentiated EC, and 10.4, 15.1 and 40.0% in poorly differentiated EC, respectively. The genotype distribution of TNF-α-308G/A was significantly different between the different ESCC pathological grading (χ2 = 10.630, P = 0.019). The frequencies of G/G, A/G and A/A were 35.3, 50.9 and 80.0%, respectively, in Kazakh ESCC with metastatic lymphadenopathy, and 64.7, 49.1 and 20.0%, respectively, in those with no metastatic lymphadenopathy. Statistically significant differences were also revealed between the TNF-α-308G/A genotype and ESCC metastatic lymphadenopathy (χ2 = 7.203, P = 0.025). G/A and A/A genotype ESCC tended to be moderately and poorly differentiated and have metastatic lymphadenopathy, in contrast with the G/G genotype (OR = 2.642; OR = 2.083).
CONCLUSION: The TNF-α-308G/A polymorphism might not be correlated with susceptibility to Kazakh ESCC in Xinjiang, but may be associated with a different ESCC pathology grading and lymph node metastasis.
- Citation: Zhang HY, Zhang HM, Chen L, Yang L, Li HA, Jiang JF, Qin JM, Yang L, Zhang GC, Li F. Relationship between polymorphisms of tumor necrosis factor-alpha and Kazakh esophageal squamous cell cancer in Xinjiang. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2236-2241
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2236.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2236
肿瘤坏死因子是体内一种促炎细胞因子, 具有广泛的生物学活性. 人TNF基因位于第6号染色体短臂MHC Ⅲ类基因区一段长7 kb的DNA序列内, 由TNFA和TNFB组成, 分别编码TNF-α和TNF-β, 各自都含4个外显子和3个内含子. 有研究证实, TNF-α基因启动子区域-308位点(转录起始位点上游第308 bp)存在单核苷酸多态性(single nucleotide polymorphisms, SNPs), 这种基因多态性的存在可能影响TNF基因转录和表达, 进而影响TNF的生物学功能[1]. 我国人口众多, 民族各异, TNF-α基因的分布肯定有不同, 新疆北部哈萨克族聚集区是我国食管癌高发区之一[2], 食管癌的死亡率居哈萨克族恶性肿瘤死亡的首位[3]. TNF-α-308基因的多态性与妇女宫颈癌有关[4], 鉴于宫颈癌与食管癌组织学的相似性, 我们对412例新疆哈萨克族TNF-α-308G/A基因的多态性进行了检测如下.
1980/2005年病理诊断为食管癌的哈萨克族活检石蜡包埋组织212例, 所有标本用40 g/L甲醛固定、石蜡包埋后保存. 男115例, 女97例, 同时在当地收集相同年龄组无肿瘤史的一般人群血样200例作为对照, 男109例, 女91例, 对照组人群抽集静脉血、肝素钠抗凝、液氮保存. 采用上海生工的小剂量DNA抽提试剂盒提取基因组DNA.
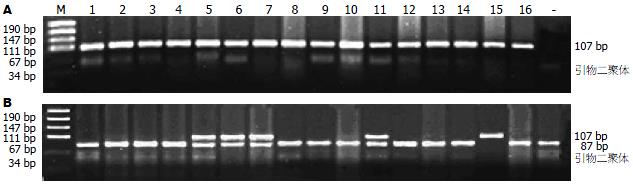
石蜡包埋组织5 μm厚蜡片l0张, 放入2.0 mL消毒的EP管中, 经脱蜡水化后, 加细胞裂解液(0.02 mmol/L Tris HCl, 0.02 mmoL/L EDTA, 20 g/L SDS), 蛋白酶K(终浓度为0.3 g/L)55℃水浴振荡过夜. 待组织完全裂解后依次加入等体积的Tris饱和酚(pH8.0), 酚/氯仿为1:1, 氯仿/异戊醇为24:1, 各抽提1次, 无水乙醇沉淀DNA, 干燥, 加入TE(pH8.0)50-80 μL溶解DNA沉淀12-24 h, 测定所提取DNA的A260、A280的值, 并计算A260/A280以确定DNA的质量和纯度, 提取的DNA置于-20℃冰箱保存备用. 特异扩增基因TNF-α多态性引物参照文献[4], 上游: 5'-AGGCAATAGGTTTTGAGGGCCAT-3', 下游: 5'-TCCTCCCTGCTCTGATTCCG-3', 由上海生工生物工程有限公司合成. 扩增的目的片段长度为107 bp. 限制性核酸内切酶NcoⅠ购自上海生工生物工程有限公司. 限制性核酸内切酶NcoⅠ特异识别CCATGG酶切位点, 对于TNF-α-308G/A单核苷酸多态性, G/G纯合基因型存在NcoⅠ的酶切位点产生87 bp和20 bp 2条DNA片段, A/A纯合基因型由于缺乏NcoⅠ的酶切位点从而表现为原始PCR后的107 bp DNA片段, G/A杂合型则表现为107 bp、87 bp和20 bp 3条片段. 采用PCR-RFLP方法检测TNF-α-308G/A基因型. PCR反应体系为25 μL, 10×Buffer 2.5 μL, 25 mmol/L MgCl2 1.5 μL, 10 mmol/L dNTP 0.5 μL, 20 pmol/L 上、下游引物各 0.6 μL, 5×103 kU/mL Taq DNA聚合酶0.3 μL, 模板DNA 2.0 μL(约20 ng DNA)及17.0 μL高压双蒸水. 扩增条件为: 94℃预变性5 min, 然后进行35个循环(每个循环包括: 94℃ 1 min, 58℃ 1 min, 72℃ 1 min), 最后72℃延伸10 min. 选用PCR扩增产物测序确定是TNF-α基因的食管癌标本作为阳性对照, 以高压双蒸水代替DNA模板作为空白对照. 取PCR产物10 μL, 酶切Bufer 2.5 μL, 限制性内切酶NcoⅠ5 U, 补高压双蒸水至20 μL, 置于37℃水浴8 h酶切消化, 取酶切产物5 μL, 30 g/L琼脂糖凝胶电泳、Bio-Rad凝胶成像图像分析仪观察结果. PCR产物由上海基康生物技术公司纯化并测序.
统计学处理 采用SPSS13.0统计软件对相关数据行χ2检验.
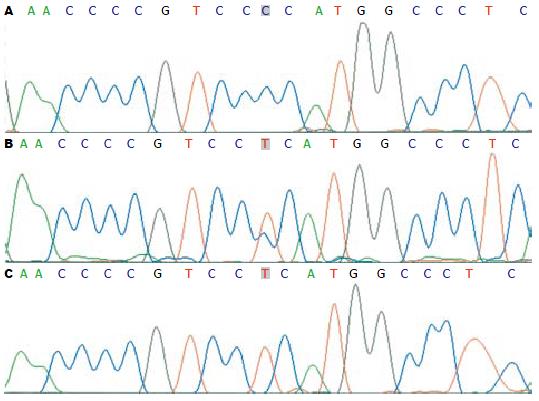
食管癌中TNF-α-308G/A基因型扩增后酶切, 产生107 bp, 87 bp和20 bp 3条片段的是G/A杂合型; 产生87 bp和20 bp 2条带的是G/G纯合型; 只产生107 bp 1条片段的是A/A纯合型(图1). 根据PCR扩增产物测序图上多态位点上的峰来判断基因型, 单峰为纯合基因型, 双峰为杂合基因型(图2). 在哈萨克族食管癌组TNF-α-308G/A基因型G/G, A/G, A/A所占比例分别为70.8%, 26.9%, 2.4%, 对照组分别是70.0%, 29.0%, 1.0%, 比较两组中3种基因型总构成比, 差异无统计意义(χ2 = 1.228, P = 0.581, 表1, 表3). 但在比较食管癌不同病理分级和淋巴结转移情况与TNF-α-308G/A基因型的分布时, 差异有统计学意义(χ2 = 10.630, χ2 = 7.203, P<0.05, 表2), G/A和A/A基因型食管癌较之G/G基因型癌趋向于中低分化并易发生癌淋巴转移(OR = 2.642, 95% CI = 1.305-5.349; OR = 2.083, 95% CI = 1.142-3.798, 表2). 随机挑选TNF-α-308G/A不同基因型的PCR产物测序, 测序结果, 与GenBank中公布的人类TNF基因(序列号: AB210166)同源性高达100%(图2). 对照组及ESCC患者的基因型分布均符合Hardy-Weinberg平衡(P>0.05).
| 分组 | n | 基因型 | ||
| G/G | G/A | A/A | ||
| 病例组 | 212 | 150(70.8) | 57(26.9) | 5(2.4) |
| 对照组 | 200 | 140(70.0) | 58(29.0) | 2(1.0) |
| 基因型 | 病理分级 | 淋巴结转移情况 | |||||
| n | 高分化 | 中分化 | 低分化 | n | 无转移 | 有转移 | |
| G/G | 134 | 58(43.3) | 62(46.3) | 14(10.4) | 150 | 97(64.7) | 53(35.3) |
| G/A | 53 | 13(24.5) | 32(60.4) | 8(15.1) | 57 | 28(49.1) | 29(50.9) |
| A/A | 5 | 0(0) | 3(60.0) | 2(40.0) | 5 | 1(20.0) | 4(80.0) |
| G/G | 134 | 58(43.3) | 76(56.7) | 150 | 97(64.7) | 53(35.3) | |
| G/A+A/A | 58 | 13(22.4) | 45(77.6) | 62 | 29(46.8) | 33(53.2) | |
| 合计 | 192 | 71 | 97 | 24 | 212 | 126 | 86 |
| 基因型 | 新疆哈萨克族 | 河北汉族 | ||
| 食管癌 | 对照 | 食管癌 | 对照 | |
| G/G | 150(70.8) | 140(70.0) | 266(91.4) | 391(89.5) |
| G/A | 57(26.9) | 58(29.0) | 21(7.2) | 40(9.1) |
| A/A | 5(2.4) | 2(1.0) | 4(1.4) | 6(1.4) |
近年来, 肿瘤坏死因子的抗肿瘤作用备受人们的关注. 他是一类具有多种生物学活性的非种属特异性的细胞因子, 在体内具有抗肿瘤、抗病毒和增强免疫的作用. 与肿瘤相关的一些基因可通过天然的遗传变异, 调节转录和翻译, 从而影响个体对肿瘤的易感性. TNF基因的功能性单核苷酸多态性与某些肿瘤的易感性有关. 有研究显示, TNF-α-308A等位基因可影响转录抑制因子(activator protein 2, AP-2)的结合而导致TNF-α表达增高[5-6]. 携带TNF-α-308A等位基因的个体有增加宫颈癌[4]、乳腺癌[7]和胃癌[8]的患病风险, 但是在对口腔鳞癌[9]、膀胱癌[10]和多发性骨髓瘤[11]的研究中却得出了不同甚至相反的结论. 且同样是研究宫颈癌的南非学者Govan et al[12]认为TNF-α-308G/A基因型与宫颈癌的发病无关. 造成研究结论不一致的原因可能是: (1)肿瘤的发生是多种细胞因子及其他多种因素共同作用的结果, TNF-α只是其中的一种细胞因子. (2)TNF-α的表达不仅受TNF-α-308位点基因多态性的影响, 除此之外其他位点同样会影响TNF-α的产量. (3)不同的肿瘤类型有不同的发病机制, TNF-α在其病理过程中可能作用不同. 另外, 也可能与此类研究多是回顾性研究, 且研究人群存在地区、人种和样本量的差异有关. 所以有待于在不同肿瘤中扩大样本量, 并在同种族、同地域人群中进行长期随访研究, 进一步观察TNF-α多态性与环境因素及其他遗传因素的相互作用, 这样对揭示TNF-α多态性与肿瘤的确切关系才更有意义.
在食管癌患者血浆中发现TNF-α表达增多[13-14]. Zhou et al[15]许多中国学者, 在对比食管癌患者放疗前后及健康人血清TNF-α水平时发现, 食管癌患者放疗前血清TNF-α水平显著高于放疗后, 而且均明显高于对照组. 他们还提出, TNF-α的检测对食管癌的诊断、治疗及预后有重要的临床意义. TNF水平变化与不同病理学类型、病理分级、有无锁骨上淋巴结转移无关, 和病程长短及近期疗效有关. 因此, TNF-α作为一种肿瘤标志物, 可能对食管癌的诊断及预后具有指导意义. Guo et al[16]利用PCR-RFLP技术对TNF-α-308G/A和TNF-β+252G/A的多态性的研究发现, 在食管鳞癌、胃癌以及健康对照人群中TNF-α等位基因的分布没有显著性差异. 综合考虑TNF-α-308G/A和TNF-β+252G/A后, 基因型为TNF-β GA和TNF-α GA或AA型个体与TNF-β AA和TNF-α GG型相比较, 癌发生率的风险明显降低. 在调节免疫监督、抑制肿瘤发生的过程中TNF-α和TNF-β可能存在交互作用.
我们用PCR-RFLP的方法, 对新疆北部哈萨克族食管癌及正常人群的TNF-α-308G/A多态性进行了检测, 结果发现TNF-α-308G/A 3种基因型G/G、A/G、A/A食管癌组中所占比例分别为70.8%、26.9%、2.4%, 对照组中分别为70.0%、29.0%、1.0%, 比较两组中3种基因型总构成比, 无差异(χ2 = 1.228, P>0.05). 说明TNF-α-308G/A基因多态性可能与新疆哈萨克族食管癌的发病无关, 这与河北学者的研究结果一致. 我们将新疆哈萨克族TNF-α-308G/A基因型分布与河北汉族进行比较发现, 无论是食管癌组还是对照组, 新疆哈萨克族TNF-α G/A基因型都高于河北汉族的(表3), 提示TNF-α-308G/A基因多态性的分布可能与民族不同相关. 我们的结果还显示G/G、A/G、A/A 3种基因型在有转移的食管癌中所占比例分别为61.6%、3.7%、4.7%, 在没有发生转移的食管癌中分别为77.0%、22.2%、0.8%. 经统计分析发现, TNF-α-308G/A基因多态性可能与新疆哈萨克族ESCC的发展和转移相关, 携带有G/A或A/A基因型的患者可能增加食管癌生长和转移的风险. 有学者[17]认为, TNF-α-308位点携带有A等位基因型的患者能促进恶性肿瘤的生长. 还有学者[18-19]研究认为, 高水平的TNF-α可能诱导机体产生血管内皮生长因子(vascular endothelial growth factor, VEGF), 生成的血管内皮生长因子则可促进肿瘤的生长和转移. 不过, 也有学者[20]认为TNF-α促进肿瘤生长作用, 可能与肿瘤细胞表面缺乏和TNF-α相结合的溶细胞活性的受体(TNFR)有关. 还有学者[21-22]认为, 也可能是TNF-α通过诱导其他细胞因子, 如IL-1、前列腺素E2(PGE2)等的释放干扰或抑制细胞免疫功能, 促进肿瘤的生长或转移. 临床资料也显示, 癌前病变或恶性肿瘤患者的血浆中TNF-α表达明显高于正常人, 慢性长期的低水平TNF-α能够促进肿瘤的发生、发展及转移. Szlosarek et al[23]认为, 其可能的机制是TNF-α传递了肿瘤细胞和炎症细胞的信息.
近年来, TNF-α基因多态性与食管癌的关系研究较少, 但均得出了TNF-α基因多态性与食管癌的发生无关. 这除了跟地区和民族的差异有关外, 有学者[24]还认为很难抛开人类白细胞抗原(human leucocyte antigen, HLA)去单独研究TNF-α在体内的作用, 因为他们之间存在着一种连锁不平衡, 其作用是相互影响的. 而且食管癌的发生除了跟遗传易感性有关外, 还跟生活习惯和生活环境有很大关系, 单方面去研究某一种因素与食管癌的关系都有一定的片面性和局限性. 在考虑某个或某些特定基因多态的风险时, 还必须强调特定的环境暴露, 因为不同的人群所暴露的环境因素可能不同. 所以下一步, 要从TNF在体内的作用机制出发, 研究各相关基因的相互作用, 及这种作用在不同的生活习惯和生活环境中, 对食管癌的发生发展有何不同.
总之, 我们认为TNF-α-308G/A基因多态性与新疆哈萨克族ESCC的发生无关, 但与其恶性程度和转移相关, G/A型和A/A型的食管癌患者, 癌趋于低分化、易转移.
食管癌是一种常见的上消化道恶性肿瘤, 往往一经发现便为中晚期,他的5 a生存率不足20%. 我国是世界上食管癌发病率最高的国家, 在我国恶性肿瘤死亡率中居于第四位. 新疆哈萨克族是我国少数民族中食管癌发病率和死亡率均最高 的民族.
近年来,TNF-α与肿瘤的关系逐渐成为研究热点. TNF-α的具体作用机制仍是亟待解决的问题.
Peter Szlosarek et al认为TNF-α有促进肿瘤的发生、生长和转移的作用. 其可能机制是, 在肿瘤细胞的微环境中,TNF-α起着传递肿瘤细胞和炎症细胞的信息作用.
首次检测了TNF-α-308G/A基因多态性在新疆哈萨克族中的分布, 并分析了其与食管癌的关系. 首次提出了TNF-α-308G/A基因多态性与食管癌恶性程度和转移相关, G/A型和A/A型的食管癌患者, 癌趋于低分化、易转移.
TNF-α-308G/A基因多态性可能不影响新疆哈萨克族食管癌的发病,但检测TNF-α-308G/A基因型可能对癌的发展和预后起到评估作用.
肿瘤坏死因子(tumor necrosis factor, TNF)是体内一种促炎细胞因子, 在体内具有广泛的生物学活性. 人们一般只了解他对肿瘤组织的出血坏死作用, 其实, 他还有促进肿瘤发生、生长和转移的作用. 具体何时主要表现什么作用, 这跟 TNF在体内的水平高低和作用时间长短有关.
本文探讨了新疆哈萨克族食管癌与TNF-a基因多态性的相关性, 方法成熟, 数据可信, 对食管鳞癌的基础和临床研究都有一定的参考价值.
编辑: 程剑侠 电编:何基才
| 1. | Warzocha K, Ribeiro P, Bienvenu J, Roy P, Charlot C, Rigal D, Coiffier B, Salles G. Genetic polymorphisms in the tumor necrosis factor locus influence non-Hodgkin's lymphoma outcome. Blood. 1998;91:3574-3581. [PubMed] |
| 4. | Duarte I, Santos A, Sousa H, Catarino R, Pinto D, Matos A, Pereira D, Moutinho J, Canedo P, Machado JC. G-308A TNF-alpha polymorphism is associated with an increased risk of invasive cervical cancer. Biochem Biophys Res Commun. 2005;334:588-592. [PubMed] |
| 5. | Wilson AG, Symons JA, McDowell TL, McDevitt HO, Duff GW. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci U S A. 1997;94:3195-3199. [PubMed] |
| 6. | Kroeger KM, Carville KS, Abraham LJ. The -308 tumor necrosis factor-alpha promoter polymorphism effects transcription. Mol Immunol. 1997;34:391-399. [PubMed] |
| 7. | Mestiri S, Bouaouina N, Ahmed SB, Khedhaier A, Jrad BB, Remadi S, Chouchane L. Genetic variation in the tumor necrosis factor-alpha promoter region and in the stress protein hsp70-2: susceptibility and prognostic implications in breast carcinoma. Cancer. 2001;91:672-678. [PubMed] |
| 8. | Machado JC, Figueiredo C, Canedo P, Pharoah P, Carvalho R, Nabais S, Castro Alves C, Campos ML, Van Doorn LJ, Caldas C. A proinflammatory genetic profile increases the risk for chronic atrophic gastritis and gastric carcinoma. Gastroenterology. 2003;125:364-371. [PubMed] |
| 9. | Liu CJ, Wong YK, Chang KW, Chang HC, Liu HF, Lee YJ. Tumor necrosis factor-alpha promoter polymorphism is associated with susceptibility to oral squamous cell carcinoma. J Oral Pathol Med. 2005;34:608-612. [PubMed] |
| 10. | Tsai FJ, Lu HF, Yeh LS, Hsu CD, Chen WC. Lack of evidence for the association of tumor necrosis factor-alpha gene promoter polymorphism with calcium oxalate stone and bladder cancer patients. Urol Res. 2001;29:412-416. [PubMed] |
| 11. | Zheng C, Huang DR, Bergenbrant S, Sundblad A, Osterborg A, Bjorkholm M, Holm G, Yi Q. Interleukin 6, tumour necrosis factor alpha, interleukin 1beta and interleukin 1 receptor antagonist promoter or coding gene polymorphisms in multiple myeloma. Br J Haematol. 2000;109:39-45. [PubMed] |
| 12. | Govan VA, Constant D, Hoffman M, Williamson AL. The allelic distribution of -308 Tumor Necrosis Factor-alpha gene polymorphism in South African women with cervical cancer and control women. BMC Cancer. 2006;6:24. [PubMed] |
| 15. | Zhou JH, Jiang YG. Pre- and postoperative NK cell number and plasma levels of TNF and PGE2 in patients with esophageal carcinoma and their clinical significance. Zhonghua Zhong Liu Za Zhi. 1994;16:132-136. [PubMed] |
| 16. | Guo W, Wang N, Li Y, Zhang JH. Polymorphisms in tumor necrosis factor genes and susceptibility to esophageal squamous cell carcinoma and gastric cardiac adenocarcinoma in a population of high incidence region of North China. Chin Med J (Engl). 2005;118:1870-1878. [PubMed] |
| 17. | Chouchane L, Ahmed SB, Baccouche S, Remadi S. Polymorphism in the tumor necrosis factor-alpha promotor region and in the heat shock protein 70 genes associated with malignant tumors. Cancer. 1997;80:1489-1496. [PubMed] |
| 18. | Leibovich SJ, Polverini PJ, Shepard HM, Wiseman DM, Shively V, Nuseir N. Macrophage-induced angiogenesis is mediated by tumour necrosis factor-alpha. Nature. 1987;329:630-632. [PubMed] |
| 19. | Balasubramanian SP, Brown NJ, Reed MW. Role of genetic polymorphisms in tumour angiogenesis. Br J Cancer. 2002;87:1057-1065. [PubMed] |
| 20. | Semenzato G. Tumour necrosis factor: a cytokine with multiple biological activities. Br J Cancer. 1990;61:354-361. [PubMed] |
| 21. | Warren RS, Starnes HF Jr, Alcock N, Calvano S, Brennan MF. Hormonal and metabolic response to recombinant human tumor necrosis factor in rat: in vitro and in vivo. Am J Physiol. 1988;255:E206-E212. [PubMed] |
| 22. | Nara K, Odagiri H, Fujii M, Yamanaka Y, Yokoyama M, Morita T, Sasaki M, Kon M, Abo T. Increased production of tumor necrosis factor and prostaglandin E2 by monocytes in cancer patients and its unique modulation by their plasma. Cancer Immunol Immunother. 1987;25:126-132. [PubMed] |
| 23. | Szlosarek P, Charles KA, Balkwill FR. Tumour necrosis factor-alpha as a tumour promoter. Eur J Cancer. 2006;42:745-750. [PubMed] |
| 24. | Deshpande A, Nolan JP, White PS, Valdez YE, Hunt WC, Peyton CL, Wheeler CM. TNF-alpha promoter polymorphisms and susceptibility to human papillomavirus 16-associated cervical cancer. J Infect Dis. 2005;191:969-976. [PubMed] |