修回日期: 2007-05-01
接受日期: 2007-05-22
在线出版日期: 2007-07-18
目的: 探讨利多卡因对兔胰管括约肌压力和造影剂及胰管结扎相关胰腺炎的影响.
方法: 日本大耳兔24只随机分为4组, 每组6只. 采用300 g/L的泛影葡胺0.5 mL/kg经兔胰管内逆行注射+胰管阻塞的方法造模. Ⅰ,Ⅱ组造模前分别用利多卡因或蒸馏水在胰管远端括约肌处进行局部喷洒, 观察其对于兔胰管括约肌压力的影响及术后24 h胰腺病理形态学研究. Ⅲ组只进行胰管括约肌测压, Ⅳ组为对照组, 只做开腹术.
结果: 术前利多卡因乳头局部喷洒组与蒸馏水喷洒组相比, 术后24 h胰头部分的病理组织学评分结果表明胰腺的病理改变主要表现为轻微的水肿和炎细胞浸润, 其水肿、炎细胞浸润、出血以及坏死的程度显著减轻(水肿: 0.83±0.75 vs 2.83±0.41; 炎细胞浸润: 1.33±0.52 vs 3.00±0.00; 出血: 0.00±0.00 vs 0.67±0.52; 坏死: 0.17±0.41 vs 1.50±0.55, 均P<0.05). 利多卡因乳头局部喷洒组与蒸馏水喷洒组及单纯测压组相比, 利多卡因可显著降低胰管括约肌压力, 差异有统计学意义(19.98±6.47 vs 34.77±8.36, 32.67±7.79, 均P<0.05).
结论: 利多卡因在胰管远端括约肌的乳头部喷洒, 可以明显降低括约肌压力, 有效预防造影剂及胰管结扎所致胰腺炎.
引文著录: 许良璧, 黄永辉, 李俐佳, 车筑萍. 利多卡因对造影剂及胰管结扎所致兔胰腺炎动物模型的影响. 世界华人消化杂志 2007; 15(20): 2210-2214
Revised: May 1, 2007
Accepted: May 22, 2007
Published online: July 18, 2007
AIM: To explore the effects of lidocaine in an experimental model of acute pancreatitis induced by contrast medium and pancreatic duct ligation, as well the rabbits' pancreatic sphincter pressure.
METHODS: Twenty-four rabbits were randomly divided into four groups, each containing six animals. The rabbit model of acute pancreatitis was set up by retrograde injection of 300 g/L Urografin in biliopancreatic duct and pancreatic duct obstruction. Before operation, lidocaine or distilled water was locally sprayed on the pancreatic duct distal sphincter in theⅠor Ⅱ group, respectively. Then the pancreatic sphincter pressure was determined and pancreas pathological changes were observed after 24 hours. The group Ⅲ rabbits only underwent manometry of pancreatic duct sphincter, and group Ⅳ underwent sham operation.
RESULTS: The histopathological score of pancreas in rabbits showed that sprayed with lidocaine before operation, the head of the pancreas exhibited very mild edema and inflammatory cell infiltration, and the amounts of edema, inflammatory cell infiltration, necrosis and hemorrhage were significantly decreased compared with those in rabbits sprayed with distilled water (edema, 0.83 ± 0.75 vs 2.83 ± 0.41; inflammatory cell infiltration, 1.33 ± 0.52 vs 3.00 ± 0.00; hemorrhage, 0.00 ± 0.00 vs 0.67 ± 0.52; necrosis, 0.17 ± 0.41 vs 1.50 ± 0.55; all P < 0.05); and the pancreatic sphincter pressure was significantly reduced in groupⅠcompared with that in groups Ⅱ and Ⅲ (19.98 ± 6.47 vs 34.77 ± 8.36, 32.67 ± 7.79; both P < 0.05).
CONCLUSION: Before operation, topical application of lidocaine significantly can reduce pancreatic sphincter pressure, and can also prevent pancreatitis induced by contrast medium and pancreatic duct ligation.
- Citation: Xu LB, Huang YH, Li LJ, Che ZP. Effects of lidocaine in an experimental model of acute pancreatitis induced by contrast medium and pancreatic duct ligation. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2210-2214
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2210.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2210
急性胰腺炎(AP)是逆行胰胆管造影术(ERCP)和内镜下括约肌切开术(EST)后常见的并发症, 有关ERCP术后胰腺炎这一疾病的确切发病机制目前尚不清楚, Cosen-Binker et al[1]和Tiscornia et al[2]研究发现, 急性胰腺炎的最初激发因素可能在胰腺外, 关键在于激发位于十二指肠的Vater壶腹周围的自主性反射弧(autonomous arc reflexes, AAR), 以及肠胰间的负反馈环被破坏. 因此根据上述涉及到的发病机制, 我们通过激发自主性反射弧和破坏正常的肠胰间负反馈环, 而模仿临床ERCP术后胰腺炎的发生. 我们假设阻断自主性反射弧, 可以阻止或缓解急性胰腺炎的发生. 因此采用利多卡因喷洒在主胰管位于十二指肠的开口周围, 通过局麻药的神经阻滞作用, 了解自主性反射弧的抑制与急性胰腺炎之间的关系, 以及该药对于ERCP术后胰腺炎的影响.
日本大耳兔24只, 雌雄各半, 体质量2.5-3 kg, 术前可自由饮水, 但术前常规禁食16-24 h. 随机分为4组, 每组6只. Ⅰ组术前利多卡因5 mL乳头局部喷洒+胰管括约肌测压+胰管内注射300 g/L泛影葡胺0.5 mL/kg+胰管阻塞; Ⅱ组术前蒸馏水5 mL乳头局部喷洒+胰管括约肌测压+胰管内注射300 g/L泛影葡胺0.5 mL/kg+胰管阻塞; Ⅲ组单纯胰管括约肌测压组; Ⅳ组为正常对照, 只做开腹术.
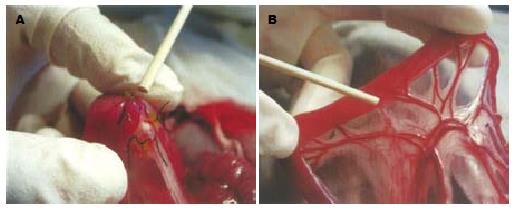
予30 g/L戊巴比妥钠1 mL/kg经兔耳缘静脉麻醉. 兔仰卧位放置在兔台上. 剪去腹部兔毛, 常规消毒铺敷后, 在腹正中经剑突下两横指切开腹部10 cm, 游离出胃幽门部, 沿十二指肠上段往下, 寻找主胰管进入十二指肠的位置(图1A 兔胰腺呈粉红色, 散在于十二指肠"U"形弯曲部的肠系膜上, 仅有一条胰管开口位于十二指肠升支开始的5-7 cm处, 兔胰管开口远离胆管开口, 这是兔的一大特点). 剪开该部位对侧的肠壁约1 cm, 可以清楚的显示主胰管开口部的乳头括约肌(图1B). 经括约肌以50 mmHg的压力逆行灌注300 g/L泛影葡胺0.5 mL/kg(上海旭东海普药业有限公司生产)用7-0丝线结扎主胰管远端, 术毕关腹[3-5]. 整个手术过程采用加热灯加热腹腔, 使腹腔温度下降不超过1-1.5℃, 避免因温度下降过多造成测压结果不可靠. 胰管括约肌压力测定导管用Terumo公司生产的3Fr.130 cm的脑血管造影管自行改制. 导管改制成为长60 cm, 外径0.8 mm, 将尖端封闭, 在位于尖端4 mm处打一侧孔, 直径0.6 mm. 在测压管表面, 距测压孔每隔1 mm共有15个标记, 作为牵拉测压的标记. 测压仪器: BL-410生物机能实验系统(成都泰盟公司生产), HY-4型生理压力传感器(北京航天医学工程研究所生产), WZ-50微量灌注泵(浙江医科大学医学仪器实验厂), 灌注水流速度恒定于0.07 mL/min, 测压系统经校准. 经上述手术处理后, 暴露主胰管远端在十二指肠开口的乳头括约肌. 经乳头逆行插入测压导管至胰管, 稳定2 min后开始测压, 采用定点牵拉法, 每次向后牵拉约1 mm, 每点测压时间0.5-1 min, 直至测压孔完全进入十二指肠, 连续描记压力曲线, 胰管下段括约肌测压以十二指肠压力为"零", 测定胰管远端括约肌的基础压[6]. 每次测压时间不超过10 min. 于术后24 h, 经耳缘静脉快速推注过量的30 g/L戊巴比妥钠将动物处死. 开腹取出胰腺组织, 放置在中性福尔马林中, 室温下保存. 取胰头组织进行石蜡包埋、切片和HE染色. 请病理科2位资深专家进行双盲的病理组织学评分. 胰腺组织的病变分为水肿、出血、炎性细胞浸润、腺泡和脂肪坏死, 按损害程度不同分为0-3分不等. 胰腺组织正常记为0分; 病变范围轻, 占30%以下记为1分; 病变范围较重, 超过30%但尚未达到50%记为2分; 病变范围很重, 超过50%记为3分[3].
统计学处理 全部数据录入计算机, 采用SPSS11.5进行统计学分析. 所有结果采用mean±SD表示. 术后24 h的病理结果进行比较, 采用完全随机设计的单因素方差分析(ANOVA); 如果差异有统计学意义, 再进行组内两两比较, 采用SNK-q检验; 其他各组与Ⅳ组(对照组)比较, 采用Dunnett-t检验; 生理盐水或利多卡因喷洒乳头后括约肌的压力变化, 以及基础状态下胰管括约肌的压力比较, 采用单因素方差分析(ANOVA), 如果差异有统计学意义, 再进行组内两两比较, 采用SNK-q检验, P<0.05为差异有显著性.
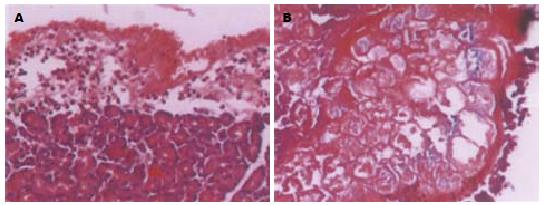
胰腺组织病理损伤的程度在Ⅱ组最重, 主要表现为明显的水肿和炎细胞浸润; 有轻微的出血和坏死, 病变范围一般不超过50%, 多数在30%以内, 仍然是以水肿型胰腺炎的表现为主. 而Ⅰ组, 胰腺主要表现为轻微的水肿和炎细胞浸润, 在部分病例见散在的点状坏死, 病变范围<30%, 而且没有明显的胰腺出血, 仅表现为非常轻微的水肿性胰腺炎, 部分病例甚至只有轻微的炎细胞浸润, 而没有明显的胰腺水肿和坏死(图3). 胰头部水肿程度按严重度由低到高Ⅳ-(Ⅰ, Ⅲ)-Ⅱ(P<0.05); 炎细胞浸润按严重度由低到高Ⅳ-(Ⅰ, Ⅲ)-Ⅱ(P<0.05); 坏死按严重程度由低到高(Ⅳ, Ⅰ, Ⅲ)-Ⅱ(P<0.05); 出血按严重程度由低到高(Ⅳ, Ⅰ, Ⅲ)-Ⅱ(P<0.05); 胰腺病理组织损害总分由低到高Ⅳ-(Ⅰ, Ⅲ)-Ⅱ(P<0.05)(表1).
| 分组 | 水肿 | 炎细胞浸润 | 坏死 | 出血 | 总分 |
| Ⅰ | 0.83±0.75 | 1.33±0.52 | 0.17±0.41 | 0.00±0.00 | 2.17±1.33 |
| Ⅱ | 2.83±0.41 | 3.00±0.00 | 1.5±0.55 | 0.67±0.52 | 8.00±0.89 |
| Ⅲ | 0.67±0.52 | 0.11±0.63 | 0.33±0.52 | 0.17±0.41 | 4.50±0.84 |
| Ⅳ | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
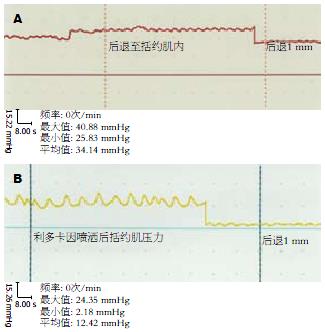
2.2 胰管远端括约肌压力Ⅰ, Ⅱ, Ⅲ组括约肌测压结果分别为: 19.98±6.47, 34.77±8.36, 32.67±7.79. 利多卡因在胰管远端括约肌的乳头部喷洒(图2B), 与蒸馏水乳头部喷洒(图2A)及单纯测压比较, 括约肌压力的改变差异有统计学意义(P<0.05); 而Ⅱ组与Ⅲ组比较, 括约肌的压力没有显著差异.
本次实验中, 选用兔为动物模型, 主要是考虑其独特的解剖特点, 兔的胰、胆管分别开口于十二指肠, 避免插管导致胆汁逆流入胰腺, 加重胰腺的损害, 以及引起括约肌功能异常, 从而影响括约肌的测压结果及胰腺病理形态学研究; 而且胰管远端括约肌明显, 其开口位于十二指肠, 一方面有利于我们插管测压, 另一方面便于我们了解利多卡因对于胰管括约肌的影响, 从而帮助解释利多卡因在十二指肠乳头局部喷洒, 能有效缓解ERCP术后胰腺炎的程度以及其降低ERCP术后胰腺炎的发病率的原因. 通过对3组胰管括约肌的基础压研究, 我们用利多卡因喷洒乳头后测压结果提示, 胰管括约肌的压力明显减低. 这与Klein et al[7]观察的一致. 在这3组动物模型中, 我们都进行胰管括约肌测压术, 但测压结果都只发现胰管括约肌的基础压, 多数动物未见明显的收缩幅度及频率变化. 这可能与每一部位的测压时间不够长有关, 也可能与压力传感器等测压仪器的敏感度有关. 但鉴于长时间测压以及测压过程中灌注的生理盐水过多, 可以引起实验结果可靠性下降, 因此本实验采用的测压时间一般不超过10 min. 即使这样, 我们仍在少数动物中发现胰管括约肌有收缩活动存在, 并描计下收缩幅度及频率. 我们相信若能改善测压技术, 采用液氮灌注; 或提高压力传感器的敏感性, 可以更加清楚的描计出完整的压力变化情况.
关于利多卡因降低Oddi括约肌的张力的机制, 既往的一系列慢性试验研究发现, 在清醒狗的Vater壶腹周围喷洒利多卡因可抑制胆碱能神经的张力, 松弛主胰管的出口, 以及减慢十二指肠运动[2]. 在近期通过免疫组化研究发现, 兔的胰岛、腺胞、胰管、神经节以及血管上分布着广泛的胆碱能(AChE)神经网, 兔胰腺的所有神经组织化学染色都是AChE阳性的, 分布在胰头连结十二指肠肌间神经丛的是AChE和NADPH-d阳性的神经纤维, 利多卡因引起兔胰管远端括约肌压力减低可能与他抑制钠通道、阻止钠离子内流, 从而抑制胆碱能神经的张力[8]. 因此, 我们认为ERCP术前乳头部喷洒利多卡因减少术后胰腺炎的发作, 可能是通过对局部胆碱能神经的抑制, 从而降低Oddi括约肌的张力, 改善胆胰液的引流, 解除梗阻这一不利因素而实现的.
Ⅲ组胰头部组织病理分析提示胰管的插管测压可以造成有很轻微胰腺的损害, 多数表现为轻微的水肿和炎细胞浸润. 其中1例仅表现为轻微的水肿, 面积小于30%. 另1例仅有轻微的炎细胞渗出, 范围小于30%. 这可能与测压这一过程扩张胰管远端括约肌, 刺激其周围的自主性反射弧感受器, 激发自主反射弧, 造成神经源性的炎症有关. 在Ⅰ组模型中, 采用造模前乳头局部喷洒利多卡因, 术后24 h的胰腺水肿、炎性细胞浸润、出血、坏死的情况较Ⅱ组明显减低, 这说明利多卡因能有效缓解胰腺的损害程度. 经过统计学研究发现, 利多卡因乳头局部喷洒后胰腺的出血及坏死情况较单纯测压组及对照组比较没有明显差异, 这进一步说明单纯测压对胰腺的损坏很轻微, 而利多卡因对胰腺的保护作用也就显而易见了. 利多卡因是如何改善胰腺损伤的呢? 一系列的研究使我们相信, 利多卡因局部浸润麻醉可以有效的抑制自主性反射弧的毒性作用, 抑制胰腺内胆碱能神经的张力; 从而有效的防止或减弱十二指肠壶腹周围的自主性反射弧的强度, 松弛主胰管的出口和减慢十二指肠运动[9-10]. 近期, 黄永辉 et al[9]研究发现利多卡因在乳头局部喷洒可以有效地防止治疗性ERCP术后淀粉酶的增高, 对胰腺炎的发生有明显预防作用, 并可以方便插管.
另外, 由于测压过程可以引起胰液引流不畅, 肠胰间的负反馈环遭到破坏, 十二指肠黏膜分泌大量的胆囊收缩素(CCK), 使血中CCK浓度升高. 而CCK受体广泛存在于Oddi括约肌及其节后副交感神经纤维, 不同动物对CCK的反应不同, CCK可兴奋兔的Oddi括约肌收缩[11]; 而且可使胰腺外分泌增加, 胰腺的酶以及各种蛋白分泌增加, 胰液的黏稠度加大, 胰管内压力进一步增高, 腺泡破裂, 胰酶进入间质被组织液激活引起炎症. Louie et al[12]用大鼠进行实验发现, 利多卡因十二指肠内灌注, 可以明显减低由于胆胰分流造成的CCK水平升高. 因此, 利多卡因局部喷洒能减少ERCP术后胰腺炎的发生, 可能与胰管远端括约肌的压力降低, 以及胰腺的外分泌受抑制有关. 目前, 也有一些研究证实, 利多卡因具有抗炎作用. Portiansky et al[13]利用口蹄疫病毒感染大鼠, 可以诱发急性坏死性胰腺炎; 利多卡因腹腔内注射可以明显的减轻胰腺坏死和炎细胞的浸润. 这是由于利多卡因可以抑制巨噬细胞的黏附、趋化、吞噬、脱颗粒以及呼吸爆发, 减少吞噬作用引起的氧耗增加和超氧阴离子形成, 并且可以减少炎症介质和多形核白细胞黏附分子的形成. 这说明利多卡因局部喷洒, 可能会通过其抗炎作用减轻胰腺的损坏.
本次实验中, 通过利多卡因在乳头局部的喷洒, 能明显减轻胰腺的炎症. 这可能与抑制乳头周围分布的自主性反射弧有关; 也与抑制胆碱能神经, 减少CCK分泌和松弛胰管下断括约肌有关; 另外, 利多卡因的抗炎作用可能也与炎症的缓解有关. 因此, 我们认为ERCP术前喷洒利多卡因可以减少术后胰腺炎的发生, 同样也可以缓解术后胰腺炎的严重程度. 但是, 近期Schwartz et al[14]进行大规模人群研究的结果却与之相反, 他们认为ERCP术前喷洒利多卡因并不能减少术后胰腺炎的发生, 这是否与他们选择的利多卡因的剂型以及浓度和用量有关, 还有待于进一步深入研究.
急性胰腺炎(AP)是逆行胰胆管造影术(ERCP)和内镜下括约肌切开术(EST)后常见的并发症, 在一定程度上制约该技术在临床上的推广和应用. 然而, 有关ERCP术后胰腺炎这一疾病的确切发病机制目前尚不清楚. 本文就如何有效的预防该疾病发生及其所涉及的机制进行一系列基础研究.
国内外研究报道利多卡因在乳头局部喷洒可以有效地防止治疗性 ERCP术后淀粉酶的增高, 对胰腺炎的发生有明显预防作用, 并可以方便插管. 大鼠的急性坏死性胰腺炎的动物模型, 采用盐酸利多卡凝胶喷洒在十二指肠Vater壶腹周围, 可以明显减轻胰腺组织的损害, 血淀粉酶和脂肪酶也较病理组明显的减低.
本论文从基础研究的角度, 通过对动物模型的胰管括约肌压力测定,并结合胰腺病理损伤的情况, 阐述利多卡因减轻胰腺损伤的机制.
利多卡因十二指肠乳头部喷洒, 可以降低局部括约肌的压力, 并减轻胰腺的损害程度, 该方法简便、药物价格低廉、药源充沛. 可以作为预防ERCP树后胰腺炎的方法.
本文应用造影剂及胰管结扎来模拟临床ERCP的实际操作, 分析应用利多卡因后括约肌压力及胰腺炎严重程度的关系, 有较好的创新性. 研究证实利多卡因术前应用可以明显减轻胰腺炎发生, 其机制与降低括约肌压力有关, 对于临床实际应用有一定指导意义, 有较好的学术价值.
编辑: 程剑侠 电编:张敏
| 1. | Cosen-Binker LI, Binker MG, Negri G, Tiscornia O. Acute pancreatitis possible initial triggering mechanism and prophylaxis. Pancreatology. 2003;3:445-456. [PubMed] |
| 2. | Tiscornia OM, Hamamura S, Lehmann ES, Otero G, Waisman H, Tiscornia-Wasserman P, Bank S. Biliary acute pancreatitis:a review. World J Gastroenterol. 2000;6:157-168. [PubMed] |
| 3. | Hackert T, Werner J, Gebhard MM, Klar E. Effects of heparin in experimental models of acute pancreatitis and post-ERCP pancreatitis. Surgery. 2004;135:131-138. [PubMed] |
| 4. | He ZJ, Winston JH, Yusuf TE, Micci MA, Elfert A, Xiao SY, Pasricha PJ. Intraductal administration of an NK1 receptor antagonist attenuates the inflammatory response to retrograde infusion of radiological contrast in rats: implications for the pathogenesis and prevention of ERCP-induced pancreatitis. Pancreas. 2003;27:e13-17. [PubMed] |
| 7. | Klein ES, Grateron H, Toth L, Dreiling DA. Pancreatic intraductal pressure: II. Effects of autonomic denervation. Am J Gastroenterol. 1983;78:510-512. [PubMed] |
| 8. | Love JA, Szebeni K. Morphology and histochemistry of the rabbit pancreatic innervation. Pancreas. 1999;18:53-64. [PubMed] |
| 10. | Tiscornia OM. The neural control of exocrine and endocrine pancreas. Am J Gastroenterol. 1977;67:541-560. [PubMed] |
| 12. | Louie DS, May D, Miller P, Owyang C. Cholecystokinin mediates feedback regulation of pancreatic enzyme secretion in rats. Am J Physiol. 1986;250:G252-259. [PubMed] |
| 13. | Portiansky EL, Gonzalez PH. Protective effect of lidocaine in the experimental foot-and-mouth disease pancreatitis. Experientia. 1995;51:1060-1062. [PubMed] |
| 14. | Schwartz JJ, Lew RJ, Ahmad NA, Shah JN, Ginsberg GG, Kochman ML, Brensinger CM, Long WB. The effect of lidocaine sprayed on the major duodenal papilla on the frequency of post-ERCP pancreatitis. Gastrointest Endosc. 2004;59:179-184. [PubMed] |