修回日期: 2007-04-01
接受日期: 2007-04-28
在线出版日期: 2007-07-18
目的: 探讨信号转导子与转录活化因子1 (STAT1)、核因子κB(NF-κB) p65和凋亡因子caspase 8在胃癌细胞SGC7901中的关系.
方法: SGC7901细胞经IFN-γ及STAT1反义寡核苷酸(STAT1ASON)处理后, 应用RT-PCR方法检测STAT1, NF-κB p65和caspase 8在mRNA水平的改变.
结果: IFN-γ (1000 U)处理SGC7901细胞, 在0.5, 3和24 h, STAT1和NF-κB p65在mRNA水平出现先下降后上升的变化, 二者呈正相关关系(r = 0.403, P = 0.009); 使用不同浓度的STAT1ASON处理SGC7901细胞24 h, 在mRNA水平, STAT1和NF-κB p65呈负相关关系(r = -0.556, P = 0.015); IFN-γ和不同浓度的STAT1ASON联合作用处理SGC7901细胞24 h, 在mRNA水平, STAT1和NF-κB p65呈负相关(r = -0.783, P = 0.002), caspase 8呈上升趋势, 与 STAT1呈负相关关系(r = -0.667, P = 0.002), 与NF-κB p65呈正相关关系(r = 0.594, P = 0.021).
结论: IFN-γ能促进STAT1, NF-κB和caspase 8的表达, STAT1和NF-κB p65在mRNA水平上呈负相关; caspase 8与STAT1呈负相关关系, 与NF-κB p65呈正相关关系.
引文著录: 向春香, 邓昊, 罗海莲, 刘丽江. 胃癌细胞SGC7901中STAT1, NF-κB p65和caspase 8的关系. 世界华人消化杂志 2007; 15(20): 2194-2200
Revised: April 1, 2007
Accepted: April 28, 2007
Published online: July 18, 2007
AIM: To discuss the relationship between signal transducer and activator of transcription 1 (STAT1), nuclear factor-κB (NF-κB) p65 and apoptotic factor casapase 8, to elucidate the possible mechanism of apoptosis in the human gastric cancer cell line SGC7901.
METHODS: SGC7901 cells were treated with IFN-γ and STAT1 antisense oligonucleotides (ASONs). The mRNA expression for STAT1, NF-κB p65 and caspase 8 was examined by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: When SGC7901 cells were treated with IFN-γ 1000 U, at 0.5, 3 and 24 h, the mRNA levels for STAT1 and NF-κB p65 expression were up-regulated; there was also a positive correlation between STAT1 and NF-κB p65 expression (r = 0.403, P = 0.009). With STAT1 ASONs, STAT1 expression was down-regulated, while NF-κB p65 expression was up-regulated; in the mRNA levels, there was a negative correlation between STAT1 and NF-κB p65 (r = -0.556, P = 0.015). There was no significant correlation between caspase 8 and STAT1 or NF-κB p65. When SGC7901 cells were treated with IFN-γ 1000 U and STAT1 ASONs, there was a negative correlation between mRNA levels of STAT1 and NF-κB p65 (r = -0.783, P < 0.05). IFN-γ up-regulated caspase 8 expression; there was a negative correlation with STAT1 (r = -0.783, P = 0.002), but a positive correlation with NF-κB p65 (r = -0.667, P = 0.002).
CONCLUSION: IFN-γ can up-regulate the mRNA levels of STAT1, NF-κB p65 and caspase 8. mRNA levels of STAT1 and NF-κB p65 were negatively correlated. Caspase 8 had a negative correlation with STAT1, but a positive correlation with NF-κB p65.
- Citation: Xiang CX, Deng H, Luo HL, Liu LJ. Relationship of signal transduction and activators of transcription 1, nuclear factor κB p65 and caspase 8 in gastric cancer cell line SGC7901. Shijie Huaren Xiaohua Zazhi 2007; 15(20): 2194-2200
- URL: https://www.wjgnet.com/1009-3079/full/v15/i20/2194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i20.2194
胃癌是全球第2大常见的恶性肿瘤, 是我国最常见的恶性肿瘤之一, 其死亡率高[1-3], 严重危害人类的健康. 但无论是在预防、早期发现以及治疗方面均没有取得突破性的进展[4]. 胃癌细胞凋亡率较低, 为1.9%-2.8%[5]. 和其他恶性肿瘤一样, 原癌基因的激活、抑癌基因的突变是胃癌形成的重要分子基础之一, 但胃癌的基因异常大多缺乏特异性, 因此胃癌发生的分子机制仍然模糊不清. 近年研究发现, 细胞凋亡与细胞增殖平衡失调在胃癌发生中具有重要意义. JAK/STAT1和NF-κB信号通路是机体内的2条重要的信号通路, 均可在IFN-γ作用下对细胞凋亡进行调控. 在胃癌中关于他们的研究较少, Beppu et al[6]研究发现, IFN-γ可同时促进胃癌MK-1和GCTM细胞中STAT1(促凋亡)和NF-κB(抑凋亡)的表达上调, 当IFN-γ和环孢菌素A(CsA, 抑制NF-κB活性)同时使用时, 凋亡明显增加, 继而使用STAT1反义寡核苷酸抑制STAT1活性时, 胃癌细胞凋亡率下降, 证实IFN-γ主要通过JAK-STAT1途径促进胃癌凋亡, Zhang et al[7]的研究也证实了此点. Fulda et al[8]发现IFN-γ作用于神经纤维瘤细胞后, 通过STAT1/IRF1途径上调caspase 8的表达, 诱导凋亡发生.
NF-κB在胃癌细胞和组织中过表达, 通过使其靶基因COX-2[9], ICAM-1[9], uPA[9], IL-8[10-11]等的mRNA及蛋白水平上调, 从而与胃癌形成, 浸润转移密切相关并在某种程度上决定着患者的预后. Sasaki et al[10]研究发现在胃癌肿瘤细胞中RelA的核转位明显高于癌旁上皮细胞. 研究报道, 抑制NF-κB的活性可促进细胞凋亡[12]. Beppu et al[6]发现使用CsA抑制NF-κB的活性, 胃癌细胞MK-1和GCTM凋亡显著增加. Wang et al[13]报道IFN-γ作用后可活化NF-κB, 抑制caspase 8的表达, 阻断凋亡通路抑制凋亡发生. 在胃癌细胞中STAT1与NF-κB的关系及他们是否可通过caspase 8调控凋亡并不清楚, 也未见相关文献报道. 我们拟通过细胞生物学和分子病理学的方法, 观察胃癌SGC7901细胞在IFN-γ及不同浓度STAT1反义寡核苷酸处理下, STAT1, NF-κB p65及caspase 8在mRNA水平的变化, 研究3者间的相关性以及可能存在的分子通路.
SGC7901细胞系[14]由本实验室保存, 在37℃ 50 mL/L CO2、饱和湿度条件下用含100 mL/L小牛血清(Gibco)的RPMI1640(Gibco)培养基培养, 细胞传代采用0.25 g/L的胰酶+0.02 g/L的EDTA, 每3-5 d传代1次. IFN-γ购自Peprotech EC公司; TRIzol购自Invitrogen公司; RT-PCR试剂盒(TaKaRa)购自大连宝生物工程有限公司; Tansfection转染试剂购自Tiangen公司; 反义寡核苷酸及引物序列由赛百胜生物技术有限公司合成. 使用Primer 5.0引物设计软件分别设计NF-κB p65, STAT1, caspase 8和β-actin的上游和下游引物(表1).
| 名称 | 正义 | 反义 | 产物长度 |
| β-actin | 5'-TGCTGTCCCTCTACGCCTCT-3' | 5'-GCTTCTCCTTGATGTCGC-3' | 234 bp |
| STAT1 | 5'-CATGCGGTTGAACCCTACA-3' | 5'-TTCTACAGAGCCCACTATCC-3' | 342 bp |
| NF-κB p65 | 5'-GGGGACTACGACCTGAATG-3' | 5'-GGGCACGATTGTCAAAGAT-3' | 475 bp |
| caspase 8 | 5'-AAGAGGAAATCTCCAAATGC-3' | 5'-TCAAAGGTCGTGGTCAAAGC-3' | 356 bp |
(1)使用IFN-γ 1000 U[15]处理胃癌SGC7901细胞, 实验分4组: 空白对照组, IFN-γ 1000 U处理0.5, 3, 24 h; (2)STAT1ASON处理胃癌SGC7901细胞24 h, STAT1反义寡核苷酸序列为: 5'-CCACTGAGACATCCTGCCACC-3'[16], 全程硫代修饰, 使用FAM标记, 在蓝色激发光下发绿色荧光, 分5组: 空白对照组, IFN-γ 1000 U处理组, STAT1ASON 200, 400, 600 nmol/L处理组; (3)IFN-γ 1000 U联合STAT1ASON处理胃癌SGC7901细胞24 h, 分5组: 空白对照组, IFN-γ 1000 U处理组, IFN-γ 1000 U+STAT1ASON 200, 400, 600 nmol/L处理组.
1.2.1 反义寡核苷酸的转染: 转染前1 d, 胰酶消化细胞并计数, 取(1-5)×105细胞传于6孔板, 在无血清0.5 mL, 不含抗生素的RPMI1640培养基中培养, 转染细胞密度约为1×106. 分别用50 μL无血清培养基稀释STAT1ASON Transfection试剂, 温和混匀, 室温放置5 min; 混合STAT1ASON和Transfection试剂(两者比例为1:2.5), 室温20 min; 以每孔100 μL将混合物加入6孔板, 轻轻混匀. CO2培养箱中37℃培养4-6 h后, 更换正常含血清培养基培养至24 h.
1.2.2 RT-PCR及灰度分析: 用TRIzol试剂从细胞中提取总RNA, 样品纯度和浓度经核酸测定仪测定, A260/280在1.8-2.0之间. cDNA合成步骤如下: MgCl 2 μL, 10×RT Buffer 1 μL, dNTP混合液(各10 mmol/L) 1 μL, RNase抑制剂0.25 μL, AMV逆转录酶0.5 μL, Olig dT 0.5 μL, RNA 1 μL(≤500 ng), RNase Free dH2O 3.75 μL, 总体积10 μL, 离心后混匀, 42℃ 30 min, 99℃ 5 min, 5℃ 5 min. 从上述反应体系中取2 μL, 加5×PCR Buffer 4 μL, TaKaRa Taq酶(83.35 nkat/L) 0.1 μL, 50 mmol/L上游、下游引物各0.5 μL, 灭菌蒸馏水12.9 μL, 总体积为20 μL. 反应条件为: 95℃预变性5 min后开始循环, 95℃变性30 s, 55℃退火30 s, 72℃延伸45 s, 30个循环, 最后72℃延伸5 min, 目的引物与β-actin用一管法进行PCR.PCR产物经1.5 g/L的琼脂糖凝胶电泳检测, 使用Biostep Photoimpact软件分析各组目的基因与β-actin条带的平均光密度值, 计算两者的比值, 进行相对定量.
统计学处理 使用SPSS13.0统计软件, 通过双样本成对t检验及Spearman等级相关分析各组平均光密度值的比值, P<0.05有统计学意义.
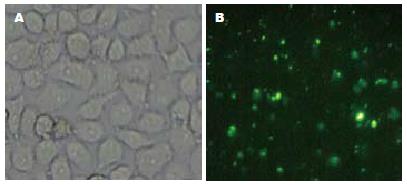
培养的SGC7901细胞贴壁生长, 在倒置显微镜下观察细胞呈不规则多边形, 折光性较强, 透明度大. 经STAT1ASON转染, 倒置荧光显微镜观察, 使用FAM标记的STAT1ASON在蓝色激发光下发绿色荧光(图1).
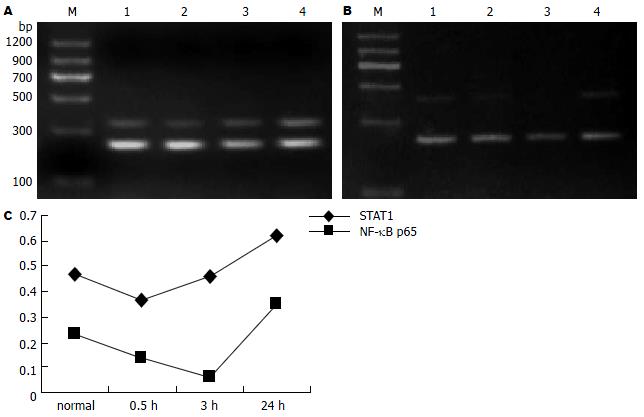
IFN-γ 1000 U处理SGC7901细胞0.5, 3, 24 h, STAT1和NF-κB p65 mRNA水平的表达先下降后上升(图2), 二者呈正相关关系(r = 0.403, P = 0.036, 表2).
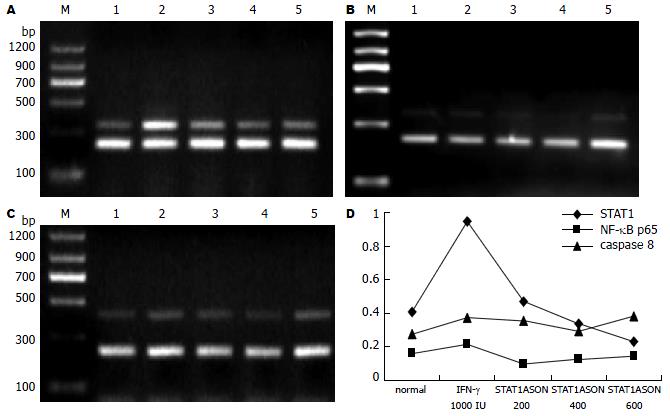
STAT1ASON处理胃癌SGC7901细胞24 h后, 随STAT1ASON浓度的加大, STAT1的表达逐渐下降(图3A). NF-κB p65的表达比空白对照组低, 随着STAT1ASON浓度加大, NF-κB p65的表达呈现逐渐升高的趋势(图3B). 二者呈负相关关系(r = -0.556, P = 0.019); caspase 8与STAT1, NF-κB p65无显著相关性(图3C, 表3).
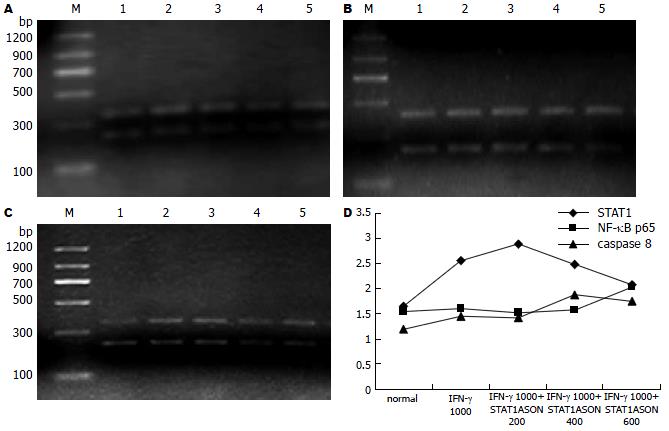
IFN-γ 1000 U处理SGC7901细胞后, STAT1, NF-κB p65和caspase 8的表达升高, 使用IFN-γ 1000 U的同时, 使用STAT1ASON在200 nmol/L时, STAT1的表达比单独IFN-γ 1000 U作用时要高, NF-κB p65表达略有降低, 但随着STAT1ASON浓度的加大, STAT1的表达逐渐下降, NF-κB p65表达逐渐增强, 而caspase 8的表达始终高于空白对照组(图4). 统计学分析显示STAT1与NF-κB p65呈负相关关系(r = -0.775, P = 0.002); STAT1与caspase 8呈负相关关系(r = -0.769, P = 0.002); NF-κB p65与caspase 8呈正相关关系(r = 0.594, P = 0.021, 表4).
STAT1和NF-κB是分布和作用均十分广泛的转录调节因子, 在机体免疫应答、炎症反应等多种生理、病理过程中发挥重要作用, 并控制着大量基因的转录, 涉及到细胞的生长分化、凋亡的调节、肿瘤转归、细胞因子产生等, 在受到多种刺激因素的激活后他们能入核内发挥其转录调节因子的功能[17]. STAT1是信号转导子和转录活化子家族中的重要成员. 许多肿瘤中STAT1高表达, 他是肿瘤血管发生、生长和转移的负性调节因子, 被认为是潜在的肿瘤抑制因子, 现多认为其可促进肿瘤细胞凋亡[18]. 研究表明, STAT1在IFN-γ诱导的凋亡中起重要作用, 他的活化能上调促凋亡分子的表达, 包括IL-1b转换酶, caspase 8和Fas/Fas受体等[19-22]. 然而, 几项研究都表明尽管STAT1活化, 肿瘤细胞仍会对IFN-γ产生抵抗[23], 对IFN-γ耐受的分子间作用机制并不清楚. Zhou et al[24]发现, IFN-γ对细胞的生长和生存有双重作用, 这两种作用是相反的, 这种生物学现象可能取决于IFN-γ诱导的多条通路间的平衡. 事实上, IFN-γ能同时启动JAK/STAT介导的凋亡途径和钙激活的NF-κB抗凋亡途径[6].
NF-κB是B细胞核提取物中一种能与免疫球蛋白k轻链基因的增强子kB序列(GGGACTTTCC)特异结合的核蛋白因子, 在哺乳动物细胞中共有5种NF-κB/Rel家族成员, 他们是c-Rel, NF-κB1(p50/p105), NF-κB2(p52/p100), RelA(p65), RelB. 通常情况下, NF-κB与本家族成员结合成同源或异源二聚体存在于胞质中, 最常见的形式是RelA(p65)/p50异源二聚体. 在无信号刺激时, NF-κB与IkB在胞质中结合成复合物, 阻止其转位进入细胞核内发挥激活功能. 他可以被细菌、病毒、免疫刺激和炎症细胞因子及可破坏细胞的很多物质所激活. 他的活化与肿瘤的侵袭、临床病理特征诸如: 淋巴转移, 浸润深度, 腹膜转移及肿瘤大小等相关联[9], 并与凋亡密切相关. 肿瘤细胞中高表达活化的NF-κB可以上调FLIP(Fas相关死亡区域蛋白样白介素1b转化酶抑制蛋白)的表达, FLIP是一种阻遏蛋白, 他主要通过抑制Fas/FasL-FADD-caspase 8通路活化而发挥抗凋亡作用. FLIP自身结构和caspase 8酶原、FADD相似, 含有DD区域, 但是缺乏关键的催化基元, 故其可以竞争性结合FADD, 阻止后者和caspase 8酶原结合形成死亡诱导信号复合物(DISC), 抑制caspase 8酶原的激活, 从而阻止caspases家族中效应因子caspase 3, 6, 7的活化, 阻断凋亡过程[25]. 在胃癌细胞中也存在此种机制[26-27]. FLIP的基因编码序列中存在kB位点故NF-κB活化可以上调FLIP的表达, 使肿瘤细胞逃脱FAS介导的凋亡. 我们发现, 在IFN-γ的作用下, STAT1和NF-κB p65在mRNA水平表达均上调, 这与Beppu et al报道的结果是一致的, 他们发现在24, 48, 72 h STAT1的表达与IFN-γ作用呈时间依赖性, 但在0.5, 3, 24 h我们观察到STAT1, NF-κB p65在mRNA水平的变化是先下降后上升的, 未见相关文献报道. 使用STAT1ASON抑制STAT1表达, 发现STAT1 mRNA水平表达降低后, NF-κB p65 mRNA水平表达也降低, 但随着STAT1反义寡核苷酸浓度的加大, NF-κB p65表达逐渐增强, 呈负相关关系, 与Wang et al[28]在蛋白水平的研究结果一致. 当IFN-γ联合STAT1ASON作用时, STAT1和NF-κB p65也呈负相关关系.
Caspase 8是caspase家族中的重要成员之一, 在细胞凋亡及增殖中起重要作用. caspase 8基因与c-FLIP(cellular FLICE inhibitor protein)基因、caspase 10基因共同位于染色体2q33-34, 由于mRNA的差异剪接, caspase 8至少存在8种不同的异构体, 他们在凋亡中起着不同的作用. 在正常条件下, caspase 8可能参与增殖, 且存在非凋亡信号转导功能. 最近研究发现caspase 8, caspase 10和c-FLIP能够利用2个完整的死亡效应域(DED)介导NF-κB活化. 蛋白酶活性丧失的caspase 8、野生型caspase 8以及只含前结构域的caspase 8均有这一特性, 他们可能通过RIP(receptor interacting protein), NIK(NF-κB inducing kinase)和IKKa (IkB kinasea)导致NF-κB活化. IFN-γ 1000 U处理细胞后, caspase 8表达显著升高; 单独使用STAT1ASON时, 在mRNA水平caspase 8与STAT1, NF-κB p65无显著相关性, 但在STAT1ASON联合IFN-γ处理细胞时, 与STAT1负相关, 与NF-κB p65正相关, 这与Chin et al[19]及Wang et al[13]在蛋白水平的报道是一致的. 因caspase 8自身结构和作用机制较复杂, SGC7901细胞中STAT1, NF-κB与caspase 8的关系仍有待进一步研究.
本项研究结果显示, 在胃癌SGC7901细胞中, IFN-γ 1000 U能上调STAT1, NF-κB p65及caspase 8的表达, 在mRNA水平上STAT1和NF-κB p65呈负相关, caspase 8与STAT1负相关, 与NF-κB p65正相关.
胃癌是严重危害人类健康的最常见的恶性肿瘤之一, 其死亡率在我国居恶性肿瘤的第2位, 和其他恶性肿瘤一样, 原癌基因的激活、抑癌基因的突变是胃癌形成的重要分子基础之一, 但胃癌的基因异常大多缺乏特异性, 因此胃癌发生的分子机制仍然模糊不清. 近年研究发现, 细胞凋亡与细胞增殖平衡失调在胃癌发生中具有重要意义.
本文首次从理论上提出了STAT1和NF-κB是胃癌细胞凋亡调控中可能存在的分子路径, 并首次提出两者在胃癌凋亡调控中存在交汇点. 本研究重点阐述了胃癌细胞系SGC7901中 STAT1, NF-κB和 caspase 8的关系,对胃癌细胞的凋亡调控机制提供了有价值的信息. 尚需从人体组织材料和临床病理层面, 开展更为深入的研究.
本研究分别和同时使用I FN-γ及不同浓度STAT1反义寡核苷酸( STAT1ASON)处理胃癌细胞(SGC7 901), 应用RT- PCR方法检测胃癌细胞中STAT1, NF- kBp65和caspase 8在mRNA水平的变化, 以探讨STAT1,NF-kB p65及二者与凋亡因子caspase 8的相互关系及可能存在的分子机制. 研究发现, IFN-γ可上调胃癌细胞STAT1, NF- kBp65和caspase 8的表达; STAT1 和NF-kB p65呈负相关; caspase 8与STAT1呈负相关,与NF-kB p65呈正相关. 上述结果未见相关文献报道.
本文通过分子病理学的方法, 探寻NF-κB和STAT1在胃癌细胞凋亡调控中的作用, 发现在mRNA水平, IFN-g能促进 STAT1, NF-κB和 caspase 8的表达; STAT1和NF-κB在mRNA及蛋白水平呈负相关;并指出了二者与凋亡因子caspase 8之间存在一定的关系, 可望为胃癌个体化治疗提供新的思路和干预靶点.
1 信号转导子和转录活化子(STAT1): 参与调节细胞内的许多正常功能活动,如: 分化、增殖、生存、凋亡和血管发生等.2 核因子-κB(NF-κB): 在机体免疫应答、炎症反应等多种生理、病理过程中发挥重要作用, 并控制着大量基因的转录,涉及到细胞的生长分化、凋亡的调节、细胞因子产生、肿瘤转归等.
本文论述了胃癌细胞凋亡调控的机制, 其结果可能为从凋亡的调控方面进行胃癌的治疗提供了有价值的信息, 立题新颖, 设计较完整, 严密, 逻辑性较强, 资料的收集, 分析均全面、系统, 有很好的参考价值.
编辑: 何燕 电编:张敏
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] |
| 2. | Corley DA, Buffler PA. Oesophageal and gastric cardia adenocarcinomas: analysis of regional variation using the Cancer Incidence in Five Continents database. Int J Epidemiol. 2001;30:1415-1425. [PubMed] |
| 4. | Sung NY, Choi KS, Park EC, Park K, Lee SY, Lee AK, Choi IJ, Jung KW, Won YJ, Shin HR. Smoking, alcohol and gastric cancer risk in Korean men: the National Health Insurance Corporation Study. Br J Cancer. 2007;. [PubMed] |
| 5. | Hoshi T, Sasano H, Kato K, Yabuki N, Ohara S, Konno R, Asaki S, Toyota T, Tateno H, Nagura H. Immunohistochemistry of Caspase3/CPP32 in human stomach and its correlation with cell proliferation and apoptosis. Anticancer Res. 1998;18:4347-4353. [PubMed] |
| 6. | Beppu K, Morisaki T, Matsunaga H, Uchiyama A, Ihara E, Hirano K, Kanaide H, Tanaka M, Katano M. Inhibition of interferon-gamma-activated nuclear factor-kappa B by cyclosporin A: A possible mechanism for synergistic induction of apoptosis by interferon-gamma and cyclosporin A in gastric carcinoma cells. Biochem Biophys Res Commun. 2003;305:797-805. [PubMed] |
| 7. | Zhang H, Fang DC, Lan CH, Luo YH. Helicobacter pylori infection induces apoptosis in gastric cancer cells through the mitochondrial pathway. J Gastroenterol Hepatol. 2007;22:1051-1056. [PubMed] |
| 8. | Fulda S, Debatin KM. IFNgamma sensitizes for apoptosis by upregulating caspase-8 expression through the Stat1 pathway. Oncogene. 2002;21:2295-2308. [PubMed] |
| 9. | Maeda S, Yoshida H, Mitsuno Y, Hirata Y, Ogura K, Shiratori Y, Omata M. Analysis of apoptotic and antiapoptotic signalling pathways induced by Helicobacter pylori. Mol Pathol. 2002;55:286-293. [PubMed] |
| 10. | Sasaki N, Morisaki T, Hashizume K, Yao T, Tsuneyoshi M, Noshiro H, Nakamura K, Yamanaka T, Uchiyama A, Tanaka M. Nuclear factor-kappaB p65 (RelA) transcription factor is constitutively activated in human gastric carcinoma tissue. Clin Cancer Res. 2001;7:4136-4142. [PubMed] |
| 11. | Isomoto H, Miyazaki M, Mizuta Y, Takeshima F, Murase K, Inoue K, Yamasaki K, Murata I, Koji T, Kohno S. Expression of nuclear factor-kappaB in Helicobacter pylori-infected gastric mucosa detected with southwestern histochemistry. Scand J Gastroenterol. 2000;35:247-254. [PubMed] |
| 12. | Voboril R, Weberova-Voborilova J, Rychterova V, Ambrus M, Horak L, Fanta J. NF-kappaB, colorectal carcinoma and radiotherapy: results of a clinical and experimental study. Rozhl Chir. 2007;86:268-272. [PubMed] |
| 13. | Wang CY, Guttridge DC, Mayo MW, Baldwin AS Jr. NF-kappaB induces expression of the Bcl-2 homologue A1/Bfl-1 to preferentially suppress chemotherapy-induced apoptosis. Mol Cell Biol. 1999;19:5923-5929. [PubMed] |
| 15. | Bromberg J, Darnell JE Jr. The role of STATs in transcriptional control and their impact on cellular function. Oncogene. 2000;19:2468-2473. [PubMed] |
| 16. | Chen X, Vinkemeier U, Zhao Y, Jeruzalmi D, Darnell JE Jr, Kuriyan J. Crystal structure of a tyrosine phosphorylated STAT-1 dimer bound to DNA. Cell. 1998;93:827-839. [PubMed] |
| 17. | Grandis JR, Drenning SD, Chakraborty A, Zhou MY, Zeng Q, Pitt AS, Tweardy DJ. Requirement of Stat3 but not Stat1 activation for epidermal growth factor receptor- mediated cell growth In vitro. J Clin Invest. 1998;102:1385-1392. [PubMed] |
| 18. | Perkins ND. NF-kappaB: tumor promoter or suppressor? Trends Cell Biol. 2004;14:64-69. [PubMed] |
| 19. | Chin YE, Kitagawa M, Kuida K, Flavell RA, Fu XY. Activation of the STAT signaling pathway can cause expression of caspase 1 and apoptosis. Mol Cell Biol. 1997;17:5328-5337. [PubMed] |
| 20. | Xu X, Fu XY, Plate J, Chong AS. IFN-gamma induces cell growth inhibition by Fas-mediated apoptosis: requirement of STAT1 protein for up-regulation of Fas and FasL expression. Cancer Res. 1998;58:2832-2837. [PubMed] |
| 21. | Lee KY, Anderson E, Madani K, Rosen GD. Loss of STAT1 expression confers resistance to IFN-gamma-induced apoptosis in ME180 cells. FEBS Lett. 1999;459:323-326. [PubMed] |
| 22. | Ruiz-Ruiz C, Munoz-Pinedo C, Lopez-Rivas A. Interferon-gamma treatment elevates caspase-8 expression and sensitizes human breast tumor cells to a death receptor-induced mitochondria-operated apoptotic program. Cancer Res. 2000;60:5673-5680. [PubMed] |
| 23. | Morisaki T, Matsunaga H, Beppu K, Ihara E, Hirano K, Kanaide H, Mori M, Katano M. A combination of cyclosporin-A (CsA) and interferon-gamma (INF-gamma) induces apoptosis in human gastric carcinoma cells. Anticancer Res. 2000;20:3363-3373. [PubMed] |
| 24. | Zhou M, Zhang Y, Ardans JA, Wahl LM. Interferon-gamma differentially regulates monocyte matrix metalloproteinase-1 and -9 through tumor necrosis factor-alpha and caspase 8. J Biol Chem. 2003;278:45406-45413. [PubMed] |
| 25. | Hernandez A, Wang QD, Schwartz SA, Evers BM. Sensitization of human colon cancer cells to TRAIL-mediated apoptosis. J Gastrointest Surg. 2001;5:56-65. [PubMed] |
| 26. | Nam SY, Jung GA, Hur GC, Chung HY, Kim WH, Seol DW, Lee BL. Upregulation of FLIP(S) by Akt, a possible inhibition mechanism of TRAIL-induced apoptosis in human gastric cancers. Cancer Sci. 2003;94:1066-1073. [PubMed] |
| 27. | Gu Q, Wang JD, Xia HH, Lin MC, He H, Zou B, Tu SP, Yang Y, Liu XG, Lam SK. Activation of the caspase-8/Bid and Bax pathways in aspirin-induced apoptosis in gastric cancer. Carcinogenesis. 2005;26:541-546. [PubMed] |
| 28. | Wang Y, Wu TR, Cai S, Welte T, Chin YE. Stat1 as a component of tumor necrosis factor alpha receptor 1-TRADD signaling complex to inhibit NF-kappaB activation. Mol Cell Biol. 2000;20:4505-4512. [PubMed] |