20世纪末, 随着纳米科技的进步, 诞生了一类新型荧光探针-量子点. 与传统有机荧光探针相比表现出独特而优良的发光特性, 在不到10 年的时间里, 这类探针在科学研究中得到了迅速的应用. 本文对量子点荧光探针在生物医学中的应用及进展进行简要的综述.
关键词: 量子点; 纳米晶; 荧光探针; 半导体
引文著录: 黄萍, 颜仰东, 李东辉. 量子点荧光探针在生物医学研究中的应用进展. 世界华人消化杂志 2007; 15(20): 2175-2180
A review of progress in the application of quantum dots to biomedical research
Ping Huang, Yang-Dong Yan, Dong-Hui Li
Ping Huang, Dong-Hui Li, Cancer Research Center, Medical College, Xiamen University, Xiamen 361005, Fujian Province, China
Yang-Dong Yan, Kodak (Xiamen) Company Ltd, Xiamen 361005, Fujian Province, China
Supported by: National Nature Science Foundation of China, No. 90206016, Key Technology Projects in Fujian Province, No. 2001H045, Program for New Century Excellent Talents in Xiamen University and Open Topic of State Key Laboratory of Physical Chemistry of Solid Surface (Xiamen University).
Correspondence to: Dong-Hui Li, Cancer Research Center, Medical College, Xiamen University, 168 Daxue Road, Xiamen 361005, Fujian Province, China. lidh@xmu.edu.cn
Received: May 18, 2007
Revised: June 1, 2007
Accepted: June 18, 2007
Published online: July 18, 2007
0 引言
荧光检测技术由于灵敏度高、选择性好、特性参数多、动态范围宽而在诸多学科领域的研究工作中发挥着重要作用. 更由于其可高灵敏度、高选择性且直观、可视化地检测复杂生物分子集群中的特别组份而成为生命科学研究的重要工具[1-2]. 荧光检测技术应用于生命科学的研究离不开荧光探针的使用. 20世纪生命科学的快速发展对荧光探针的性能提出了更高的要求. 多种待测组份的快速、原位、实时、多色及可视化的检测越来越成为实际工作的需要, 因此, 新型荧光探针的开发一直受到人们的极大关注.
20世纪末期, 一类新型的荧光探针-量子点(quantum dot)的出现为上述问题的解决带来了曙光[3-4]. 量子点, 文献中亦常称作半导体纳米晶, 是指直径在1-100 nm的半导体纳米荧光颗粒. 尽管量子点在上世纪50年代就已出现, 但直到上世纪末, Bruchez et al[3]和Chan et al[4]解决了其水溶性和生物相容性的问题之后, 量子点的生物医学应用才成为可能. 自此以后, 量子点的研究迅速成为热点领域, 而量子点的生物医学应用尤为研究之重点.
国内外的研究工作表明, 与传统的荧光化合物相比, 量子点荧光探针具有如下显著特点: (1)发射光谱狭窄, 光谱重叠明显减小, 对于提高测定的选择性和灵敏度极为有利; (2)具有宽广的激发带, 而其发射波长可通过调整粒子径的大小进行调节, 这意味着可用同一波长的光进行激发而获得不同颜色的荧光发射, 使多组份的同时(多色)检测成为可能. 换言之, 人们可用不同粒径的纳米发光微粒进行标记, 而以同一激发波长进行激发, 对不同的待检分析物进行同时检测或观测. 纳米发光材料的这一特点对于荧光显微成像和流式细胞术技术具有特别的意义; (3)具有较高的量子产率、较大的stokes位移、优良的稳定性及抗光漂白能力(其抗光漂白能力可比传统的有机荧光染料大50-100倍). 本文拟对近年来量子点荧光探针在生物医学中的应用的进展作简要的介绍.
1 量子点的结构
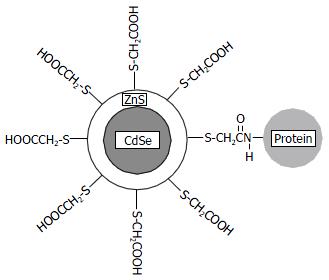
量子点是由少量的原子或分子组成的原子团簇. 国内外文献报道的主要是元素周期表中Ⅱ-Ⅵ主族如CdSe, CdTe, Ⅲ-Ⅴ主族如InP, InAs等半导体纳米晶. 应用于生物医学领域的量子点的典型结构(图1)所示[4]. 量子点通常为核壳(core-shell)结构, 核心为具有高发光效率的半导体物质(如CdSe), 外包一层硫化物(如ZnS)以进一步提高发光量子效率. 更重要的是, 外层硫化物的存在极大地提高了量子点的光化学稳定性. 因而, 与传统有机荧光探针相比, 量子点的抗光漂白能力大为增强. 核壳结构之外再通过化学方法引入活性基团如羧基, 活性基团的引入解决了两个重要问题: (1)使量子点具有水溶性; (2)使量子点具有可标记基团, 因而可与生物分子进行化学偶联.
2 生物分子相互作用研究
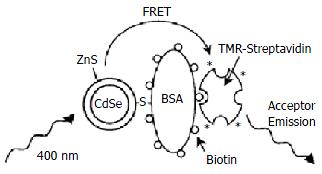
荧光共振能量转移(fluorescence resonance energy transfer, FRET)技术是研究生物分子相互作用的有力工具. 但在研究中人们也发现, 传统的有机荧光染料存在着局限性: 由于有机荧光染料的吸收谱通常较窄, 因此很难避免在对供体分子进行有效激发时同时也激发了受体分子; 另外, 有机荧光探针的发射光谱较宽且带有较长的红端拖尾, 因而常与受体的发射光发生重叠. 而纳米荧光探针(量子点)激发谱带宽、发射谱对称而狭窄且发射波长与其粒径相关, 因而可望克服有机探针所存在的上述弱点. 近来有报道[5]表明, 半导体量子点如CdSe, CdTe能够参与FRET过程, 这意味有望成为FRET的新型探针而在生物分子结构、配体受体结合等方面获得应用. 实际上, 这方面的研究已经开始, 如Willard et al[6]以具有核壳结构的CdSe-ZnS量子点与四甲基罗丹明组成FRET对, 应用于生物素化牛血清白蛋白(bBSA)与标有四甲基罗丹明的链亲和素(streptavidin)的相互作用的模型研究(图2), 获得了令人满意的结果. 他们认为, 这一工作可望得到进一步拓展而应用于抗原-抗体、DNA杂交、酶-底物的相互作用的均相研究. Yildiz et al[7]以量子点为荧光探针, 将上述原理应用于受体-底物相互作用的研究.
图2 量子点-四甲基罗丹明能量转移对应用生物分子相互作用的研究.
3 核酸分子生物学研究
3.1 核酸结构的研究
越来越多来自于X-射线晶体结构、凝胶电泳、酶环化作用以及电子显微学的实验证据表明, 核酸序列能够决定核酸的整体结构. Mahtab et al[8]提出了一种探测稀溶液中核酸结构的新方法, 他们将具有特定结构的核酸序列吸附于半导体量子点CdS上后发现, 通过量子点表面敏化发光行为可以区分"直线型"、"弯曲型"和"扭结型"的双链寡核苷酸. 这一研究工作的另一意义在于提供了一种无蛋白背景下DNA向底物弯曲的检测方法.
3.2 核酸原位杂交检测
Pathak et al[9]将长波发射的(609 nm, 利于避开背景荧光的干扰)、具有核/壳结构的CdSe/ZnS量子点标记核酸探针应用于人精子Y染色体的荧光原位杂交(fluorescence in situ hybridization, FISH)检测获得了成功. 这一工作特别值得一提的是, 作者采用了羟基衍生化的量子点代替羧基衍生化的量子点. 与羧基衍生化的量子点相比, 羟基衍生化的量子点对寡核苷酸的标记率较高, 对组织的非特异性吸附很小, 且可长期保存而没有明显的活性丧失及聚集现象发生.
3.3 端粒化作用与核酸复制动力学研究
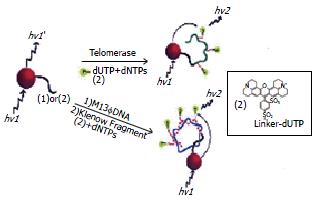
Patolsky et al[10]将发射波长为560 nm的CdSe/ZnS量子点与德克萨斯红(Texas-Red, 发射波长610 nm)组成荧光共振能量转移对用于端粒化作用与核酸复制动力学的示踪(图3).
图3 量子点在端粒化作用与核酸复制动力学研究中的应用.
下面以端粒化作用的示踪为例来说明这一方法的原理. 首先, 以具有生物相容性的CdSe/ZnS量子点标记引物, 然后与3种核苷酸(dATP, dCTP, dGTP)及经德克萨斯红标记的dUTP混合温浴, 以400 nm进行激发, 此时观察到的荧光是量子点的荧光. 然后加入端粒酶, 随着端化作用的进行, 引物逐步延伸, 德克萨斯红与量子点的距离拉近(因为标记有德克萨斯红的dUTP已经整合入DNA链中, 如图3所示), 此时可观察到量子点荧光逐步减弱而德克萨斯红的荧光逐步增强, 从而可监测端粒化作用的进程. 类似地, 也可利用这一原理跟踪M13fDNA在DNA酶(Klenow片段)作用下的复制动力学过程.
4 蛋白质研究与分析
量子点在蛋白质检测与研究中的应用近年来引起了人们很大的兴趣. 由于量子点具有优异的光物理性质, 且其尺度相对较小, 因而可用作研究生物学过程(包括膜或胞质)的超灵敏荧光探针. Courty et al[11]对量子点示踪活细胞中蛋白质单分子动力学的方法学进行了详细的介绍(从标记技术到量子点的运动的观测). Choi et al[12]设计了基于量子点荧光共振能量转移的蛋白质纳米传感器. Bakalova et al[13]则将量子点应用蛋白质印迹以检测痕量蛋白. Ghazani et al[14]将组织微阵列技术、光谱分析技术与量子点相结合, 发展了一种用于定量测定肿瘤中蛋白表达的新方法, 他们认为, 这一方法对改善肿瘤诊断与治疗效果有着潜在的积极意义. Ravindran et al[15]将量子点用于植物黏附蛋白的定位, 并通过与传统的免疫荧光染色技术的结果相比, 证明了量子点在实际应用中的优势. Dahan et al[16]报道了利用量子点观察活细胞中单个蛋白质分子的动力学行为.
5 免疫学检测
量子点在免疫学检测中的应用已有较多报道. 如Sun et al[17]羧基衍生的CdSe/ZnS量子点兔抗人IgG, 以玻璃为抗体载基形成阵列芯片, 采用夹心型反应并通过激光扫描共聚焦显微镜检测人IgG. Wu et al[18]采用两种量子点(发射波长分别为535和630 nm)标记抗体, 结合免疫组化技术检测Hera2(一种在乳腺癌细胞表面过度表达的肿瘤标志物). Goldman et al[19]成功地将量子点和抗体偶联物用于大分子(蛋白质毒素)和小分子(三硝基甲苯)的荧光免疫检测. 在后续工作中[21], 他们将4种颜色的量子点成功地应用于4种毒素(霍乱毒素、蓖麻毒蛋白、志贺样毒素、葡萄球菌肠毒素)的同时检测. Lingerfelt et al[20]则将生物素化的量子点与免疫亲和层析技术相结合, 用于蛋白质毒素的检测, 最低检出浓度可达10 g/L. Chattopadhyay et al[22]将半导体量子点与多色流式细胞术相结合, 用于免疫分型研究. Wu et al[23]则将量子点偶联物应用于荧光免疫组化技术. Ziring et al[24]则将多色发射量子点用于肠炎疾病的免疫学检测.
6 细胞生物学研究
用于细胞生物学研究是量子点在生物医学领域中应用最早也是最成功的领域之一. 早期的应用主要有固定细胞和组织的免疫荧光标记. 如细胞膜蛋白[25]、肌动蛋白[3]、微管及核抗原[26]等. 近年来, 量子点在细胞生物研究应用领域得到进一步拓宽, 其在活细胞的研究中的应用尤为引人注目. 如: (1)全细胞标记[27]. 在细胞或病原体检测、细胞示踪、细胞谱系研究等工作中, 人们对全细胞的量子点标记特别有兴趣; (2)受体与配体的相互作用研究[28].
7 动物活体成像
量子点的光化学稳定(强抗光漂白能力)及高亮度(荧光强度高)使其成为理想的动物活体定位与靶向成像的荧光示踪剂. Dubertret et al[29]以磷脂包埋的方式制备了具有生物相容性的量子点, 并应用于体内、体外研究. 在体内研究中, 他们将这种量子点直接注射非洲爪蟾的胚胎中, 可用于胚胎发育全过程的示踪. Larson et al[30]以量子点为荧光示踪剂, 结合双光子激光扫描共聚焦显微术, 对活体动物的血管成像进行了多方面研究, 结果显示, 无论是对比度还是观测纵深都明显优于传统的有机荧光染料. Ballou et al[31]对量子点在小鼠体内长时活体成像进行了研究, 并指出包被高分子量的聚乙二醇可避免量子点的聚集, 这对于长时成像十分有利. Gao et al[32]则将功能化量子点用于动物恶性肿瘤的靶向定位和体内成像.
8 生物传感
8.1 用于分子、离子的传感
如前所述, 量子点可与分子光谱匹配的有机荧光染料组成荧光共振能量转移对. 这一原理也被用于某些生化分子的传感. 如Medintz et al[33]以发绿色荧光(560 nm)的量子点标记麦芽糖结合蛋白, 以有机荧光染料QSY-9(其最大吸收在565 nm)标记β-环糊精, 组成荧光共振能量转移对. 在有麦芽糖存在时, 二者之间的能量转移过程被破坏, 量子点的荧光得以恢复. 据此, 实现了对麦芽糖的均相传感. Nechyporuk-Zloy et al[34]将双色量子点标记技术应用于钾离子通道的检测, 获得了满意的结果.
8.2 生物传感新模式
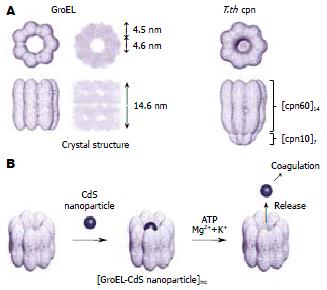
伴侣蛋白GroEL由2个超分子环形成双层结构, 包含一个直径4.5 nm的圆柱型凹穴, 正好可以容纳一个量子点. Ishii et al[35]发现, 在伴侣蛋白GroEL-量子点复合物中加入ATP, 并在Mg2+, K+的存在下, 蛋白分子发生构型改变而将量子点释放出来(图4). 正如量子点专家聂书明教授所说, 日本科学家的这一研究工作"为量子点的生物学应用开辟了新的道路, 人们有可能因此设计出新的生物传感器".
9 量子点荧光编码技术
量子点派生技术一个令人兴奋的进展是近年出现的发光编码微球[36]. Han et al将量子点包埋于高分子(聚苯乙烯)微球中, 制成强度与发射波长可调的发光微球. 这种发光微球具有如下特点: (1)强度可调. 通过控制原料比例, 可以调节包埋于微球中的纳米晶体的数量, 从而使不同种类的微球具有不同的荧光发射强度, 如可以获得10个强度级别的纳米微球; (2)发射波长可调. 如前所述, 由于纳米发光微粒(量子点)的发射波长与其粒径大小有关, 因此, 将不同粒径的纳米发光微粒(1种或几种)包埋于微球中, 即可获得具有不同发射波长(颜色)特性的发光微球; (3)控制合适的反应条件, 可获得粒径均匀的发光微球. 由于发光微球的强度与发射波长具有多重性(即可调), 通过二者之间的组合, 可获得大量的、具有不同荧光发射强度与发射波长特性的微球[可获得的微球种类数目为nm-1, n为可调的强度级别数目, m为可调的波长(颜色)数目], 即每种(或每个)发光微球的发光性各有差别. 如将发光微球的这种特性应用于生物示踪, 则每种(或每个)发光微球可标记不同的生物分子(如, 不同的抗原、抗体或序列不同的核酸探针), 即可对不同的生物分子进行编码标识, 并应用于靶目标(抗体、抗原、受体、核酸等)的检测. 以纳米发光微粒标记的发光微球的这种独特性质使其在理论上可以编码上百万个核酸或蛋白质序列. 为生命科学研究尤其是基因表达、高通量扫描、医学诊断提供崭新的检测手段, 具有巨大的应用潜力. 如Mattneakis et al[37]和Lagerholm et al[38]将上述编码技术用于多细胞的平行分析.
10 展望
量子点发展的历史并不长, 而其在解决了水溶性和生物相容性的问题后应用于生命科学研究领域只有短短的不到10 年的时间, 但进展却十分迅速. 其应用领域涉及生物化学与分子生物学、免疫学、细胞生物学、发育生物学等主要学科, 研究对象涉及从微观到宏观的各个层次(离子、亚分子、分子、细胞、组织、胚胎、大体). 这表明, 作为一种与传统有机荧光探针相比具有独特优点的新型荧光探针, 量子点荧光探针尽管不能取代技术成熟的有机荧光探针和荧光融合蛋白技术, 但可与二者相互补充, 极大地丰富了荧光探针家族, 促进了荧光探针技术的发展. 量子点正在全面而深入地介入生命科学问题的研究中, 越来越广泛地引起生命科学领域科学工作者的兴趣与重视. 我们有理由相信, 随着量子点科学的进一步发展, 其在生命科学领域将具有更加广阔的应用空间, 也将为生命科学的发展做出更多的贡献.
评论
背景资料
随着纳米科技的进步, 科技工作者在20世纪末发现了一类性质优良而独特的新型荧光探针—量子点. 在不到10 a的时间里, 这类探针在科学研究尤其是生物医学研究中得到了迅速的应用. 量子点荧光探针与传统荧光探针相互补充, 显著增加了荧光探针的种类, 丰富并发展了荧光探针技术, 展示了其在生命科学领域广阔的应用前景.
研发前沿
量子点在细胞及动物的活体、实时、原位示踪与成像中的应用是当前以及今后很长一段时间的研究热点. 而利用量子点多色发射的特性进行多指标同时定性、定量的检测也十分令人关注. 须重点解决的问题是具有可标记基团的量子点的规模化制备技术, 以显著降低应用成本.
应用要点
与国际上的先进水平相比, 国内在量子点的生物医学应用方面所做的研究工作存在明显差距, 本综述也许可提供一些参考或启发, 对于国内相关工作的开展是有益的.
名词解释
量子点: 文献中亦常称作半导体纳米晶, 是指直径在1-100 nm的半导体纳米荧光颗粒.具有: (1)发射光谱狭窄, 光谱重叠明显减小, 对于提高测定的选择性和灵敏度极为有利. (2)宽广的激发带, 而其发射波长可通过调整粒子径的大小进行调节, 这意味着可用同一波长的光进行激发而获得不同颜色的荧光发射, 使多组份的同时( 多色) 检测成为可能. (3)较高的量子产率、较大的s toke s位移、优良的稳定性及抗光漂白能力.
同行评价
本文对量子点荧光探针在生物医学研究中的作用进行了综述, 内容新颖, 论述全面, 行文流畅, 具有潜在的应用价值.