修回日期: 2006-11-01
接受日期: 2006-11-10
在线出版日期: 2007-01-18
目的: 探讨烧、烫伤应激对胃动力的影响以及相关神经肽的变化.
方法: 应用便携式消化道动力监测仪记录烧、烫伤患者急性期胃动力的改变, 放免法检测胃肠动力相关神经肽-CCK-8、VIP、SS、GAS含量变化; 于大鼠胃窦部缝置应力传感器, 制备烫伤应激模型. 记录应激前后大鼠胃动力的变化及血浆内VIP和CCK-8含量的改变, 观察应激前后静脉插管内给予VIP和CCK-8后胃动力变化.
结果: 与对照组比较, 烧伤患者正常胃运动节律消失, 代之以时程不定的运动静止或低振幅收缩、无规律高频率收缩及爆发活动; 血中CCK-8、SS、GAS含量显著升高(5.63± 1.31 ng/L vs 1.84±0.87 ng/L, P<0.05; 235.36 ±49.72 ng/L vs 50.70±12.62 ng/L, P<0.01; 124.16±28.6 ng/L vs 49.71±15.57 ng/L, P<0.01), VIP含量明显降低(19.87±7.26 ng/L vs 35.44±14.81 ng/L, P<0.05). 正常大鼠禁食状态, 胃运动呈规则的相对静止期、收缩期交替的变化. VIP可抑止正常大鼠胃运动, CCK-8明显加强胃的收缩. 应激使大鼠胃窦的规则收缩消失、运动加强; VIP对增强的胃运动有明显的抑制效应; 大鼠血浆内VIP含量在应激后1, 2 h显著升高(165.21±58.29 vs 40.42±16.36, P<0.01; 89.78±32.36 vs 48.92±13.65, P<0.05), CCK-8含量于应激后即刻升高(8.95 ±2.84 vs 4.11 ± 1.74, P<0.05), 随后恢复正常.
结论: 烧伤应激可致胃动力紊乱及体内胃肠动力调节相关神经肽分泌改变, 后者对应激状态下的胃动力有调节作用.
引文著录: 刘婧, 李兆申. 烧伤应激对胃动力的影响. 世界华人消化杂志 2007; 15(2): 134-139
Revised: November 1, 2006
Accepted: November 10, 2006
Published online: January 18, 2007
AIM: To investigate the effect of burn stress on gastric motility as well as the changes of related neuropeptides.
METHODS: Radioimmunological assay was performed to detect the dynamic changes of related neuropeptides, including CCK-8, vasoactive intestinal peptide (VIP), somatostatin (SS), and gastrin (GAS) in patients with burn injury and healthy volunteers using ambulatory manometry. Strain-gauge transducers were pre-equipped at the antrum of rats to establish the models of burn injury (30% full skin scalding), and gastric motility and the changes of plasma VIP and CCK-8 contents were recorded before and after modeling. Exogenous peptides (VIP, CCK-8) were intravenously administrated to determine the gastric motor responses.
RESULTS: There were no complete migrating motor complex (MMC) cycles in burn patients. Interdigestive and postprandial gastric motility patterns were mainly resting state without constant phase or with low ampulitude contraction, persistent and irregularly high-frequency contraction and propagated burst activity. In patients with burn injury, the plasma levels of CCK-8, SS, and GAS were significantly higher than those in the controls (5.63 ± 1.31 ng/L vs 1.84 ± 0.87 ng/L, P < 0.05; 235.36 ± 49.72 ng/L vs 50.70 ± 12.62 ng/L, P < 0.01; 124.16 ± 28.6 ng/L vs 49.71 ± 15.57 ng/L, P < 0.01), while the level of VIP was significant lower than that in the controls (19.87 ± 7.26 ng/L vs 35.44 ± 14.81 ng/L, P < 0.05). In fasting rats, gastric motor activity was regular with resting and contractile states before stress. VIP inhibited gastric motility whereas CCK-8 enhanced it. The regularity of gastric motility was destroyed and the motor activity was increased after stress. However, VIP inhibited the enhanced gastric motility. The plasma level of VIP rose in 1 and 2 hours (165.21 ± 58.29 ng/L vs 40.42 ± 16.36 ng/L, P < 0.01; 89.78 ± 32.36 ng/L vs 48.92 ± 13.65 ng/L, P < 0.05), whereas the contents of CCK-8 was immediately increased (8.95 ± 2.84 vs 4.11±1.74, P < 0.05) and then returned to the normal level after stress.
CONCLUSION: Burn stress can lead to disorders of gastric motility and plasma level changes of gastrointestinal motility associated neuropeptides, which may modulate gastric motility.
- Citation: Liu J, Li ZS. Effect of burn stress on gastric motility. Shijie Huaren Xiaohua Zazhi 2007; 15(2): 134-139
- URL: https://www.wjgnet.com/1009-3079/full/v15/i2/134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i2.134
有研究证明, 各种程度的创伤作为躯体应激的一种, 可致胃排空、结肠传送功能异常[1-2]. 说明各种创伤作为应激源有致胃肠动力紊乱的可能, 而不同的研究对象、研究方法得到的结论并不一致[3-6]. 我们以中重度烧、烫伤为应激源, 研究创伤应激对胃动力的影响, 并初步探讨严重烧、烫伤致胃肠动力紊乱的原因.
长海医院就诊的8例中重度烧、烫伤患者(创伤面积20%-70%)为病例组, 男3例, 女5例. 年龄21-35(平均28.80±7.66)岁. 均因烧伤、烫伤24 h内急诊入院. 入院后患者意识清醒, 询问病史, 排除以下情况: (1)器质性胃肠病变, 有消化性溃疡病史或腹部手术史; (2)习惯性便秘; (3)慢性腹泻; (4)全身性代谢系统、内分泌系统、神经系统疾病或精神病; (5)近期服用影响胃肠道运动的药物. 10例健康志愿者为对照组, 其中男12例, 女8例, 平均年龄(30.78±10.80)岁. 排除情况同病例组. 便携式消化道动力监测仪(瑞典CTD-synectics Medical公司)包括一根三腔固态导管(长210 cm, 口径2.5 cm, 内含微型换能器3个, 分别距离管端5, 10, 15 cm), 便携式数据自动记录器, 计算机分析处理系统. ♂SD大鼠12只, 体质量180-220 g (上海西普尔-必凯实验动物有限公司提供).
1.2.1 患者和健康志愿者胃动力监测: 插管前, 把测压导管和数据自动记录器连接, 在装有37℃水的立式圆筒中校准两个固定压力水平(0和6.7 kPa). 清晨8时插入导管并在X-线透视下将远端换能器定位于十二指肠内, 近端和中间两个换能器定位于胃窦部. 定位后, 导管固定于鼻侧. 健康对照者在监测期间尽量避免下床活动, 对照者和患者于病床上可行必要的肢体活动. 实验对象分别于11时、17时食用统一标准的中餐和晚餐, 在研究期间不允许食用其他食物. 通过便携式数据记录器上的时间按钮记录准确的用餐时间、症状、卧床和起床时间(患者可由床边特护人员帮助记录). 次日8时透视确定导管位置后取出导管. 将数据自动记录器与计算机连接, 资料存盘, 以备分析.
1.2.2 患者和健康志愿者相关神经肽含量测定: 中重度烧、烫伤患者伤后4 h左右急诊入院, 共14例, 其中烧伤6例, 烫伤8例, 入急诊室后, 即刻收集患者静脉血3 mL置于预冷的含1 g/L肝素30 mL, 抑肽酶(25005 nkat/L)的塑料指形管中, 混匀后离心(3000 r/min, 15 min), 吸取上层血浆移入另一指形管, 置-20℃冰箱内冷冻待测. 另在相同时间点采集健康志愿者血标本(n = 14), 作为基础对照. 取血浆标本置聚苯乙烯放射免疫测定管中, 分别加入100 mL I125(美国Amersham公司产品)标记的CCK, VIP, SS, GAS (8000-12000 cpm)(美国Aalky研究所产品), 再分别加入各抗血清100 mL (第二军医大学神经生物学教研室制备), 最后加PELH缓冲液使最终反应体积为500 mL. 置4℃环境24 h, 测定各管总cpm后, 加入2%加膜活性碳溶液300 mL, 混合后迅速离心(4000 r/min, 5 min), 弃上清, 测定沉淀的cpm值(F), 计算各管B/T值, 根据同批实验的标准曲线, 分别查出各神经肽的含量, 换算成每毫升血浆中的含量.
1.2.3 实验动物及模型制作: 实验前均行颈静脉插管, 按周吕 et al[7]的方法于胃窦部浆膜面缝置一应力传感器(中国医学科学院基础医学研究所提供). 术后3 d用于实验, 期间饮食、饮水、活动均不限. 实验组大鼠背部剃毛, 浸入90℃水中10 s造成30% TBSAⅢ度烫伤, 于伤后0.5 h进行实验. 为消除生物节律对实验结果的影响, 均于上午8时开始实验.
1.2.4 应激前后大鼠胃运动的观察: 实验前禁食12-18 h, 分别于对照期和应激期(相隔24 h〕记录大鼠清醒状态下胃收缩活动2 h. 计算单位时间(每10 min)胃窦的收缩频率、振幅. 胃收缩波的振幅以收缩力N表示, 按已报道的方法定标[2]. 并计算动力指数(MI = 单位时间内收缩次数×平均振幅). 比较应激状态与基础状态下相应指标百分比(%).
1.2.5 VIP与CCK-8对大鼠胃运动的调节作用: 清醒状态下记录大鼠胃运动, 应激前后先于颈静脉插管内注入生理盐水0.2 mL作为自身对照, 30 min后随机注入各种剂量的血管活性肠肽(VIP)(100, 200, 400, 800 ng/kg), 胆囊收缩素-8(CCK-8)(50, 100, 200, 400 pmol/kg)(Sigma公司), 每个剂量注入后观察10 min, 间隔30 min后用另一剂量, 一种肽注入结束后2 h, 注入另一种肽. 观察应激前后胃运动对胃肠肽的反应.
1.2.6 应激后血浆VIP和CCK-8含量测定: 另取SD大鼠60只, 随机分为应激组和对照组. 应激组于应激后即刻, 1, 2, 4, 6 h分别断头取血(每组动物6只). 对照组大鼠也按5个时间点分为5个亚组, 每组6只, 不做任何处理, 在相同5个时间点同时断头取血. 用放射免疫法测定血浆VIP和CCK-8含量.
统计学处理 数据用mean±SD表示, 采用组间比较的t检验.
烧伤患者胃动力及血中神经肽含量改变空腹状态对照组研究期间, 每例至少可以记录到两个完全的消化道运动周期即MMC周期, 共42个. 包括Ⅰ相: 运动静止期, 时程50.50±17.56 min, 之后为Ⅱ相: 不规则收缩期, 时程43.40±14.87 min, 收缩频率1.07±0.48次/min, 平均振幅6.77±2.13 kPa, 最后为Ⅲ相: 强力收缩期, 时程6.58±1.70 min, 振幅153.69±5.71 kPa, 收缩频率胃窦部为2.96±0.30 次/min. 每个MMC周期Ⅲ相的时程、频率相对稳定. 10例受试者检测期间记录到1次爆发活动. 与对照组比较, 8例中重度烧伤患者日间、夜间均无完整的MMC周期出现, 胃、十二指肠运动形式表现各异, 主要有: (1)时程不等的运动静止(9 min-1.3 h); (2)无规律的持续高频率收缩, 时程1.27-8.70 h不等, 频率2.5-12.0次/min, 有时收缩频率、振幅比较一致, 有时表现为高振幅、低振幅收缩交替出现, 每段平均振幅2.75-47.81 kPa不等; (3)爆发活动: 为短暂、高频、高振幅收缩. 8例共有34次, 每次持续约54.67±4.76 s, 收缩频率14.10±2.63 次/min, 平均振幅19.04±1.25 kPa, 可于持续收缩之中、之后出现, 也可于静止期突然发生, 且发生频繁. 爆发活动有顺行传送(5次), 但多为反向传送(13个)、同时发生(16个). 有的患者爆发活动持续存在一段时间. 餐后状态, 对照组餐后表现为规律、持续、较低振幅收缩, 餐后30 min内胃窦平均收缩频率2.44±0.76 次/min, 振幅5.37±0.96 kPa, 烧伤患者餐后胃窦运动以较低振幅收缩为主2.64-7.47 kPa, 频率1.2-12次/min, 多伴有同时发生或逆向传播的爆发活动. 对照组有3例, 在检测期间有轻微恶心, 能耐受, 不伴有运动异常. 而烧伤组8例患者均主诉腹部不适感, 腹痛4例, 恶心6例, 呕吐3例, 腹胀3例. 不适感往往持续存在, 因例数较少不能看出症状发作和运动异常之间的关系. 每例患者可能以某种异常运动形式表现为主, 但往往多种异常表现同时存在, 时程、振幅、频率变异较大, 无规律可寻.
烧伤患者血浆内神经肽含量变化与对照组比较, 创伤后患者血中CCK-8、生长抑素(SS)、胃泌素(GAS)含量显著升高(P<0.05), VIP含量明显降低(P<0.05)(表1).
正常大鼠禁食状态胃运动呈现明显时相性, 即出现交替变化的相对静止期(10-15 min)和收缩期(3-5 min). 应激后大鼠胃窦收缩显著增强, 规律性的周期性变化消失, 呈现高频率、高振幅收缩. 计算MI烧伤前为32.9±8.3 g/10 s, 烫伤后10 min、90 min动力指数分别为70.4±12.5 g/10 s, 65.8±10.3 g/10 s, 与应激前比较相差显著(P<0.05).
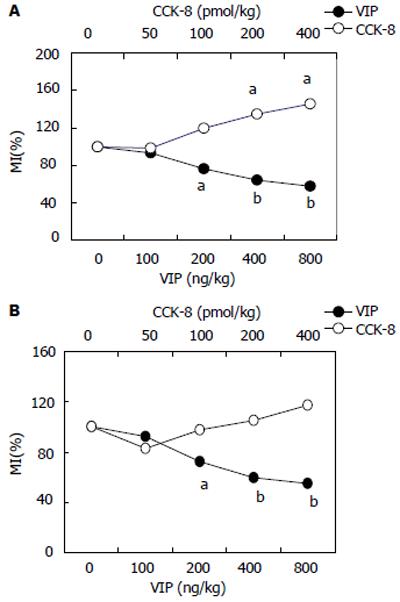
外源性VIP, CCK-8引起的胃动力反应应激前后静脉内注入生理盐水, 胃窦运动没有改变; 对照期大鼠静脉内注入不同剂量的VIP和CCK-8, 1 min内即可引起不同的胃动力反应, 均呈剂量依赖性. 其中VIP在收缩期开始出现时给药, 可使胃窦收缩频率与振幅明显降低, 相对静止期延长, 呈明显抑制效应(P<0.05). CCK-8在胃窦收缩末期或相对静止期给药, 可使胃运动相对静止期消失, 呈现高频率收缩, 每次较高振幅收缩波上往往叠加更小的收缩波, 收缩指数明显大于对照组(P<0.05); 应激后静脉给予VIP对增强的胃动力仍呈明显抑制效应(P<0.05); 而静脉给予CCK-8改变应激大鼠胃动力的作用则不明显(P>0.05)(图1).
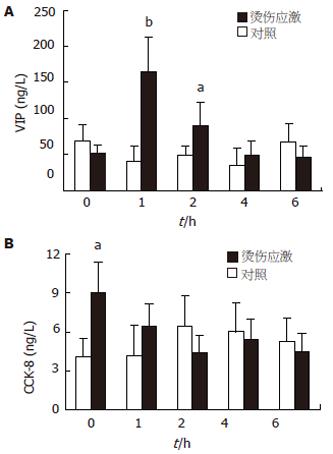
对照组各时间点间的变化无显著性差异(P>0.05). VIP含量在应激后即刻无明显变化, 1 h后显著高于对照组(P<0.01), 随后逐渐下降, 至伤后4 h虽仍高于对照组, 但无统计学意义(P>0.05); CCK-8含量在大鼠应激后即刻显著升高(P<0.05), 1 h后不再有显著变化(图2).
本研究先是应用便携式动力监测仪, 在一个相对长的时间内观察中重度烧伤患者急性期胃动力的变化. 不但获得了大量信息, 同时也通过数字记录系统反映症状和动力异常之间的关系. 从记录结果可以看到: 健康人群胃、十二指肠消化间期呈现规则的运动复合周期(MMC), 餐后表现为低振幅、不规则收缩. 这种规律、协调运动对于维持胃肠的正常生理功能是十分必要的[8-12]. 中重度烧伤患者急性期胃运动节律明显紊乱. 尽管烧伤患者胃运动形式也有运动静止期、不规则收缩期以及高频、高振幅收缩, 但相互之间的变化无规律可寻, 且每种运动形式持续时间、发生频率、收缩幅度和对照组比较明显不同, 患者同时出现腹痛、恶心、呕吐等症状.
为使创伤的类型和强度得到统一, 本研究利用大鼠制作烫伤应激模型, 人为控制各种条件. 实验发现: 正常大鼠禁食状态下, 胃窦收缩呈规则的收缩相和相对静止相, 类似于人胃、十二指肠运动的移行性MMC. 而应激后大鼠胃窦运动的规则收缩消失, 节律明显紊乱, 胃窦运动呈增强趋势. 这是机体对急性创伤产生的应激反应. 动物及临床实验均发现烧、烫伤应激致胃的无规则运动加强, 使胃的各部不能协调收缩, 会导致胃对食物的排空延迟, 这将影响到患者营养摄入、吸收及药物治疗[13-18].
烧伤急性期胃动力紊乱、可能是应激致全身反应的一部分. 因为应激可使调节胃肠运动的中枢自主神经系统、局部神经系统、交感、副交感神经功能性失衡或紊乱. Alican et al[14]研究烫伤大鼠对不同试餐的胃排空率, 认为烫伤应激以后主要是交感神经兴奋性增高而使高渗液的胃排空延迟. 同时, 创伤应激可导致机体中枢或外周释放大量的应激激素, 肾上腺素、去甲肾上腺素、前列腺素等可通过改变胃肠道粘膜的微循环, 使肠道的营养、代谢发生障碍, 干扰胃肠肌电、机械活动. b-内啡肽、血管加压素、胃动素、胆囊收缩素等直接抑制或加强胃肠运动的神经肽分泌失衡, 也会导致胃肠动力紊乱[19-22]. Smith et al研究烧伤程度和应激的关系, 认为烧伤越严重, 应激越强, 对体内激素的影响也越大. 此外, 烧伤以后的失血、脱水、治疗不当等可致体内水电平衡紊乱, 也会影响消化道的运动功能. 所以烧伤后胃肠动力的改变可能是多因素的结果. 其中应激使中枢及胃肠壁从神经系统中某些神经肽(CCK, VIP, SS, GAS)的释放及相应受体发生变化, 对胃肠运动起调节作用[23-24]. CCK-8、GAS对胃肠运动主要起促进作用, 而VIP、SS主要起抑制胃肠运动的作用, 但不同生理、病理条件下, 神经肽对胃肠道不同部位的作用并不一致, 例如CCK-8促进胃窦收缩的同时, 可舒张胃体而延缓胃排空[25-26]. 人或动物是一个有机的整体, 只有各种胃肠肽的分泌在体内达到协调统一, 才能保证胃肠道正常的运动生理功能. 我们临床及动物实验资料证实创伤后与胃肠运动调节相关的神经肽含量明显变化, 表明神经肽作为体内重要的调节介质可能参与了创伤后胃肠动力紊乱的病理过程. 但是同作为抑制性胃肠肽, 血浆内SS含量升高, VIP含量降低, 可能某些肽的变化有负反馈调节的作用, 从而使胃肠运动恢复相对协调状态.
VIP是体内非肾上腺素能、非胆碱能抑制性神经介质, 他与胃肠道的靶细胞受体结合后, 激活cAMP依赖性蛋白激酶, 对胃肠运动起抑制性调节作用. CCK与胃肠道平滑肌细胞膜上的受体结合后, 激活Ca2+依赖性蛋白激酶发挥对胃肠运动的调节作用[27-28]. 我们通过动物实验证实了, VIP和CCK-8外周静脉给药对胃窦收缩呈明显抑制效应及兴奋效应, 说明外周血浆内神经肽改变可对胃肠运动产生影响. 因VIP, CCK-8半衰期很短, 在体内代谢迅速[6], 本实验给药方式可基本排除累积给药对胃动力的作用, 但并不排除创伤应激及给药过程中的全身反应对胃动力的影响. 同时证实, 应激创伤后大鼠体内VIP, CCK-8含量呈动态变化, 这可能与机体的应激反应相适应. 应激初期, CCK-8分泌增加, 可致胃动力紊乱, 随着机体的调节, CCK-8分泌减少, 作用相对减弱, 局部抑制性神经肽VIP分泌增强, 对胃动力紊乱有负反馈调节作用. 应激状态下, 外源性VIP对胃窦的强烈收缩仍呈明显抑制效应, 对应激后增强的胃肠运动可起抑制、调节作用. 而外源性CCK-8对于应激状态下强烈收缩的胃窦, 在实验剂量范围内既无明显兴奋效应也无明显抑制效应. 这一方面可能是全身反应引起神经系统的调节作用, 另一方面可能是其他神经肽增强、拮抗的结果[29-30]. 这对于维持胃肠道正常运动生理功能有重要意义
当机体遭受各种重创(外伤、灼伤、失血等)后, 常出现胃肠道症状, 表现为腹痛、恶心、呕吐,重者发生消化道出血, 影响患者预后. 各种消化道症状的出现认为与创伤应激后胃肠道动力紊乱关系密切.
目前关于胃肠道动力调节的机制一直是该领域研究热点, 创伤应激后脑肠肽的变化发挥了关键作用. 关于各种脑肠肽分泌的调节及相互作用是亟待继续研究的方向.
应用压力传感器直接对烧伤患者进行胃肠动力监测, 并通过临床及动物实验观察烧伤后神经肽分泌的动态变化, 国内尚未见报道.
对临床上烧伤及其他创伤应激后患者胃肠道症状发生的机制及进一步防治提供理论依据.
该论文研究了烧伤后胃动力学的变化以及一些神经递质对其的影响, 有一定新意, 实验设计合理, 对临床创伤应激后胃肠道功能性疾病的防治有一定指导意义.
电编: 李琪 编辑: 张焕兰
| 1. | Wang SX, Wu WC. Effects of psychological stress on small intestinal motility and bacteria and mucosa in mice. World J Gastroenterol. 2005;11:2016-2021. [PubMed] [DOI] |
| 2. | Mistiaen W, Blockx P, Van Hee R, Bortier H, Harrisson F. The effect of stress on gastric emptying rate measured with a radionuclide tracer. Hepatogastroenterology. 2002;49:1457-1460. [PubMed] |
| 3. | Puckett JL, Bhalla V, Liu J, Kassab G, Mittal RK. Oesophageal wall stress and muscle hypertrophy in high amplitude oesophageal contractions. Neurogastroenterol Motil. 2005;17:791-799. [PubMed] [DOI] |
| 4. | Mönnikes H, Tebbe JJ, Hildebrandt M, Arck P, Osmanoglou E, Rose M, Klapp B, Wiedenmann B, Heymann-Mönnikes I. Role of stress in functional gastrointestinal disorders. Evidence for stress-induced alterations in gastrointestinal motility and sensitivity. Dig Dis. 2001;19:201-211. [PubMed] [DOI] |
| 5. | Datta UK. Effect of heat stress on gastro-intestinal motility in young albino rats. Indian J Physiol Pharmacol. 2001;45:222-226. [PubMed] |
| 6. | Verleye M, Gillardin JM. Effects of etifoxine on stress-induced hyperthermia, freezing behavior and colonic motor activation in rats. Physiol Behav. 2004;82:891-897. [PubMed] [DOI] |
| 9. | 戴 菲, 龚 均, 罗 金燕, 董 蕾, 朱 有玲, 王 学勤. 胃肠激素与十二指肠胃反流及消化间期胃肠移行性复合运动的关系. 西安交通大学学报•医学版. 2004;25:257-260. |
| 11. | Jonderko K, Krusiec-Swidergoł B, Mazur W, Kasicka-Jonderko A, Gonciarz M, Błońska-Fajfrowska B, Gonciarz Z. Effect of single-dose administration of recombinant interferon-alpha2b on gastric myoelectrical activity in patients with chronic hepatitis C. J Gastroenterol. 2004;39:1035-1044. [PubMed] [DOI] |
| 12. | Cullen JJ, Ephgrave KS, Caropreso DK. Gastrointestinal myoelectric activity during endotoxemia. Am J Surg. 1996;171:596-599. [PubMed] [DOI] |
| 13. | Ives A, Muller M, Pegg S. Colonic pseudo-obstruction in burns patients. Burns. 1996;22:598-601. [PubMed] [DOI] |
| 14. | Alican I, Coşkun T, Yeğen C, Aktan AO, Yalin R, Yeğen BC. The effect of thermal injury on gastric emptying in rats. Burns. 1995;21:171-174. [PubMed] [DOI] |
| 16. | Gan HT, Chen JD. Roles of nitric oxide and prostaglandins in pathogenesis of delayed colonic transit after burn injury in rats. Am J Physiol Regul Integr Comp Physiol. 2005;288:R1316-R1324. [PubMed] [DOI] |
| 17. | Musselius IuS, Mikhel'son VA, Stepanenko SM, Beliaeva ID, Lazarev VV, Popova TS. [Nutritional therapy in children during perioperative period]. Anesteziol Reanimatol. 2004;42-46. [PubMed] |
| 18. | Unlüer EE, Alican I, Yeğen C, Yeğen BC. The delays in intestinal motility and neutrophil infiltration following burn injury in rats involve endogenous endothelins. Burns. 2000;26:335-340. [PubMed] [DOI] |
| 19. | 王 少根, 陈 侠英, 王 立基, 汪 昌荣, 徐 凡. 严重烫伤休克期肠道运动功能的改变及意义. 中国中西医结合脾胃杂志. 2000;8:80-82. |
| 20. | Tian XY, Bian ZX, Hu XG, Zhang XJ, Liu L, Zhang H. Electro-acupuncture attenuates stress-induced defecation in rats with chronic visceral hypersensitivity via serotonergic pathway. Brain Res. 2006;1088:101-108. [PubMed] [DOI] |
| 21. | Nakade Y, Tsuchida D, Fukuda H, Iwa M, Pappas TN, Takahashi T. Restraint stress delays solid gastric emptying via a central CRF and peripheral sympathetic neuron in rats. Am J Physiol Regul Integr Comp Physiol. 2005;288:R427-R432. [PubMed] [DOI] |
| 22. | Ito M, Nakashima M, Nakayama T, Shikuwa S, Ohtsuru A, Sekine I. Preventive effects of parathyroid hormone-related peptide on stress-induced gastric hypercontraction in the rat. J Gastroenterol Hepatol. 2002;17:1260-1266. [PubMed] [DOI] |
| 25. | Cao SG, Wu WC, Han Z, Wang MY. Effects of psychological stress on small intestinal motility and expression of cholecystokinin and vasoactive intestinal polypeptide in plasma and small intestine in mice. World J Gastroenterol. 2005;11:737-740. [PubMed] [DOI] |
| 26. | Whited KL, Thao D, Lloyd KC, Kopin AS, Raybould HE. Targeted disruption of the murine CCK1 receptor gene reduces intestinal lipid-induced feedback inhibition of gastric function. Am J Physiol Gastrointest Liver Physiol. 2006;291:G156-G162. [PubMed] [DOI] |
| 27. | Keller J, Mueller-Wolf JC, Ahmadi-Simab K, Fibbe C, Rosien U, Layer P. Do elevated plasma vasoactive intestinal polypeptide (VIP) levels cause small intestinal motor disturbances in humans? Dig Dis Sci. 2005;50:276-282. [PubMed] [DOI] |
| 28. | Miyasaka K, Ohta M, Kanai S, Yoshida Y, Sato N, Nagata A, Matsui T, Noda T, Jimi A, Takiguchi S. Enhanced gastric emptying of a liquid gastric load in mice lacking cholecystokinin-B receptor: a study of CCK-A,B, and AB receptor gene knockout mice. J Gastroenterol. 2004;39:319-323. [PubMed] [DOI] |
| 29. | Olsson C, Holmgren S. The control of gut motility. Comp Biochem Physiol A Mol Integr Physiol. 2001;128:481-503. [PubMed] [DOI] |
| 30. | Chaudhri O, Small C, Bloom S. Gastrointestinal hormones regulating appetite. Philos Trans R Soc Lond B Biol Sci. 2006;361:1187-1209. [PubMed] [DOI] |