修回日期: 2006-11-05
接受日期: 2006-11-10
在线出版日期: 2007-01-18
目的: 探讨表皮生长因子受体(EGFR)和环氧化酶-2(COX-2)的表达与胃癌侵袭、转移因素的关系以及EGFR与COX-2在胃癌组织中表达的相关性.
方法: 用免疫组化的方法检测61例胃癌组织和相应的20例癌旁组织石蜡切片中EGFR、COX-2表达情况; 用Western blot方法检测10例胃癌组织和相应的癌旁组织中EGFR、COX-2蛋白的表达.
结果: 免疫组化检测胃癌组织中EGFR及COX-2的阳性表达率分别为36.07%、59.02%均明显高于癌旁组织的0%、25%(χ2 = 9.903, P<0.01; χ2 = 6.972, P<0.01); COX-2表达与浸润深度、淋巴结转移、TNM分期和病理分化程度有关(χ2 = 6.333, P<0.05; χ2 = 5.588, P<0.05; χ2 = 8.826, P<0.01; χ2 = 5.653, P<0.05). EGFR表达与淋巴结转移和TNM分期有关(χ2 = 10.648, P<0.01; χ2 = 4.150, P<0.05). EGFR与COX-2表达呈明显相关(r = 0.316, P<0.05). Western blot方法检测胃癌组织中EGFR及COX-2的蛋白表达高于癌旁组织(35.89± 12.50 vs 15.14 ±2.15, P<0.01; 51.29±23.42 vs 27.65±7.42, P<0.05).
结论: EGFR、COX-2在胃癌组织中高表达, EGFR、COX-2的表达与胃癌的侵袭、转移密切有关, COX-2表达与EGFR显著相关.
引文著录: 肖炜明, 施瑞华, 丁岩冰, 龚卫娟, 丁永玲, 薛艳. 胃癌组织中EGFR和COX-2表达的意义及其相关性. 世界华人消化杂志 2007; 15(2): 123-128
Revised: November 5, 2006
Accepted: November 10, 2006
Published online: January 18, 2007
AIM: To investigate the expression of epidermal growth factor receptor (EGFR) and cyclooxygenase-2 (COX-2) as well as their correlations in gastric carcinoma.
METHODS: Immunohistochemistry was performed to detect the expression of EGFR and COX-2 in 61 cases of gastric cancer and 20 cases of cancer-adjacent tissues, while Western blot was used to examine the protein expression of EGFR and COX-2 in 10 cases of gastric cancer and their corresponding cancer-adjacent tissues.
RESULTS: Immunohistochemistry showed that the expression of EGFR and COX-2 in gastric carcinoma were significantly higher than those in normal mucosa (36.07% vs 0%, χ2 = 9.903, P < 0.01; 59.02% vs 25%, χ2 = 6.972, P < 0.01). COX-2 expression was correlated with the depth of invasion, lymph node metastasis, TNM classification and pathologic differentiation degree (χ2 = 6.333, P < 0.05; χ2 = 5.588, P < 0.05; χ2 = 8.826, P < 0.01; χ2 = 5.653, P < 0.05). EGFR expression was correlated with lymph node metastasis, and TNM classification (χ2 = 10.648, P < 0.01; χ2 = 4.150, P < 0.05). There was also significant correlation between COX-2 and EGFR expression (r = 0.316, P < 0.05). Western blot also showed that the protein expression of EGFR and COX-2 in gastric carcinoma were significantly higher than those in normal mucosa (35.89 ± 12.50 vs 15.14 ± 2.15, P < 0.01; 51.29 ± 23.42 vs 27.65 ± 7.42, P < 0.05).
CONCLUSION: EGFR and COX-2 are over-expressed in gastric carcinoma, which is associated with the invasion and metastasis of gastric cancer. COX-2 expression is positively correlated with EGFR expression.
Key Words: Gastric cancinoma; Epidermal growth factor receptor; Cyclooxygenase-2; Correlation; Invasion; Metastasis
- Citation: Xiao WM, Shi RH, Ding YB, Gong WJ, Ding YL, Xue Y. Expression of epidermal growth factor receptor and cyclooxygenase-2 and their correlations in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(2): 123-128
- URL: https://www.wjgnet.com/1009-3079/full/v15/i2/123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i2.123
胃癌在我国是高发的恶性肿瘤之一, 其死亡率在所有恶性肿瘤中居第1位. 目前, 对胃癌的治疗, 仍以包括淋巴结清扫在内的外科手术为主, 以术前、术后的化疗为辅. 对进展期胃癌而言, 上述胃癌综合治疗方案仍难取得令人满意的疗效. 因此, 探讨胃癌生长及转移的分子机制以找寻新的化学预防、治疗方案具有极其重要的意义. 目前, 表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)抑制剂和环氧化酶-2(cyclooxygenase-2, COX-2)抑制剂的研制为肿瘤的防治带来了希望. 我们对胃癌组织中EGFR和COX-2的表达与临床病理特征之间的关系及他们之间的相关性进行了探讨, 以期为EGFR抑制剂和COX-2抑制剂在胃癌中应用提供一定的依据.
2005-10/2006-04经我院外科手术治疗, 且经过病理证实的胃癌手术后标本61例, 每一例患者术后取材两块: 癌组织、癌旁组织(距癌灶≥5 cm). 所有入选病例均无长期使用非甾体消炎药和糖皮质激素类药, 术前均未接受过放、化疗. 其中男42例, 女19例, 年龄33-78(平均61±9)岁. 肿瘤组织学类型按WHO分级, 高中分化腺癌38例, 低分化腺癌、未分化腺癌23例. 肿瘤大小: <5 cm者32例, ≥5 cm者29例. 肿瘤浸润深度: 浸润未达浆膜层者25例, 达浆膜层者36例. 转移情况: 发生局部淋巴结转移者33例, 无局部淋巴转移者28例. 根据国际抗癌联盟(UICC)关于胃癌TNM分期方法进行临床分期: Ⅰ期12例, II期18例, Ⅲ期26例, Ⅳ期5例. 肿瘤部位: 位于近端胃(贲门+胃底)18例, 位于远端胃(胃体+胃窦+幽门)43例. 在61例癌旁组织中随机选取20例作为免疫组化实验的对照组, 并经过病理检查排除肿瘤累及, 病理检查20例均为慢性浅表性胃炎, 有3例伴有轻度异型增生, 5例伴有部分腺体囊性扩张. 并随机选取10例癌组织及其相应的癌旁组织作Western blot的检测. COX-2 mAb(福州迈新生物技术公司), EGFR mAb即用型工作液(DAKO公司, 上海基因公司分装), 二步法免疫组化检测试剂盒(上海基因公司), 哺乳动物组织蛋白提取液MT-Celllytics, 混合蛋白酶抑制剂(上海博彩生物公司), 丙烯酰胺、亚甲双丙烯酰胺、SDS、b-巯基乙醇、过硫酸胺(上海生工生物公司), TEMED(Sigma公司), 低分子量蛋白预染marker(碧云天生物公司), 高分子量蛋白预染marker (北京天来生物医学科技公司), b-actin多抗、兔抗人EGFR多抗、鼠抗人COX-2单抗(Santa Cruz公司), PVDF膜(上海生工生物公司), HRP酶标记羊抗鼠多抗、HRP酶标羊抗兔多抗(上海华美生物公司), DAB(Fluka公司).
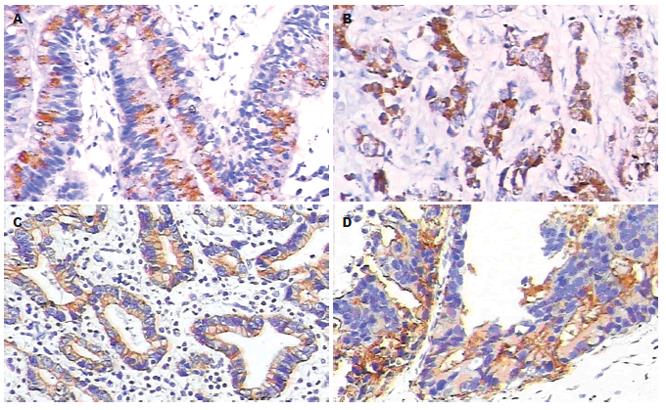
1.2.1 免疫组化方法检测EGFR、COX-2的表达: 所有标本组织经40 g/L中性甲醛溶液固定,石蜡包埋, 常规切片, 厚4 mm, 载玻片均经多聚赖氨酸防脱片处理, 另取一张HE染色. 采用ChemMateTMEnVision两步法进行染色. 主要步骤: 石蜡切片常规脱蜡梯度水化, 胰酶抗原修复, 滴加30 mL/L过氧化氢溶液阻断剂, 分别滴加EGFR一抗、COX-2一抗, 4℃孵育过夜, 洗片, 滴加二抗, 室温孵育30 min, 洗片, DAB显色, 苏木素复染, 脱水、中性树胶封片. 用已知阳性切片作为阳性对照, 用PBS代替第一抗体作为空白对照. 染色结果判断分别按阳性染色细胞百分数及染色强度计分[1]. 阳性细胞数为0, 计0分; 1%-10%计1分; 11%-50%计2分; 51%-75%计3分; >75%计4分. 染色阴性计0分; µ黄色计1分; 棕黄色计2分; 棕褐色计3分. 两种积分相加, 积分为0-2分, 表示阴性(-); 积分≥3分为阳性. 其中积分为3分, 表示阳性(+); 积分为4-5分, 表示阳性(++); 积分为6-7分, 表示阳性(+++). 光镜下(×100倍)选取染色清晰的连续5个视野, 切片先在低倍镜(×100)下观察全片, 再在高倍镜(×200)下观察.
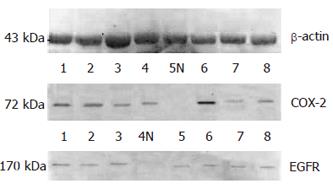
1.2.2 Western blot检测COX-2, EGFR的表达: 将组织用4℃ PBS液洗去残留血液, 称重. 加入蛋白提取液MT-Celllytics(含混合蛋白酶抑制剂100 mL), 充分研碎, 组织匀浆. 15 000 r/min, 4℃离心30 min. 收集上清分装. 用Bradford法测定蛋白总浓度, 使最终上样总蛋白为50 mg. 检测COX-2蛋白用Tris-Glycine电泳缓冲液以80 V恒压电泳0.5 h, 样品在浓缩胶内压成一细线后, 160 V电泳1.5 h. 检测EGFR的蛋白电泳采用80 V 0.5 h后200 V 2 h. 电泳完毕后以湿转移的方法(100 V, 100 min)将分离的蛋白条带转移至PVDF膜上. 用考马斯亮蓝染液染色、脱色并观察转膜效率. 使用30 mL/L牛血清白蛋白孵育2 h, 置于1:200稀释的COX-2单抗和EGFR多抗反应液37℃摇动下2 h. 冼膜, 加入含1:100稀释的辣根过氧化物酶酶联二抗反应液, 37℃摇动孵育1 h. 冼膜, DAB显色, 扫描记录结果. 根据预染Marker条带中的位置, 分析所测电泳条带的性质. 电泳条带经Genetools软件处理, 分析各实验组条带与对照组条带灰度值. 以β-actin多抗作为内参照.
统计学处理 所得数据计数资料用mean±SD表示; 计量资料用百分率表示, 比较用χ2检验. 相关性用Spearman等级相关分析. 所有统计均在SPSS10.0统计软件包中完成, P<0.05为有统计学意义.
COX-2染色在癌细胞胞质或核膜上呈棕黄色者为阳性, EGFR阳性以细胞质和部分细胞膜染成棕黄色(图1). COX-2、EGFR在胃癌组织中的阳性表达率分别为59.02%和36.07%, 在癌旁组织中的阳性表达率分别为25%和0%, 二者在胃癌组织中阳性表达率均明显高于癌旁组织(χ2 = 6.972, P<0.01; χ2 = 9.903, P<0.01). 胃癌组织中COX-2的阳性表达率: 在浸润达浆膜层的胃癌中为72.22%较未达浆膜层40%高(χ2 = 6.333, P<0.05); 有局部淋巴结转移的胃癌为72.73%较无淋巴结转移42.86%高(χ2 = 5.588, P<0.05); TNM分期Ⅲ期、Ⅳ 期的胃癌为77. 42%较Ⅰ期、Ⅱ期40. 0%高(χ2 = 8.826,P<0.01); 低分化、未分化腺癌的为78. 26%较高、中分化腺癌47.37%高(χ2 = 5.653,P<0.05). 由此可见: COX-2的阳性表达与胃癌浸润深度、淋巴结转移和TNM分期、分化程度有关; 而与胃癌的大小、部位无关. 胃癌组织中EGFR的阳性表达率: 在有局部淋巴结转移的胃癌中为54. 55%较无淋巴结转移14. 29%高(χ2 = 10.648, P<0.01); TNM分期Ⅲ期、Ⅳ 期的胃癌为48. 39%较Ⅰ期、Ⅱ期23. 33%高(χ2 = 4.150, P< 0.05). 由此可见, EGFR的阳性表达与胃癌淋巴结转移和TNM分期有关; 而在肿瘤部位、大小、浸润深度和分化方面以远端胃癌、肿瘤较大、浸润深和分化低者EGFR表达略高, 但无统计学意义(表1). 36例COX-2阳性胃癌中有17例EGFR表达阳性, 阳性率为47.22%; 25例COX-2表达阴性病例中有5例EGFR表达阳性, 阳性率仅20%, COX-2阳性的胃癌组织中EGFR阳性表达率明显高于COX-2阴性者(χ2 = 4.742, P<0.05), 即两者在胃癌组织表达同时阳性的百分率较高, 表明两者在胃癌中有共表达现象. Spearman等级相关分析表明, 胃癌组织中EGFR表达与COX-2之间具有显著相关性(r = 0.316, P<0.05).
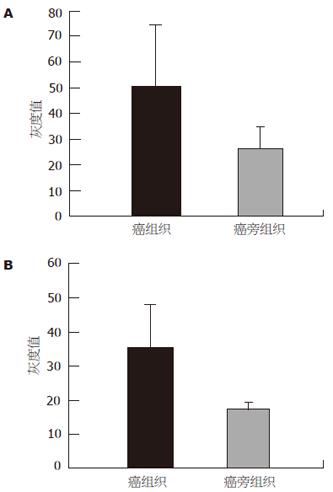
用b-actin多抗检测各样品间的肌动蛋白表达量基本一致. 各蛋白提取样品分别用鼠抗人COX-2单抗、兔抗人EGFR多抗检测后, 经预染marker核对后分别在72 kDa、170 kDa左右有条带(图2). 扫描后用Genetools软件分析各灰度值, 经t检验分析, 发现胃癌组织中COX-2, EGFR的灰度值显著高于癌旁组织(51.29±23.42 vs 27.65±7.42, P<0.05; 35.89±12.50 vs 15.14±2.15, P<0.01, 图3).
COX-2是前列腺素合成过程中的重要限速酶, 在恶性肿瘤发生、肿瘤血管形成及转移过程中发挥着重要作用. COX-2 可催化合成大量的前列腺素(包括PGE2等), 刺激细胞增生; 上调原癌基因bcl-2和下调上皮细胞钙黏蛋白(E-cadherin)、TGF-β受体的表达、抑制细胞凋亡、上调表皮生长因子(epidermal growth factor, EGF)、血管内皮生长因子(vascular endothelial growth Factor, VEGF)、内皮素-1等的表达、促进肿瘤血管形成、刺激基质金属蛋白酶的分泌, 促进肿瘤的转移等[2-4]. 有文献报道, COX-2, VEGF的高表达与胃癌的发生、进展高度相关[5-7]. 而COX-2抑制剂可抑制肿瘤血管的生成而具有防治胃癌、结肠癌等实体瘤的作用[8-11]. EGFR是一个跨膜受体, 与其相应配体结合后, 在细胞内激活信号传递系统, 刺激细胞生长与增殖. EGFR过度表达见于包括消化系肿瘤在内的人类多种恶性肿瘤, 并和肿瘤的发生、发展、增殖、转移以及血管形成密切相关[12-13]. Casanova et al[14]发现, 在肿瘤的演进过程中, 去除EGFR的作用会阻碍血管的进一步发展, 且可增加肿瘤细胞的凋亡数. Kopp et al[15]研究显示, 与邻近的正常胃黏膜相比, 胃癌中见到EGFR水平增加, 而EGFR水平增加尤多见于浸润程度更深的T3, T4期癌、淋巴结转移阳性的肿瘤、UICCⅢ进展期癌、未分化癌、弥漫型癌和远处贲门癌.
本课题免疫组化的结果显示, 在人胃癌组织中COX-2, EGFR表达较癌旁组织高, 与国内外部分文献报道基本一致[15-18]. COX-2的阳性表达率在浸润达浆膜、有淋巴结转移、分化较差、TNM分期Ⅲ、Ⅳ期的胃癌组织中较高, 反映了COX-2的表达与胃癌的浸润深度、淋巴结转移和临床TNM分期及分化程度有关, 这与文献报道相一致[5-7]. EGFR的表达与淋巴结转移、临床TNM分期有关. Western blot检测结果也显示了胃癌组织中COX-2, EGFR的表达较癌旁组织高. 由上述可见, 在人体胃癌组织中存在着COX-2, EGFR的高表达, 而浸润深度、淋巴结转移、组织分化、临床分期是胃癌侵袭转移因素, 是反映胃癌进展和患者生存预后的相关指标, 因此本研究表明, 胃癌组织中COX-2, EGFR的高表达与肿瘤的高侵袭转移性有关, 可作为判断胃癌进展和预后的指标.
COX-2, EGFR都与肿瘤血管生成、侵袭性及转移有关, 这两个指标之间有无相关性呢? 在结直肠癌细胞中, 增加COX-2的表达能反向激活EGFR而刺激细胞增殖[19], 在乳腺癌和肺癌中也发现PGE2的作用涉及EGFR信号通路[20]. 阻滞EGFR信号通路可抑制COX-2诱导的HCA-7移植瘤的生长[21-22]. 体外培养的子宫颈癌细胞、口腔上皮细胞用EGF处理, 可显著诱发COX-2蛋白、COX-2 mRNA和刺激COX-2的促进活性, EGF对COX-2的诱导可被酪氨酸激酶活性抑制物等抑制, 这些实验提示, EGFR信号通路失调可导致COX-2表达增强[23-24]. 最近有研究认为, Barrett's食管和食管腺癌组织中COX-2和EGFR的高表达呈显著正相关,且协同促进Barrett's食管的癌变[25], 国内也有报道[26-27], 在甲状腺乳头状癌、口腔鳞状细胞癌中的COX-2和EGFR的表达有显著正相关, 认为这两种蛋白协同作用共同促进恶性细胞的增殖和侵袭转移.我们的前期研究发现[28], 在胃癌细胞中COX-2来源的产物PGE2可通过EGFR通路促进肿瘤细胞VEGF的表达. 而在胃癌组织中EGFR与COX-2的相关性国内却少有报道.
我们研究了胃癌组织中COX-2、EGFR表达的相关性. 实验结果显示, 在胃癌组织中COX-2与EGFR两者存在着共同高表达现象. 实验结果经过Spearman等级相关分析表明, 胃癌组织中COX-2与EGFR具有正相关. 最近研究发现, 联合应用COX-2抑制剂和EGFR抑制剂可明显减少癌细胞的增殖和血管形成, 且较单药有明显的抑制作用[29-31]. 对这些指标及其相关性的研究为COX-2抑制剂和EGFR抑制剂在临床胃癌治疗中的应用或联合应用提供一定的分子学依据.
胃癌在我国是高发的恶性肿瘤之一, 其死亡率在所有恶性肿瘤中居第1位. 目前, 对进展期胃癌的治疗, 手术加化疗的治疗方案难取得令人满意的疗效. 因此, 探讨肿瘤的生长及转移的分子机制以找寻新的化学预防、治疗方案具有极其重要的意义.
目前, 有关肿瘤新生血管的生成及其信号通路成为研究的热点, COX-2及EGFR在肿瘤的血管生成和肿瘤侵袭转移方面的作用受到人们的关注.
本文研究了胃癌组织中COX-2和EGFR的表达及其在胃癌发生、发展过程中的相互作用, 发现EGFR、COX-2在胃癌组织中高表达, EGFR、COX-2的表达与胃癌的侵袭、转移密切有关, COX-2表达与EGFR显著相关.
对胃癌组织中EGFR和COX-2的表达与胃癌侵袭转移因素的关系及其相关性的探讨, 为EGFR抑制剂和COX-2抑制剂在胃癌治疗中的应用及联合应用提供了一定的依据.
文章探讨了表皮生长因子受体(EGFR)和环氧化酶-2(COX-2)的表达与胃癌侵袭、转移因素的关系以及EGFR与COX-2在胃癌组织中表达的相关性, 科学性较强, 设计合理, 具有重要的临床指导意义.
电编: 李琪 编辑: 王晓瑜
| 2. | Ohno R, Yoshinaga K, Fujita T, Hasegawa K, Iseki H, Tsunozaki H, Ichikawa W, Nihei Z, Sugihara K. Depth of invasion parallels increased cyclooxygenase-2 levels in patients with gastric carcinoma. Cancer. 2001;91:1876-1881. [PubMed] [DOI] |
| 3. | Tsujii M, Kawano S, Tsuji S, Sawaoka H, Hori M, DuBois RN. Cyclooxygenase regulates angiogenesis induced by colon cancer cells. Cell. 1998;93:705-716. [PubMed] [DOI] |
| 5. | Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y, Shiozaki H, Hori M. Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma. Am J Gastroenterol. 1999;94:451-455. [PubMed] [DOI] |
| 6. | Marks F, Fürstenberger G. Cancer chemoprevention through interruption of multistage carcinogenesis. The lessons learnt by comparing mouse skin carcinogenesis and human large bowel cancer. Eur J Cancer. 2000;36:314-329. [PubMed] [DOI] |
| 7. | Kakeji Y, Koga T, Sumiyoshi Y, Shibahara K, Oda S, Maehara Y, Sugimachi K. Clinical significance of vascular endothelial growth factor expression in gastric cancer. J Exp Clin Cancer Res. 2002;21:125-129. [PubMed] |
| 8. | Yao M, Zhou W, Sangha S, Albert A, Chang AJ, Liu TC, Wolfe MM. Effects of nonselective cyclooxygenase inhibition with low-dose ibuprofen on tumor growth, angiogenesis, metastasis, and survival in a mouse model of colorectal cancer. Clin Cancer Res. 2005;11:1618-1628. [PubMed] [DOI] |
| 9. | Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K. Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancers: a review and report of personal experience. World J Gastroenterol. 2006;12:1336-1345. [PubMed] [DOI] |
| 10. | Wu GS, Zou SQ, Liu ZR, Tang ZH, Wang JH. Celecoxib inhibits proliferation and induces apoptosis via prostaglandin E2 pathway in human cholangiocarcinoma cell lines. World J Gastroenterol. 2003;9:1302-1306. [PubMed] [DOI] |
| 11. | Yu J, Tang BD, Leung WK, To KF, Bai AH, Zeng ZR, Ma PK, Go MY, Hu PJ, Sung JJ. Different cell kinetic changes in rat stomach cancer after treatment with celecoxib or indomethacin: implications on chemoprevention. World J Gastroenterol. 2005;11:41-45. [PubMed] [DOI] |
| 12. | Grünwald V, Hidalgo M. Development of the epidermal growth factor receptor inhibitor Tarceva (OSI-774). Adv Exp Med Biol. 2003;532:235-246. [PubMed] [DOI] |
| 13. | Xiong HQ, Abbruzzese JL. Epidermal growth factor receptor-targeted therapy for pancreatic cancer. Semin Oncol. 2002;29:31-37. [PubMed] [DOI] |
| 14. | Casanova ML, Larcher F, Casanova B, Murillas R, Fernández-Aceñero MJ, Villanueva C, Martínez-Palacio J, Ullrich A, Conti CJ, Jorcano JL. A critical role for ras-mediated, epidermal growth factor receptor-dependent angiogenesis in mouse skin carcinogenesis. Cancer Res. 2002;62:3402-3407. [PubMed] |
| 15. | Kopp R, Ruge M, Rothbauer E, Cramer C, Kraemling HJ, Wiebeck B, Schildberg FW, Pfeiffer A. Impact of epidermal growth factor (EGF) radioreceptor analysis on long-term survival of gastric cancer patients. Anticancer Res. 2002;22:1161-1167. [PubMed] |
| 18. | Ghaderi A, Vasei M, Maleck-Hosseini SA, Gharesi-Fard B, Khodami M, Doroudchi M, Modjtahedi H. The expression of c-erbB-1 and c-erbB-2 in Iranian patients with gastric carcinoma. Pathol Oncol Res. 2002;8:252-256. [PubMed] [DOI] |
| 19. | Yoshimoto T, Takahashi Y, Kinoshita T, Sakashita T, Inoue H, Tanabe T. Growth stimulation and epidermal growth factor receptor induction in cyclooxygenase-overexpressing human colon carcinoma cells. Adv Exp Med Biol. 2002;507:403-407. [PubMed] [DOI] |
| 20. | Kelloff GJ, Fay JR, Steele VE, Lubet RA, Boone CW, Crowell JA, Sigman CC. Epidermal growth factor receptor tyrosine kinase inhibitors as potential cancer chemopreventives. Cancer Epidemiol Biomarkers Prev. 1996;5:657-666. [PubMed] |
| 21. | Mann M, Sheng H, Shao J, Williams CS, Pisacane PI, Sliwkowski MX, DuBois RN. Targeting cyclooxygenase 2 and HER-2/neu pathways inhibits colorectal carcinoma growth. Gastroenterology. 2001;120:1713-1719. [PubMed] [DOI] |
| 22. | Ross JS, McKenna BJ. The HER-2/neu oncogene in tumors of the gastrointestinal tract. Cancer Invest. 2001;19:554-568. [PubMed] [DOI] |
| 23. | Kulkarni S, Rader JS, Zhang F, Liapis H, Koki AT, Masferrer JL, Subbaramaiah K, Dannenberg AJ. Cyclooxygenase-2 is overexpressed in human cervical cancer. Clin Cancer Res. 2001;7:429-434. [PubMed] |
| 24. | Mestre JR, Subbaramaiah K, Sacks PG, Schantz SP, Tanabe T, Inoue H, Dannenberg AJ. Retinoids suppress epidermal growth factor-induced transcription of cyclooxygenase-2 in human oral squamous carcinoma cells. Cancer Res. 1997;57:2890-2895. [PubMed] |
| 25. | Li Y, Wo JM, Ray MB, Jones W, Su RR, Ellis S, Martin RC. Cyclooxygenase-2 and epithelial growth factor receptor up-regulation during progression of Barrett's esophagus to adenocarcinoma. World J Gastroenterol. 2006;12:928-934. [PubMed] [DOI] |
| 26. | 王喜梅, 孙雷, 张朝, 郑仁恕, 王乃玉, 冯晓梅,张众. EGFR、COX-2 及p63蛋白表达与甲状腺乳头状癌侵袭转移的关系. 临床与实验病理学杂志. 2004;20:191-194. |
| 28. | Ding YB, Shi RH, Tong JD, Li XY, Zhang GX, Xiao WM, Yang JG, Bao Y, Wu J, Yan ZG. PGE2 up-regulates vascular endothelial growth factor expression in MKN28 gastric cancer cells via epidermal growth factor receptor signaling system. Exp Oncol. 2005;27:108-113. [PubMed] |
| 29. | Hattori K, Iida K, Joraku A, Tsukamoto S, Akaza H, Oyasu R. Chemopreventive effects of cyclooxygenase-2 inhibitor and epidermal growth factor-receptor kinase inhibitor on rat urinary bladder carcinogenesis. BJU Int. 2006;97:640-643. [PubMed] [DOI] |
| 30. | Torrance CJ, Jackson PE, Montgomery E, Kinzler KW, Vogelstein B, Wissner A, Nunes M, Frost P, Discafani CM. Combinatorial chemoprevention of intestinal neoplasia. Nat Med. 2000;6:1024-1028. [PubMed] [DOI] |
| 31. | Tortora G, Caputo R, Damiano V, Melisi D, Bianco R, Fontanini G, Veneziani BM, De Placido S, Bianco AR, Ciardiello F. Combination of a selective cyclooxygenase-2 inhibitor with epidermal growth factor receptor tyrosine kinase inhibitor ZD1839 and protein kinase A antisense causes cooperative antitumor and antiangiogenic effect. Clin Cancer Res. 2003;9:1566-1572. [PubMed] |