修回日期: 2007-05-11
接受日期: 2007-05-16
在线出版日期: 2007-07-08
目的: 探讨直肠癌中巨噬细胞抑制因子-1(MIC-1), 血管内皮生长因子(VEGF), P53基因蛋白表达与病理特征的相关性.
方法: 用免疫组化法检测73例直肠癌中MIC-1, VEGF和P53的表达, 并与临床病理因素进行相关性分析.
结果: MIC-1, VEGF, P53表达均与直肠癌临床分期显著相关(χ2MIC-1 = 37.534, χ2VEGF = 54.451, χ2P53 = 16.834; P<0.01); 三者联合阳性表达率与临床分期呈显著线性相关(r = 0.918, P = 0.000). MIC-1表达与VEGF, P53表达呈正相关(r = 0.808, r = 0.369, P<0.01).
结论: MIC-1, VEGF, P53在直肠癌发生、发展中呈协同和相互调节作用, 联合检测他们的阳性表达有助于直肠癌侵润转移的判断.
引文著录: 王志宇, 杨渤彦, 高健, 韩强, 毕雪冰, 程魏, 朱熹珍. 直肠癌中MIC-1, VEGF和P53表达的临床意义. 世界华人消化杂志 2007; 15(19): 2170-2173
Revised: May 11, 2007
Accepted: May 16, 2007
Published online: July 8, 2007
AIM: To investigate the expression of macrophage inhibitory cytokine-1 (MIC-1), vascular endothelial growth factor (VEGF) and P53 in rectal cancer, and its relationship to clinicopathological parameters.
METHODS: Expression of MIC-1, VEGF and P53 in 73 cases of rectal cancer was assessed by immunohistochemistry, and its correlation with clinicopathological factors was statistically analyzed.
RESULTS: Expression of MIC-1, VEGF and P53 had a significant correlation with clinical stage (χ2MIC-1 = 37.534, χ2VEGF = 54.451, χ2P53 = 16.834, respectively; P < 0.01). There was a significant linear relationship between the levels of the three oncoproteins and clinical stage in patients with rectal cancer (r = 0.918, P = 0.000). The expression of MIC-1 also had a positive correlation with the expression of VEGF and P53 (r = 0.808, r = 0.369, respectively; P < 0.01).
CONCLUSION: MIC-1, VEGF and P53 have synergetic and mutual regulation in the occurrence and development of rectal cancer. The combined detection of their expression may help to determine progression and metastasis in rectal cancer.
- Citation: Wang ZY, Yang BY, Gao J, Han Q, Bi XB, Cheng W, Zhu XZ. Expression of macrophage inhibitory cytokine-1, vascular endothelial growth factor and P53 and its clinical significance in rectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2170-2173
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2170.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2170
1990年Fearon et al[1]在对肿瘤发生的多阶段性研究证实, 结直肠癌细胞至少存在两个基因的突变, 许多情况下都涉及到Ras与P53. 随着肿瘤恶性度的增强, 发生突变的基因数目也逐渐增加. 抑癌基因和癌基因在肿瘤发生中是如何协同起作用, 以及在肿瘤不同发展阶段如何起作用, 到底有多少基因参与细胞的癌变和肿瘤的发生、发展成为研究的焦点. 目前应用免疫组化方法检测蛋白是一种精确、简单的估测基因变化的方法, 可反映基因的活性状态. 因此, 本研究采用S-P法检测巨噬细胞抑制细胞因子-1(MIC-1), VEGF和P53蛋白在直肠癌中的表达, 并探讨他们之间的相关性及与临床病理特征的关系.
保定市第三医院1997/2004手术切除且资料完整的直肠癌73例, 均经根治性手术治疗和病理确诊, 男33例, 女40例; 年龄25-79(平均55.7)岁. 高分化腺癌11例, 中分化腺癌45例, 低分化腺癌17例; Ⅰ期12例, Ⅱ期18例, Ⅲ期43例, 至2007-01, 73例患者中30例死亡, 43例生存.
MIC-1抗体购自北京华美生物有限公司, VEGF, P53, DAB显色试剂盒, SV-9000免疫组化检测试剂盒均购自北京中杉生物工程有限公司. 采用微波热修复, 免疫组化S-P法, MIC-1和VEGF染色阳性细胞为胞浆呈棕黄色. P53染色阳性细胞为细胞核出现棕黄色染色而胞浆不着色. 随机选择10个高倍视野共记录1000个直肠癌细胞, 并计算阳性表达细胞百分比, 结合染色强度进行评分, 以两者乘积为最后得分, 具体操作为: (1)无阳性细胞数为0分, 1%-10%为1分, 11%-50%为2分, >51%为3分. (2)阳性强度: 无色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 将前两者积分相乘, 0分为阴性, ≥1分为阳性.
统计学处理 所有计算均用SPSS软件包完成, 实验所得数据资料采用方差分析, 计数资料采用χ2检验法, 用Spearman方法计算变量间的相关性.
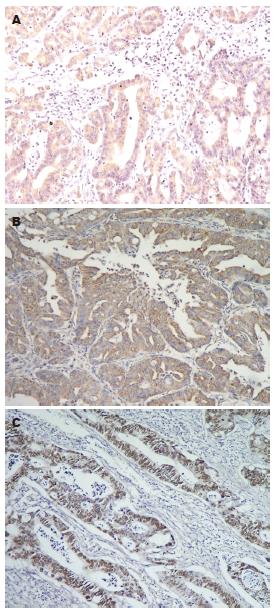
MIC-1, VEGF阳性染色颗粒主要分布于细胞质内(图1A-B), P53阳性染色颗粒主要分布于细胞核内(图1C). 3种癌相关基因阳性表达率在不同年龄、组织分化程度的直肠癌患者中均无统计学差异. MIC-1和VEGF表达与直肠癌肿瘤临床分期、浸润深度有显著相关性(MIC-1分别为χ2 = 37.534, P = 0.000; χ2 = 3.878, P = 0.049; VEGF分别为χ2 = 54.451, P = 0.000; χ2 = 7.344, P = 0.007); 即分期越晚、肿瘤浸润越深, MIC-1和VEGF的阳性表达率越高. P53表达与直肠癌肿瘤临床分期有显著相关性(χ2 = 16.834, P = 0.000); 三者联合阳性表达率与临床分期有显著线性相关趋势(r = 0.918, P = 0.000)(表1, 表2).
| n | MIC-1 | P53 | VEGF | |||||
| n(%) | χ2 | n(%) | χ2 | n(%) | χ2 | |||
| 浸润深度 | 3.878a | 0.035 | 7.344b | |||||
| 侵及浆膜 | 57 | 37(64.9) | 30(52.6) | 36(63.2) | ||||
| 未及浆膜 | 16 | 6(37.5) | 8(50) | 4(25) | ||||
| TNM分期 | 37.534b | 16.834b | 54.451b | |||||
| Ⅰ/Ⅱ期 | 30 | 5(16.7) | 7(23.3) | 1(3.3) | ||||
| Ⅲ期 | 43 | 38(88.4) | 31(72.1) | 39(90.7) | ||||
| 分化程度 | 0.308 | 0.222 | 0.535 | |||||
| 高、中分化 | 56 | 32(57.1) | 30(53.6) | 32(57.1) | ||||
| 低、黏液腺癌 | 17 | 11(64.7) | 8(47.1) | 8(47.1) | ||||
| 年龄 | 1.358 | 0.878 | 2.021 | |||||
| <40岁 | 3 | 1(33.3) | 1(33.3) | 1(33.3) | ||||
| ≥40, <65岁 | 46 | 29(65.9) | 23(50.0) | 28(60.9) | ||||
| ≥65岁 | 24 | 13(54.2) | 14(58.3) | 11(45.8) | ||||
| 病理因素 | 单基因 | 双基因 | 多基因 | χ2 |
| 浸润深度 | 5.159 | |||
| 侵及浆膜 | 7(12.3) | 11(19.3) | 24(42.1) | |
| 未及浆膜 | 5(31.3) | 2(12.5) | 3(18.8) | |
| TNM分期 | 28.364b | |||
| Ⅰ/Ⅱ期 | 9(30.0) | 2(6.7) | 0(0) | |
| Ⅲ期 | 3(7.0) | 11(25.6) | 27(62.8) | |
| 分化程度 | 2.797 | |||
| 高、中分化 | 9(16.1) | 8(14.3) | 23(41.1) | |
| 低、黏液腺癌 | 3(17.6) | 5(29.4) | 4(23.5) | |
| 年龄 | 3.917 | |||
| <40岁 | 1(33.3) | 1(33.3) | 0(0) | |
| ≥40, <65岁 | 7(15.2) | 10(21.7) | 17(37.0) | |
| ≥65岁 | 4(16.7) | 2(8.3) | 10(41.7) |
利用等级相关进行检验, 结果表明, 在直肠癌中MIC-1阳性表达程度与VEGF, P53阳性表达程度均存在显著的相关性(r = 0.808, P = 0.000; r = 0.369, P = 0.001).
MIC-1巨噬细胞抑制细胞因子-1(Macrophage Inhibitory Cytokine-1), 是1997年Bootcov et al[2]从激活的巨噬细胞中发现的一个人类转化生长因子TGF-β超家族的分支成员. 他对多种细胞的应激反应具有调节作用[3]. 大量的直接和间接的证据证实MIC-1和癌症有关. 同Brown et al[4]报道的相似, MIC-1的表达与直肠癌的临床分期、浸润、转移等特征密切相关, 可作为评价直肠癌浸润、转移和预后的一个重要指标. MIC-1引起肿瘤浸润及转移的可能机制为: MIC-1抑制了cyclin D1癌基因的表达, 并可增强蛋白水解酶活性, 增加间质胶原的降解, 从而降低瘤细胞黏附力, 促进癌细胞的分离, 迁移和转移[5]. MIC-1在肿瘤中能通过激活uPA系统来促进癌细胞的侵袭. MIC-1可增加uPA和尿激酶型纤溶酶原激活剂受体(uPAR)的表达, uPA连接uPAR可以触发蛋白水解的途径由此增强了肿瘤细胞降解细胞外基质的能力, 促进了癌细胞的浸润.
MIC-1启动区域是抑癌基因P53产物的靶点, P53可诱导MIC-1表达的增加, 通过介导P53途径, MIC-1抑制细胞生长和血管生成, 促使细胞周期停滞[6]. 属于负性生长因子. 但在另一些研究中也发现, MIC-1对肿瘤细胞生长无明显抑制, 即转化细胞对MIC-1的负性调控不敏感, 高水平的MIC-1并不能抑制肿瘤细胞的生长. 本实验研究也证实了这一点. MIC-1蛋白的阳性表达随直肠癌分期升高, 浸润深度增加、淋巴结转移而升高, 具有显著性差异. 表明直肠癌细胞丧失了对MIC-1生长抑制作用的反应, 而反馈性表达MIC-1增高. 随着肿瘤生长, MIC-1的分泌增加, 对肿瘤控制的正面作用被局部肿瘤免疫力的下降所抵销. 这是对肿瘤免疫逃避的机制. 必然的, 一个正反馈机制建立, 导致更多的MIC-1产生, 额外的免疫抑制, 肿瘤的扩散和患者更早的死亡[4].
VEGF是一个特异性作用于血管内皮细胞的, 公认的强有力的促血管生成因子. VEGF能促进血管内皮细胞分裂增生, 增加血管的通透性, 促进纤维蛋白的排出, 形成血管内皮细胞黏附移行的新基质, 血管内皮细胞在VEGF的刺激下增生移行, 形成新的肿瘤供血血管网, VEGF在肿瘤的发生、发展、浸润和转移中发挥重要作用.
本研究发现, VEGF的表达与肿瘤侵润深度、淋巴结转移、临床分期有关. VEGF的表达增加, 可以促进恶性肿瘤细胞的迅速增殖生长, 并加快肿瘤的侵袭和转移. 肿瘤细胞分化与增殖密切相关, 分化越差, 增殖越快, 需要的营养越多, 促使肿瘤细胞分泌越多的血管形成因子, 以形成丰富的肿瘤营养血管.
p53基因是目前研究最为广泛深入的肿瘤抑制基因之一. 野生型p53为隐性抑癌基因, 但突变型p53为显性癌基因, 大约50%的人类肿瘤都有p53基因的突变. 本研究发现, P53蛋白表达的肿瘤更具有侵袭性, 与肿瘤分期显著性正相关. 提示p53阳性表达的直肠癌患者更容易发生浸润、转移. Kieser et al[7]发现存在一条P53调节VEGF的通路, 突变型P53加强了VEGF的转录, 促进肿瘤血管生成, 从而促使了肿瘤的转移. 我们的研究发现P53与VEGF之间表达呈显著正相关, 提示P53基因突变是调控肿瘤血管生长的重要因素. P53, VEGF的共同表达在直肠癌的转移过程中起协同作用.
通过基因编码证实, MIC-1作为依赖P53和不依赖P53的DNA损伤途径的下游区靶点, 他是两个途径的交汇点, 对这些途径有重要的调节作用[6]. 在DNA损伤或肿瘤发生的早期, 野生型P53基因作为保护因子被激活, 诱导了下游的MIC-1基因的高表达, 从而抑制肿瘤的发生或发展, 在肿瘤发生的较晚时期, MIC-1通过免疫抑制、合成细胞外基质、刺激肿瘤血管生成等, 提供了适宜肿瘤细胞生长、浸润及转移的微环境, 促进肿瘤播散, 从而促进肿瘤的发展. 有研究表明除缺氧外, TGF-β1是产生VEGF的另一重要因素[8], MIC-1可能直接或间接的上调VEGF的表达. 我们研究发现MIC-1与P53, VEGF的表达呈正相关. 这说明在直肠癌中P53对MIC-1有诱导作用, MIC-1可能通过P53的介导上调VEGF的表达而刺激肿瘤血管形成, 进而促进直肠癌细胞的侵袭与转移. 但MIC-1是否能直接刺激血管生成尚不能肯定. 说明三者在肿瘤的生长过程中有协同和相互调节作用, 促进了肿瘤血管生成、侵袭及转移.
在73例直肠癌中, 联合阳性表达与直肠癌临床分期显著相关, 且具有某种线性趋势(即随着直肠癌的浸润转移, 发生基因变异并异常高表达的基因数目逐渐增多), 提示多基因联合阳性表达可以反映直肠癌的发展演化过程, 肿瘤的发生发展是多基因变异并协同作用累加的结果.
巨噬细胞是重要的免疫效应细胞, 对肿瘤的发生、发展发挥着重要的调控作用. 本研究探讨巨噬细胞抑制因子-1(MIC-1)、血管内皮生长因子(VEGF)、P53蛋白的表达与直肠癌临床病理特征的相关性. 大量的直接和间接的证据证实MIC-1和癌症有关. 他对肿瘤的发生、发展有双向的调节作用. 而且在所有结直肠癌中高表达的基因中, MIC-1是非常有限的分泌蛋白质的基因之一. 这在临床诊断方面比其他由上皮肿瘤产生的细胞因子有显著的实际优势.
直肠癌组织中MIC-1与VEGF、P53表达的相关性研究. 用免疫组化的方法检测MIC-1在直肠癌中的表达, 及其与临床病理因素的相关性. 这在国内文献中未查到相同的报道.
本文研究了联合检测MIC-1, P53, VEGF更有助于直肠癌侵润转移的判断. 立意创新, 数据可信, 论证有据, 有一定的临床意义.
编辑: 程剑侠 电编:郭海丽
| 1. | Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61:759-767. [PubMed] |
| 2. | Bootcov MR, Bauskin AR, Valenzuela SM, Moore AG, Bansal M, He XY, Zhang HP, Donnellan M, Mahler S, Pryor K. MIC-1, a novel macrophage inhibitory cytokine, is a divergent member of the TGF-beta superfamily. Proc Natl Acad Sci U S A. 1997;94:11514-11519. [PubMed] |
| 3. | Schober A, Bottner M, Strelau J, Kinscherf R, Bonaterra GA, Barth M, Schilling L, Fairlie WD, Breit SN, Unsicker K. Expression of growth differentiation factor-15/macrophage inhibitory cytokine-1 (GDF-15/MIC-1) in the perinatal, adult, and injured rat brain. J Comp Neurol. 2001;439:32-45. [PubMed] |
| 4. | Brown DA, Ward RL, Buckhaults P, Liu T, Romans KE, Hawkins NJ, Bauskin AR, Kinzler KW, Vogelstein B, Breit SN. MIC-1 serum level and genotype: associations with progress and prognosis of colorectal carcinoma. Clin Cancer Res. 2003;9:2642-2650. [PubMed] |
| 5. | Liu T, Bauskin AR, Zaunders J, Brown DA, Pankhurst S, Russell PJ, Breit SN. Macrophage inhibitory cytokine 1 reduces cell adhesion and induces apoptosis in prostate cancer cells. Cancer Res. 2003;63:5034-5040. [PubMed] |
| 6. | Tan M, Wang Y, Guan K, Sun Y. PTGF-beta, a type beta transforming growth factor (TGF-beta) superfamily member, is a p53 target gene that inhibits tumor cell growth via TGF-beta signaling pathway. Proc Natl Acad Sci U S A. 2000;97:109-114. [PubMed] |
| 7. | Kieser A, Weich HA, Brandner G, Marme D, Kolch W. Mutant p53 potentiates protein kinase C induction of vascular endothelial growth factor expression. Oncogene. 1994;9:963-969. [PubMed] |
| 8. | Breier G, Blum S, Peli J, Groot M, Wild C, Risau W, Reichmann E. Transforming growth factor-beta and Ras regulate the VEGF/VEGF-receptor system during tumor angiogenesis. Int J Cancer. 2002;97:142-148. [PubMed] |