修回日期: 2007-05-11
接受日期: 2007-05-24
在线出版日期: 2007-07-08
目的: 建立一种快速、特异、敏感的分子生物学诊断方法对腹泻患者粪中痢疾杆菌致病基因ipaH及ial进行检测.
方法: 分别应用常规培养生化血清学鉴定方法、普通PCR、巢氏PCR(nested-PCR)方法, 对71例腹泻患者粪标本进行检测. 痢疾杆菌致病基因ipaH及ial的扩增产物经电泳分离.
结果: 在71例腹泻患者粪标本中, 常规培养生化血清学鉴定方法分离出福氏痢疾杆菌24例, 宋内痢疾杆菌23例, 志贺痢疾杆菌1例, 沙门菌23例. 采用普通PCR法检测痢疾杆菌粪标本48例, ipaH基因均阳性(100%); ial基因阳性34例(70.8%), 余14例为阴性. 对该14例粪标本进而采用巢氏PCR法进行ial基因扩增, 其中12份标本阳性. 48例痢疾杆菌粪标本中46例ipaH和ial基因为双阳性(46/48). 沙门菌粪标本23例中ipaH及ial基因表达均为阴性. 以上两种方法的诊断一致性检验Kappa = 0.937, 差异有统计学意义(P<0.05). 71例腹泻患者粪标本采用PCR和巢氏PCR法扩增得到的ipaH和ial基因特异片段与基因库中发表的标准菌株序列比较, 一致性为100%.
结论: 建立了快速诊断腹泻患者粪中痢疾杆菌致病基因ipaH和ial的PCR检测方法, 具有简便、快速、特异和敏感的特点.
引文著录: 李小丽, 阴赪宏, 温艳, 黄敏君, 栗绍刚, 齐志群, 李威. PCR快速检测腹泻患者粪中痢疾杆菌致病基因ipaH和ial. 世界华人消化杂志 2007; 15(19): 2128-2132
Revised: May 11, 2007
Accepted: May 24, 2007
Published online: July 8, 2007
AIM: To establish a fast, specific and sensitive diagnostic method for detecting the invasion plasmid antigen H (ipaH) and the invasion-associated locus (ial) DNA sequence of Shigella.
METHODS: Seventy-one stool specimens from patients with acute diarrhea were tested by two methods; a traditional culture method, and a polymerase chain reaction (PCR) and nested-PCR assay. PCR-amplified products were initially evaluated by electrophoresis with 20 g/L agarose gel and visualization by ethidium bromide staining.
RESULTS: Serological assay classified the Shigella isolates as follows: 24 Shigella flexneri, 23 Shigella sonnei and one Shigella dysenteriae. Salmonella was isolated from 23 of the 71 stool specimens by conventional coproculture. PCR assays showed that 46 of the 48 Shigella spp. were positive for the ipaH gene, 34 were positive for the ial gene, and 14 were negative. Nested-PCR assays detected 14 specimens as negative for ial, 12 were positive, and 46 specimens were positive for both the ipaH and ial genes. The ipaH and ial genes were both negative in 23 Salmonella isolates. The kappa test, was used to compare two test results, and the kappa value was 0.937 (P < 0.05).
CONCLUSION: PCR assays detecting the invasion-associated genes of Shigella from feces provided fast, specific and sensitive diagnostic methods.
- Citation: Li XL, Yin CH, Wen Y, Huang MJ, Li SG, Qi ZQ, Li W. Rapid polymerase chain reaction assay for ipaH and ial genes in feces from shigellosis. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2128-2132
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2128.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2128
由于细菌性痢疾的临床及流行特点, 对痢疾杆菌的鉴定具有十分重要的意义[1]. 长期以来, 传统的分离培养、血清学试验、生化反应等常规方法在痢疾杆菌病原体诊断中发挥了良好的作用, 但一般需要2-3 d时间. 对于痢疾杆菌的检测, 传统的微生物方法已经显现出很大的局限性, 如检测周期长、步骤繁琐、许多因素难以控制等, 存在菌痢的误诊和漏诊, 因此需要用快速、敏感、特异的检测方法诊断菌痢, 以采取有效防治措施. 我们用普通PCR方法从腹泻患者粪便中扩增痢疾杆菌侵袭质粒基因(ipaH)和侵袭相关基因位点(ial)基因, 评价其诊断菌痢的临床价值.
研究对象为71例粪标本, 来自北京友谊医院肠道门诊2006年04-11 mo就诊的急性腹泻患者. 按卫生部颁布《全国临床检验操作规程》进行培养和生化反应及血清学鉴定. 分离鉴定所用培养基及生化反应试剂均购于北京天坛生物制品股份有限公司. 痢疾杆菌凝集血清及沙门菌凝集血清购于兰州生物制品研究所.
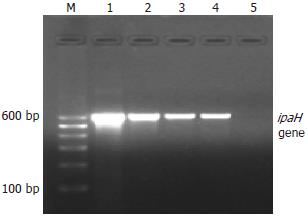
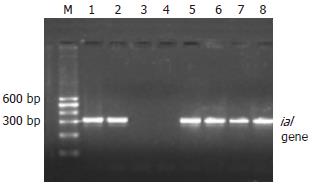
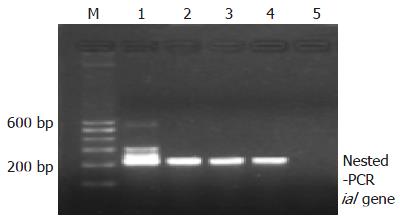
取腹泻粪标本200 mg, 经QIAamp DNA Stool Mini Kit(Qiagen Inc., Valencia, CA, USA)试剂盒(Cat No: 51504)进行DNA的分离提取. 根据文献[2-3]报道的相关序列设计痢疾杆菌致病基因ipaH和ial的2对引物及ial基因巢氏PCR的引物, 均由北京赛百盛生物制剂有限公司合成(表1). ipaH及ial反应体系(25 μL): Promega公司产品5×green buffer缓冲液5 μL; 25 mmol/L MgCl2终浓度2 mmol/L; 2.5 mmol/L dNTP混合物终浓度0.2 mmol/L; 10 μmol/L相应引物终浓度 0.2 μmol/L; Taq DNA聚合酶16.67 nkat; 模板(DNA)2 μL. ial巢氏PCR反应体系(25 μL): Promega公司产品5×green buffer缓冲液6.25 μL; 25 mmol/L MgCl2终浓度2.5 mmol/L; 2.5 mmol/L dNTP混合物终浓度 0.2 mmol/L; 10 μmol/L引物0.5 μmol/L; Taq DNA聚合酶20.84 nkat; 模板(DNA)2.5 μL. 扩增条件: 预变性94℃ 7 min. 退火温度分别为: ipaH 54℃; ial 52℃; ial巢氏PCR 60℃; 均为1 min, 30个循环. 延伸72℃ 7 min. 扩增产物用含EB(0.5 mg/L)的20 g/L琼脂糖电泳,电泳缓冲液1×TAE, 6 V/cm恒压电泳40 min. 以标准分子量Marker作参照, 在612, 320和217 bp处出现扩增条带者即相应基因为阳性. 凝胶成像仪拍照记录结果.
| Gene | Primer(5'-3') | length | |
| ipaH | ipaH1 | GTTCCTTGACCGCCTTTCCGATACCGT | 619 bp |
| ipaH2 | GCCGGTCAGCCACCCTCTGAGTAC | ||
| ial | ial-I | CTGGTAGGTATGGTGAGG | 320 bp |
| ial-II | CCAGGCCAACAATTATTT | ||
| ial nested | F | TTTTTAATTAAGAGTGGGGTTTGA | 217 bp |
| R | GAACCTATGTCTACCTTACCAGAAGT |
统计学处理 应用SPSS11.5统计学软件进行统计学处理, 计数资料使用诊断试验的一致性检验(Kappa检验)进行统计学分析, P<0.05差异有统计学意义.
在腹泻患者粪标本71例中, 常规培养生化血清学鉴定方法分离出福氏痢疾杆菌24例, 宋内痢疾杆菌23例, 志贺痢疾杆菌1例, 沙门菌23例. 采用普通PCR法检测48例痢疾杆菌粪标本ipaH基因阳性率100% (48/48); ial基因阳性率70.8%(34/48), 余14例为阴性. 对14例粪标本进而采用巢氏PCR法进行ial基因扩增, 其中12份标本阳性. 在48例痢疾杆菌粪标本中46例ipaH和ial基因双阳性为(46/48). 23例沙门菌粪标本的ipaH和ial基因表达均为阴性. 以上两种方法的诊断一致性检验Kappa = 0.937, 差异有统计学意义(P<0.05, 表2).
| 粪标本培养法 | n | ipaH | Ial | ipaH和Ial |
| 志贺痢疾杆菌 | 1 | 1 | 1 | 1 |
| 福氏痢疾杆菌 | 24 | 24 | 22 | 22 |
| 宋内痢疾杆菌 | 23 | 23 | 23 | 23 |
| 沙门菌 | 23 | 0 | 0 | 0 |
| 合计 | 71 | 48 | 46 | 46 |
对71例腹泻患者粪标本采用PCR和巢氏PCR法, 可得到ipaH和ial基因的特异片段及巢氏ial的特异片段(图1, 图2, 图3). 将扩增得到的ipaH和ial基因特异片段与基因库中发表的标准菌株序列比较, 一致性为100%.
传统的分离培养、生化和血清学试验对痢疾杆菌的诊断既费时又操作繁琐, 并易漏检. 其原因: (1)痢疾杆菌与肠杆菌科某些属(种)表型特征、生化反应的相似性引起传统的分离培养、生化和血清学试验漏检、误诊. 志贺菌与不发酵或迟发酵乳糖的大肠杆菌在常用的选择性和鉴别性分离培养基上均生长良好, 且菌落形态相似, 革兰染色均为阴性无芽孢杆菌. 很难将志贺菌与低活性大肠杆菌区别[4]. (2)在繁琐的传统方法手工操作中失误引起的漏诊. 用取菌环蘸取粪便时, 未取到脓血部分; 取菌环未降温直接接触痢疾杆菌, 活菌死亡, SS琼脂平板上无痢疾杆菌生长; 在挑选可疑菌落时, 经验不足, 无法正确识别痢疾杆菌菌落; 在SS琼脂平板上接种时, 未能使菌落散开, 无法辨别可疑痢疾杆菌菌落; 可疑菌落被其他菌膜覆盖. 以上现象时有发生, 造成的痢疾杆菌漏诊现象与检验人员有无丰富的操作经验有关. 传统的分离培养、生化和血清学试验需要近48 h, 与临床诊断治疗严重脱节, 常常延误了治疗的最佳时机.
多聚酶链反应(PCR)具有快速、高特异性和高敏感性, 已被国外学者用于追踪和检测细菌性腹泻[5], 特别是对菌量较少标本或经药物治疗标本中活菌量不多的标本, 还有血清学标记不能鉴定的腹泻菌种. 全部检验过程包括DNA提取、PCR扩增、电泳仅需3-4 h, 是一种较为理想的检验方法. 国内外报道PCR检测痢疾杆菌方法的建立, 一般选取标准菌株作为研究对象, 需要从粪中分离培养进行血清学鉴定之后提取DNA. 而本试验直接从腹泻患者粪中提取DNA, 进行痢疾杆菌的检测, 快速简便, 省时省力. 目前PCR技术可用于检测粪中与腹泻病有关的微生物有沙门菌、志贺菌与侵袭性大肠杆菌、小肠结肠耶尔森菌、艰难梭菌、霍乱弧菌O139、轮状病毒等. 但是由于粪标本中存在着已知和未知的抑制或干扰PCR检测的成分, 使得这一技术在粪标本检测的应用上受到一定程度的限制. 粪中存在的抑制物包括生物学成分和非生物学成分, 他们可能来自于粪中大量细菌和食物降解的产物, 其中已知的有粪中的胆红质、胆盐、菌体蛋白、复合多糖、DNA分子以及一些重金属离子等, 他们有可能抑制DNA聚合酶的活性或改变反应体系的离子强度从而影响扩增的效果. 研究摸索粪标本的处理方法以及建立适用于检测这类标本的PCR技术一直为人们所关注. 国内外所报道从粪中提取DNA的方法一般是热裂解粗提法, 灵敏度较差[4,6]. 近几年许多行之有效的方法概括起来有两类, 一类是从粪中分离出目的微生物以减少其他微生物的干扰, 如免疫磁珠PCR、选择性增菌培养等; 另一类是从标本中直接提取靶DNA, 再以适当的方法纯化, 如酚-氯仿抽提、柱层析等.
本试验模板DNA的提取使用的是QIAamp层析法(QIAamp DNA Stool Mini Kit), 直接从粪中提取DNA. QIAamp是一种硅胶, 他能选择性结合DNA而分离糖类和蛋白质. 将经过离心、溶菌酶和蛋白酶K处理的粪标本, 用乙醇沉淀后, 过QIAamp柱, 再经Centrisep柱处理, 可消除PCR抑制物, 使检测的灵敏度达1-10 cfu, 特异性99.6%[7-8]. 本试验选择侵袭相关基因座位(ial)、侵袭性质粒抗原H(invasive plasmid, ipaH)为痢疾杆菌的检测基因. ial存在于该菌侵袭大质粒上一个2.5 kb侵袭相关区段中, ipaH同时存在于染色体和侵袭性大质粒上, 两基因的PCR引物能特异检测所有痢疾杆菌. 据文献报道各相关试验选用一种基因(ipaH或是ial基因)进行痢疾杆菌的PCR检测[9-10], 但据2005年Phantouamath et al[2]研究结果表明ipaH PCR结果阳性并不一定发病, 多是痢疾杆菌携带者, 而菌痢患者ipaH和ial基因检测同时阳性. 所以ipaH和ial PCR结果都呈阳性时才能证明是痢疾杆菌感染, 且具有致病性. 本研究选择的71例腹泻患者粪标本, 常规培养生化血清学鉴定方法分离出福氏痢疾杆菌24例, 宋内痢疾杆菌23例, 志贺痢疾杆菌1例, 沙门菌23例. 采用普通PCR法检测结果, 48例痢疾杆菌粪标本ipaH基因阳性率100%(48/48); ial基因阳性率70.8%(34/48), 余14例为阴性, 可能是因ial基因产物存在的一条较大的非特异区带, 影响了特异片段的产量. 对这14例粪标本进而采用巢氏PCR法进行扩增, 12例标本阳性, 2例阴性, 可能是痢疾杆菌在储存期其侵袭大质粒的自发丢失或是质粒编码基因选择性剔除. 48例痢疾杆菌粪标本中46例ipaH和ial基因双阳性(46/48), 表明PCR法有很高的敏感性. 23例沙门菌的粪标本ipaH及ial基因表达均为阴性, 表明PCR法有很高的特异性. PCR方法与常规培养生化血清学鉴定方法的诊断一致性检验Kappa = 0.937, 差异有统计学意义(P<0.05), 说明两种方法的诊断一致性很好, PCR方法可将其代替进行痢疾杆菌的检测.
除了痢疾杆菌, 侵袭性大肠杆菌(EIEC)亦具有ipaH和ial基因. 这将干扰针对ipaH和ial基因的PCR检测方法在菌痢研究中的应用. 所幸的是, 在中国及亚洲地区, 文献报道的EIEC流行率远远低于痢疾杆菌的流行率[11-12], 使得研究结果不至于产生大的偏差. 但如何将两者进行区分鉴定将是今后实验中有待解决的问题.
本实验进行PCR操作, 严格遵守操作规程, 避免产生假阳性. 实验操作在3个不同的区域内进行: 标本处理区、PCR扩增区、产物分析区. 各工作区有一定的隔离, 操作器材专用. PCR扩增所需试剂均在装有紫外灯的超净工作台配制和分装. 高压处理的加样器和吸头固定放于其中, 不交叉使用. 引物和dNTP用高压双蒸水配制后分装储存, 标明时间, 以备发生污染时查找原因. 戴一次性手套, 使用一次性吸头, 吸头不能在空气中长时间暴露, 避免气溶胶的污染. 避免反应液飞溅, 若溅到手套或桌面上, 立刻更换手套并用稀酸擦拭桌面. 制备多份样品的反应混合液时, 先将dNTP、缓冲液、引物和酶混合好, 然后分装, 这样可以减少操作, 避免污染, 又可以增加反应的精确度. 操作时设立阳性和空白对照, 验证PCR反应的可靠性, 协助判断扩增体统的可信性; 对可疑器具用1 mol/L盐酸擦拭或浸泡. 超净工作台使用前、后, 紫外照射30 min. 以上这些措施可以有效的避免PCR假阳性的发生.
与常规培养生化血清学鉴定方法相比较, PCR方法所需费用较高, 但是随着经济的发展,技术的普及运用, 其成本会降低. 临床运用此方法时, 首先要求医院拥有符合要求的检验室及相关仪器. 其次检验人员需经培训, 熟练掌握PCR操作方法, 严格遵守操作规程, 才能保证诊断的准确性.
总之, 利用PCR技术, ipaH和ial引物检测痢疾杆菌, 具有快速、敏感和特异等优点, 尽管不能区分菌种, 但在临床诊断、治疗监测及流行病学调查方面显示出良好的实用性.
痢疾杆菌传统的分离培养、生化和血清学试验需要近48h, 与临床诊断治疗严重脱节, 常常延误了细菌性痢疾治疗的最佳时机. 多聚酶链反应(PCR)具有快速、高特异性和高敏感性, 已被国外学者用于追踪和检测细菌性腹泻.
本实验直接从腹泻患者粪中提取DNA, 进行痢疾杆菌的检测. 选择侵袭相关基因座位(ial)、侵袭性质粒抗原H(invasiveplasmid, ipaH)为痢疾杆菌的检测基因. ipaH和ialPCR结果都呈阳性时才能证明是痢疾杆菌感染, 且具有致病性.
国内外报道PCR检测痢疾杆菌方法的建立, 一般选取标准菌株作为研究对象, 需要从粪中分离培养进行血清学鉴定之后提取DNA. 而本试验直接从腹泻患者粪中提取DNA, 进行痢疾杆菌的检测, 快速简便, 省时省力. 目前PCR技术可用于检测粪中与腹泻病有关的微生物有沙门菌、志贺菌与侵袭性大肠杆菌、小肠结肠耶尔森菌、艰难梭菌、霍乱弧菌O139、轮状病毒等.
利用PCR技术, ipaH和ial引物检测痢疾杆菌, 具有快速、敏感和特异等优点, 尽管不能区分菌种, 但在临床诊断、治疗监测及流行病学调查方面显示出良好的实用性.
侵袭性质粒抗原H(ipaH)基因:是同时存在于痢疾杆菌染色体和侵袭性大质粒上的侵袭基因, 为痢疾杆菌检测基因;侵袭相关基因座位(ial)基因:位于痢疾杆菌侵袭大质粒上一个2.5kb侵袭相关区段中, 为痢疾杆菌具有侵袭性的检测基因.
本文对临床材料的分析, 总结了快速建立诊断腹泻患者粪中痢疾杆菌致病基因ipaH与ial的PCR检测方法, 有较强的临床意义和应用价值.
编辑: 潘伯荣 电编:何基才
| 1. | Noda T, Murakami K, Hamasaki M, Ishiguro Y, Miyahara M. Amplified fragment length polymorphism genotyping of Shigellae and comparison to pulsed-field gel electrophoresis and colicin typing. Kansenshogaku Zasshi. 2006;80:513-521. [PubMed] |
| 2. | Phantouamath B, Sithivong N, Insisiengmay S, Ichinose Y, Higa N, Song T, Iwanaga M. Pathogenicity of Shigella in healthy carriers: a study in Vientiane, Lao People's Democratic Republic. Jpn J Infect Dis. 2005;58:232-234. [PubMed] |
| 3. | Lindqvist R. Detection of Shigella spp. in food with a nested PCR method-sensitivity and performance compared with a conventional culture method. J Appl Microbiol. 1999;86:971-978. [PubMed] |
| 4. | Dutta S, Chatterjee A, Dutta P, Rajendran K, Roy S, Pramanik KC, Bhattacharya SK. Sensitivity and performance characteristics of a direct PCR with stool samples in comparison to conventional techniques for diagnosis of Shigella and enteroinvasive Escherichia coli infection in children with acute diarrhoea in Calcutta, India. J Med Microbiol. 2001;50:667-674. [PubMed] |
| 6. | Vu DT, Sethabutr O, Von Seidlein L, Tran VT, Do GC, Bui TC, Le HT, Lee H, Houng HS, Hale TL. Detection of Shigella by a PCR assay targeting the ipaH gene suggests increased prevalence of shigellosis in Nha Trang, Vietnam. J Clin Microbiol. 2004;42:2031-2035. [PubMed] |
| 7. | Collins E, Glennon M, Hanley S, Murray AM, Cormican M, Smith T, Maher M. Evaluation of a PCR/DNA probe colorimetric membrane assay for identification of Campylobacter spp. in human stool specimens. J Clin Microbiol. 2001;39:4163-4165. [PubMed] |
| 9. | Farshad S, Sheikhi R, Japoni A, Basiri E, Alborzi A. Characterization of Shigella strains in Iran by plasmid profile analysis and PCR amplification of ipa genes. J Clin Microbiol. 2006;44:2879-2883. [PubMed] |
| 10. | Aranda KR, Fagundes-Neto U, Scaletsky IC. Evaluation of multiplex PCRs for diagnosis of infection with diarrheagenic Escherichia coli and Shigella spp. J Clin Microbiol. 2004;42:5849-5853. [PubMed] |
| 11. | Phantouamath B, Sithivong N, Insisiengmay S, Higa N, Toma C, Nakasone N, Iwanaga M. The incidence of Escherichia coli having pathogenic genes for diarrhea: a study in the People's Democratic Republic of Lao. Jpn J Infect Dis. 2003;56:103-106. [PubMed] |
| 12. | Sarantuya J, Nishi J, Wakimoto N, Erdene S, Nataro JP, Sheikh J, Iwashita M, Manago K, Tokuda K, Yoshinaga M. Typical enteroaggregative Escherichia coli is the most prevalent pathotype among E. coli strains causing diarrhea in Mongolian children. J Clin Microbiol. 2004;42:133-139. [PubMed] |