修回日期: 2007-05-11
接受日期: 2007-05-22
在线出版日期: 2007-07-08
目的: 探讨共轭三烯酸抑制肝癌细胞体外增殖的作用机制.
方法: 采用细胞增殖试验(MTT法)、克隆形成试验、Brdu掺入实验(20 g/L, 12 h)研究共轭三烯酸对人正常肝细胞L-02, 人肝癌细胞系SMMC-7721和鼠肝癌细胞系Hepa1-6的体外增殖抑制作用; Hoechst33342荧光染色, 流式细胞术检测细胞凋亡和细胞周期分布.
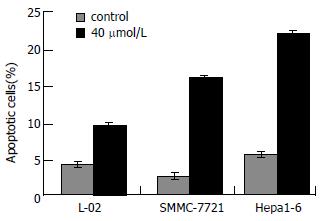
结果: 共轭三烯酸处理后, 肿瘤细胞增殖活性降低(SMMC-7721: 1.5±2.6 vs 1.9±12.3, P<0.05; Hepa1-6: 1.0±1.5 vs 1.2±9.7, P<0.05), 克隆形成下降(SMMC-7721: 149.3±3.1 vs 191.7±5.8, P<0.05; Hepa1-6: 32.7±3.1 vs 61.3±4.2, P<0.05), Brdu标记指数降低(SMMC-7721: 42.3%±1.5% vs 63.6%±0.7%, P<0.05; Hepa1-6: 59.5%±0.7% vs 79.6%±1.6%, P<0.05), 凋亡细胞增多(SMMC-7721: 48.9%±0.7% vs 9.9%±0.4%, P<0.05; Hepa1-6: 65.1%±1.1% vs 15.9%±0.7%, P<0.05); 凋亡指数升高(SMMC-7721: 16.3%±0.7% vs 3.3%±0.4%, P<0.05; Hepa1-6: 21.7%±1.1% vs 5.3%±0.4%, P<0.05), G0/G1期细胞数增加(SMMC-7721: 48.4%±1.8% vs 38.0%±2.1%, P<0.01; Hepa1-6: 53.4%±2.1% vs 41.1%±0.7%, P<0.01), S期细胞数减少(SMMC-7721: 32.2%±2.9% vs 37.2%±1.9%, P<0.05; Hepa1-6: 28.3%±0.9% vs 39.9%±0.9%, P<0.01).
结论: 共轭三烯酸对肿瘤细胞的增殖有显著抑制作用, 其作用机制可能为抑制肿瘤细胞DNA合成, 诱导肿瘤细胞凋亡及细胞周期阻滞.
引文著录: 吴亚英, 王修杰, 林苹, 张洁, 任婧婧, 杨洪亮, 高艳萍, 刘凯. 共轭三烯酸抑制肝癌细胞体外增殖和凋亡诱导的作用. 世界华人消化杂志 2007; 15(19): 2108-2113
Revised: May 11, 2007
Accepted: May 22, 2007
Published online: July 8, 2007
AIM: To investigate the effects of conjugated trienoic fatty acids on the proliferation of hepatocellular carcinoma cells and to elucidate the mechanism of their activity.
METHODS: Normal liver, hepatocellular carcinoma SMMC-7721 and hepa1-6 cells were tested in vitro for cytotoxicity, colony formation inhibition, BrdU incorporation, Hoechst 33342 apoptotic cell staining, and cell cycle distribution, through flow cytometry (FCM) after treatment with conjugated trienoic fatty acids.
RESULTS: After conjugated trienoic fatty acid treatment, proliferation, colony formation and BrdU labeling indices of cancer cells decreased (proliferation: SMMC-7721, 1.5 ± 2.6 vs 1.9 ± 12.3, P < 0.05; Hepa1-6, 1.0 ± 1.5 vs 1.2 ± 9.7, P < 0.05; colony formation: SMMC-7721, 149.3 ± 3.1 vs 191.7 ± 5.8, P < 0.05; Hepa1-6, 32.7 ± 3.1 vs 61.3 ± 4.2, P < 0.05; BrdU labeling indices: SMMC-7721, 42.3% ± 1.5% vs 63.6% ± 0.7%, P < 0.05; Hepa1-6, 59.5% ± 0.7% vs 79.6% ± 1.6%, P < 0.05); and Hoechst 33342 stained apoptotic cells increased (SMMC-7721, 48.9% ± 0.7% vs 9.9% ± 0.4%, P < 0.05; Hepa1-6, 65.1% ± 1.1% vs 15.9% ± 0.7%, P < 0.05). By FCM, the apoptotic indices increased (SMMC-7721, 16.3% ± 0.7% vs 3.3% ± 0.4%, P < 0.05; Hepa1-6, 21.7% ± 1.1% vs 5.3% ± 0.4%, P < 0.05), the number of cells in G0/G1 phase increased (SMMC-7721, 48.4% ± 1.8% vs 38.0% ± 2.1%, P < 0.01; Hepa1-6, 53.4% ± 2.1% vs 41.1% ± 0.7%, P < 0.01) and the number in S phase decreased (SMMC-7721, 32.2% ± 2.9% vs 37.2% ± 1.9%, P < 0.05; Hepa1-6, 28.3% ± 0.9% vs 39.9% ± 0.9%, P < 0.05).
CONCLUSION: The findings suggest that conjugated trienoic fatty acids induce cytotoxicity in hepatocellular carcinoma cells, and that the mechanism of their activity might be associated with the inhibition of DNA synthesis, induction of apoptosis and cell cycle arrest in cancer cells.
- Citation: Wu YY, Wang XJ, Lin P, Zhang J, Ren JJ, Yang HL, Gao YP, Liu K. Proliferation inhibition and apoptosis induction of conjugated trienoic fatty acids in hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2108-2113
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2108.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2108
共轭亚油酸(conjugated linoleic acid, CLA)或共轭二烯酸(conjugated dienoic fatty acid, CLA)是一类含有共轭双键的亚油酸(linoleum acid, LA)的同分异构体混合物. CLA具有许多生理活性, 如调节脂类代谢, 重新分配体脂, 抗动脉粥样硬化, 增强人体免疫功能, 防治高血压和糖尿病等[1-3]. CLA还与肿瘤发生、发展有关[4-5], 抑制人乳腺癌细胞MDA2MB468[6]、小鼠乳腺癌细胞4526[7]和人前列腺癌细胞DU2145[8]在动物体内的转移. CLA存在着多种位置和几何异构体, 不同的异构体其生理活性不尽相同, 其中以顺-9, 反-11-十八碳二烯酸活性最强. 共轭三烯酸(conjugated trienoic fatty acids, TCLA)是CLA的另一种异构体, 比共轭二烯酸(conjugated dienoic fatty acid, CLA)具有更强的抗癌活性[9], 体外实验研究发现, TCLA对人结直肠腺癌细胞DLD-1, 肝癌细胞HepG2, 肺癌细胞A549, 乳腺癌细胞MCF-7等肿瘤细胞都具有细胞毒作用[10], 但对化学致癌剂诱发的大鼠乳腺癌和结肠癌的发生无预防作用[11]. 现探讨TCLA对肿瘤细胞的增殖抑制作用及其作用机制, 如下.
人肝细胞L-02, 人肝癌细胞SMMC-7721和鼠肝癌细胞Hepa1-6由本实验室常规保存备用. TCLA按文献[10-11]方法修改制备, 用无水乙醇配制成浓度为200 mmol/L储备液, -20℃保存备用, 临用时配制成所需浓度. RPMI 1640购自Gibco/BRL公司(Invitrogen Corporation, USA), 新生小牛血清为成都哈里生物工程有限公司产品, 胰酶及二甲亚砜(DMSO)购自北京华美生物技术公司, 噻唑蓝(MTT)、5-溴脱氧尿苷(Brdu)为Sigma公司产品, Anti-Brdu抗体为Zymed公司产品, S-P试剂盒(SP9001)购自北京中杉金桥生物技术有限公司, Hoechst33342为南京凯基生物科技发展有限公司产品.
用含100 g/L小牛血清、 100 g/L链霉素、100 kU/L青霉素的RPMI 1640培养基, 37℃, 50 mL/L CO2培养箱中培养. 用2.5 g/L trypsin和/或0.2 g/L EDTA消化传代. 取对数生长期细胞用于实验.
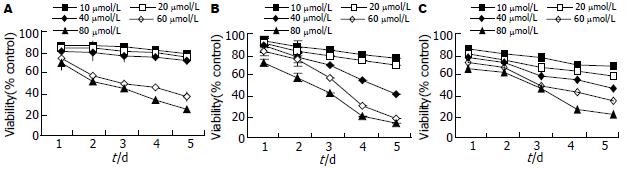
1.2.1 细胞增殖试验: 调整细胞浓度为1×107/L, 接种于96孔板, 每孔200 μL, 培养过夜使细胞贴壁, 次日分别用不同剂量的TCLA(10, 20, 40, 60, 80 μmol/L)分别处理肿瘤细胞和正常细胞, 对照组不处理, 每个剂量组接种3个复孔, 置37℃, 50 mL/L CO2培养. 分别于培养1, 2, 3, 4, 5 d后, 取1个培养板, 每孔加入5 g/L MTT试剂10 μL, 继续培养4 h, 再加1000 g/L DMSO 150 μL , 振荡混匀15 min, 用酶标仪(λ = 570 nm)测定A值(A值与活细胞数成正比). 同时计算细胞存活率. 细胞存活率 = (实验组A值-本底A值)/(对照组A值-本底A值)×100%, 实验重复3次.
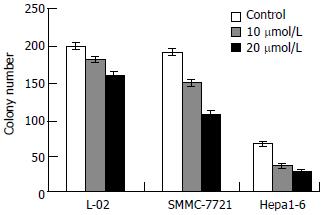
1.2.2 克隆形成实验: 调整细胞浓度, 接种于6孔板, 每孔细胞数为300-500个, 每一剂量组接种3孔, 培养过夜使细胞贴壁, 次日分别用不同剂量的TCLA(10, 20, 40 μmol/L)分别处理肿瘤细胞和正常细胞, 对照组不处理, 置37℃, 50 mL/L CO2培养10 d, 甲醇固定, Gimsa染色, 低倍镜下观察克隆形成, 以大于50个细胞为标准, 计数各孔克隆数, 取其平均值, 计算克隆形成抑制率, 实验重复3次.
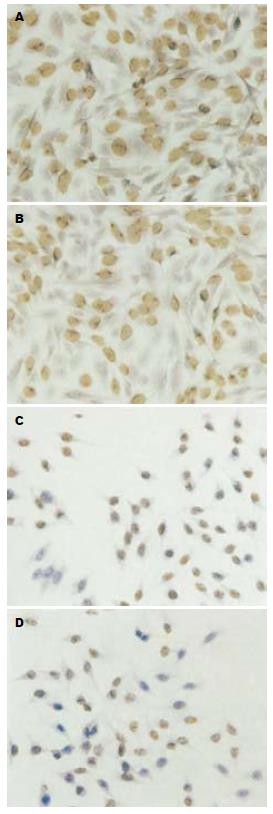
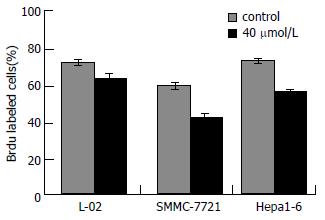
1.2.3 Brdu掺入实验[12] 分别接种肿瘤细胞和正常细胞于置有盖玻片的6孔板内, 5×105/孔, 培养过夜, 用40 μmol/L TCLA处理细胞, 对照组不处理. 36 h后加入20 g/L Brdu, 继续培养12 h, 固定(甲醇:丙酮 = 1:1)细胞贴片, 按照S-P试剂盒(SP9001)操作. 显微镜下计数3个视野下的阳性和阴性细胞数. 计算阳性细胞百分率即阳性细胞百分率 = 阳性细胞数/(阳性细胞+阴性细胞数)×100%.
1.2.4 Hoechst33342荧光染色检测细胞凋亡[13] 取对数生长期的L-02, SMMC-7721, Hepa1-6分别按5×105, 3×105, 5×105个细胞接种于50 mL培养瓶中, 培养过夜使细胞贴壁, 次日用40 μmol/L TCLA处理细胞, 对照组不处理, 作用72 h后, 按照Hoechst33342凋亡试剂盒进行操作, 荧光显微镜观察, 记录凋亡细胞数, 每组观察细胞数>200.
1.2.5 细胞周期检测(流式细胞术): 用40 μmol/L TCLA分别处理肿瘤细胞和正常细胞, 对照组不处理. 72 h后收集各组细胞, 用700 mL/L冰乙醇固定, 加10 g/L RNA酶37℃孵育30 min, 用碘化丙啶(50 g/L)一步插入法DNA染色, 上流式细胞仪检测细胞周期分布及凋亡细胞.
统计学处理 所有实验数据计算均数和标准差, 细胞增殖实验资料用方差分析处理, 其他实验数据用χ2检验处理, P<0.05为差异有显著性.
TCLA对人肝细胞、人肝癌细胞、鼠肝癌细胞的增殖均有抑制作用. 随着剂量增加和时间的延长增殖抑制作用逐渐增强, 呈剂量和时间效应关系(P<0.05, 图1). 当剂量为10和20 μmol/L时对正常细胞增殖比对肿瘤细胞的影响小(P<0.05).
TCLA对肿瘤细胞克隆形成有明显的抑制作用, 其抑制作用与剂量成正相关(P<0.05, 图2). 当剂量为40 μmol/L时克隆形成抑制率为100%. 对正常细胞的作用明显小于肿瘤细胞(P<0.05, 图3A-D).
对照组人肝细胞、人肝癌细胞及鼠肝癌细胞的Brdu标记指数分别为80.9%±1.3%, 63.6%±0.7%和79.6%±1.6%, 用40 μmol/L TCLA处理72 h后, 其标记指数分别为69.9%±4.3%, 42.3%±1.5%和59.5%±0.8%. TCLA处理后使肿瘤细胞标记指数降低(P<0.05, 图4). 对正常细胞的影响小于肿瘤细胞(P<0.05).
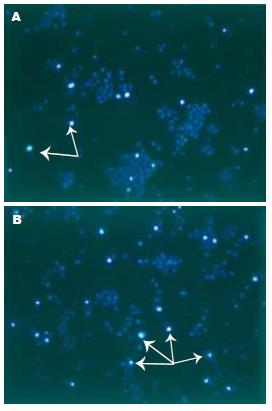
肿瘤细胞经40 μmol/L TCLA处理72 h后, 凋亡细胞显著增加(P<0.05, 图5, 6). 同等剂量下, TCLA对正常细胞的影响没有肿瘤细胞大(P<0.05).
用40 μmol/L TCLA处理肿瘤细胞72 h, 凋亡指数和G0/G1期细胞数增加(P<0.05), S期细胞数减少(P<0.05, 表1).
| 细胞 | 处理 | 凋亡指数 | G0/G期 | S期 | G2/M期 | 增殖指数 |
| L-02 | 对照 | 5.5±0.4 | 31.8±3.6 | 47.3±1.0 | 20.9±4.0 | 68.2±3.6 |
| TCLA | 11.1±0.7a | 38.0±1.9a | 46.4±0.7 | 15.6±2.5a | 62.0±1.9b | |
| SMMC-7721 | 对照 | 3.5±0.6 | 38.0±2.1 | 37.2±1.9 | 21.1±1.9 | 62.0±1.7 |
| TCLA | 13.6±2.9d | 48.4±1.8d | 32.2±2.9c | 19.4±4.2 | 51.6±1.8d | |
| Hepa1-6 | 对照 | 4.8±0.8 | 41.1±0.7 | 39.9±0.9 | 19.0±1.1 | 58.9±0.7 |
| TCLA | 16.4±0.6e | 53.4±2.1e | 28.3±0.9e | 18.3±1.8 | 46.6±2.1e |
CLA是食物中的天然成分, 最早由Ha et al[14], Ip et al[15]从研磨的牛肉中发现, 以后相继在奶及其制品中发现(每克脂肪中含量为3-9 mg)[16-17]. 研究表明, 膳食补充CLA可以抑制鼠前列腺癌、直肠癌、皮肤癌、大鼠乳腺癌细胞生长[8,18-20]. 体外研究发现, CLA能抑制人肝癌细胞的增殖, 对人恶性黑色素瘤、结肠癌、直肠癌及乳腺癌细胞的生长均有抑制作用[21-22]. TCLA是CLA的另一种异构体, 该异构体有无抗癌活性, 既往研究结果极不一致[9-11], Tsuzuki et al[9]研究发现, TCLA对肝癌细胞HepG2、肺癌细胞A549、白血病细胞HL-60的体外增殖抑制作用和对人结直肠腺癌DLD-1的体内生长抑制均强于其他CLA异构体[9]; Igarashi et al[10]也研究证实, TCLA对人结直肠腺癌细胞DLD-1、肝癌细胞HepG2、肺癌细胞A549、乳腺癌细胞MCF-7等肿瘤细胞的体外增殖抑制作用比CLA强; 但对化学致癌剂诱发的大鼠乳腺癌和结肠癌的发生无预防作用[11]. 因此, TCLA的抗癌活性尚需进一步研究证实.
我们的研究结果表明, TCLA对人、鼠肝癌细胞的增殖均有显著地抑制作用P<0.05, 并具有时间、剂量效应关系, 剂量为40 μmol/L时, 可以完全抑制正常细胞和肿瘤细胞的克隆形成. 肿瘤细胞用TCLA 40 μmol/L处理72 h后, Brdu标记处理组细胞显著低于未处理细胞. 结果提示, TCLA抑制了肿瘤细胞DNA合成, 使Brdu掺入减少P<0.05. Hoechst33342荧光染色, 经TCLA 40 μmol/L处理72 h的肿瘤细胞凋亡细胞显著增加P<0.05, 流式细胞仪检测进一步证实TCLA处理使肿瘤细胞凋亡指数和G0/G1期细胞数增加. 结果表明, TCLA可诱导肿瘤细胞凋亡和G0/G1期阻滞. 同时TCLA对正常肝细胞的增殖也有一定程度的抑制作用, 当剂量<20 μmol/L时, 对正常细胞增殖、凋亡及细胞周期无明显影响, 当剂量为40 μmol/L时, 对正常细胞的影响没有对肿瘤细胞明显P<0.05. 所以TCLA的毒性作用也必须引起重视.
总之, TCLA对人、鼠肝癌细胞的增殖有显著地抑制作用, 其作用机制可能与抑制肿瘤细胞DNA合成, 诱导肿瘤细胞凋亡及细胞周期阻滞有关. 但其毒副作用亦不容忽视, 值得进一步深入研究.
共轭亚油酸(Conj-ugatedlinoleicacid, CLA)或共轭二烯酸(conjugateddienoicfattyacid, CLA)是一系列在碳9、11或10、12位具有双键的亚油酸, 存在于反刍动物的肉、奶及其制品中, 但含量较低. 大量的科学研究证明, 共轭亚油酸具有抗肿瘤、抗氧化、抗动脉粥样硬化、提高免疫力等多种重要生理功能. 共轭三烯酸(conjugatedtrienoicfattyacids, TCLA)是CLA的另一种异构体, 在某些植物中含量较高, 他是否具有CLA相似或更强的抗癌作用还有待进一步的研究.
CLA对人类健康的诸项作用都是试验有据的, 日、美等一些国家已有大量的含有共轭亚油酸的功能食品面世, 而我国关于共轭亚油酸的研究才刚刚起步.
TCLA是CLA的另一种异构体, 该异构体有无抗癌活性, 国内尚无相关研究. 有研究发现TCLA对肝癌细胞HepG2、肺癌细胞A549、白血病细胞HL-60的体外增殖抑制作用和对人结直肠腺癌DLD-1的体内生长抑制均强于其他CLA异构体,但对化学致癌剂诱发的大鼠乳腺癌和结肠癌的发生无预防作用, 因此, TCLA的抗癌活性尚需进一步研究证实.
CLA是食物中的天然成分, 研究表明具有多种重要的生理功能, TCLA作为CLA的一种异构体, 具有更强的抗癌活性, 文章探讨了TCLA对人正常肝细胞, 人肝癌细胞, 鼠肝癌细胞的体外作用及其作用机制, 为进一步研究TCLA的抗癌作用提供理论依据.
Brdu(5-bromo-2-deoxyuridine), 中文全名5-溴脱氧尿嘧啶核苷, 为胸腺嘧啶的衍生物, 可代替胸腺嘧啶在DNA合成期(S期), 活体注射或细胞培养加入, 而后利用抗BrdumAb或多抗的免疫化学法, 显示增殖细胞. 标记阳性细胞为光镜下致密覆盖于胞核上的褐色沉淀物. 可判断增殖细胞的种类, 增殖速度, 对研究细胞动力学有重要意义. 由于BrdU标记方法敏感、简单和迅速, 该技术在肿瘤增殖动力学领域应用非常广泛.
本文研究了共轭三烯酸对肝癌细胞增殖抑制和凋亡的诱导作用, 方法多样, 技术先进, 结果可信, 有一定的学术价值.
编辑: 潘伯荣 电编:何基才
| 1. | Park Y, Albright KJ, Liu W, Storkson JM, Cook ME, Pariza MW. Effect of conjugated linoleic acid on body composition in mice. Lipids. 1997;32:853-858. [PubMed] |
| 2. | West DB, Blohm FY, Truett AA, DeLany JP. Conjugated linoleic acid persistently increases total energy expenditure in AKR/J mice without increasing uncoupling protein gene expression. J Nutr. 2000;130:2471-2477. [PubMed] |
| 3. | Schonberg S, Krokan HE. The inhibitory effect of conjugated dienoic derivatives (CLA) of linoleic acid on the growth of human tumor cell lines is in part due to increased lipid peroxidation. Anticancer Res. 1995;15:1241-1246. [PubMed] |
| 4. | Pariza MW, Park Y, Cook ME. Mechanisms of action of conjugated linoleic acid: evidence and speculation. ProcSoc Exp Bi. ol Med. 2000;223:8-13. [PubMed] |
| 5. | Belury MA. Conjugated dienoic linoleate: a polyunsaturated fatty acid with unique chemoprotective properties. Nutr Rev. 1995;53:83-89. [PubMed] |
| 6. | Visonneau S, Cesano A, Tepper SA, Scimeca JA, Santoli D, Kritchevsky D. Conjugated linoleic acid suppresses the growth of human breast adenocarcinoma cells in SCID mice. Anticancer Res. 1997;17:969-973. [PubMed] |
| 7. | Hubbard NE, Lim D, Summers L, Erickson KL. Reduction of murine mammary tumor metastasis by conjugated linoleic acid. Cancer Lett. 2000;150:93-100. [PubMed] |
| 8. | Cesano A, Visonneau S, Scimeca JA, Kritchevsky D, Santoli D. Opposite effects of linoleic acid and conjugated linoleic acid on human prostatic cancer in SCID mice. Anticancer Res. 1998;18:1429-1434. [PubMed] |
| 9. | Tsuzuki T, Tokuyama Y, Igarashi M, Miyazawa T. Tumor growth suppression by alpha-eleostearic acid, a linolenic acid isomer with a conjugated triene system, via lipid peroxidation. Carcinogenesis. 2004;25:1417-1425. [PubMed] |
| 10. | Igarashi M, Miyazawa T. Newly recognized cytotoxic effect of conjugated trienoic fatty acids on cultured human tumor cells. Cancer Lett. 2000;148:173-179. [PubMed] |
| 11. | Kitamura Y, Yamagishi M, Okazaki K, Umemura T, Imazawa T, Nishikawa A, Matsumoto W, Hirose M. Lack of chemopreventive effects of alpha-eleostearic acid on 7,12-dimethylbenz[a]anthracene (DMBA) and 1,2-dimethylhydrazine (DMH)-induced mammary and colon carcinogenesis in female Sprague-Dawley rats. Food Chem Toxicol. 2006;44:271-277. [PubMed] |
| 12. | Kyle AH, Huxham LA, Baker JH, Burston HE, Minchinton AI. Tumor distribution of bromodeoxyuridine-labeled cells is strongly dose dependent. Cancer Res. 2003;63:5707-5711. [PubMed] |
| 13. | Pariza MW, Loretz LJ, Storkson JM, Holland NC. Mutagens and modulator of mutagenesis in fried ground beef. Cancer Res. 1983;43:2444-2446. [PubMed] |
| 14. | Ha YL, Grimm NK, Pariza MW. Anticarcinogens from fried ground beef: heat-altered derivatives of linoleic acid. Carcinogenesis. 1987;8:1881-1887. [PubMed] |
| 15. | Ip C, Chin SF, Scimeca JA, Pariza MW. Mammary cancer prevention by conjugated dienoic derivative of linoleic acid. Cancer Res. 1991;51:6118-6124. [PubMed] |
| 16. | Ip C, Singh M, Thompson HJ, Scimeca JA. Conjugated linoleic acid suppresses mammary carcinogenesis and proliferative activity of the mammary gland in the rat. Cancer Res. 1994;54:1212-1215. [PubMed] |
| 17. | Kritchevsky D. Antimutagenic and some other effects of conjugate d linoleic acid. Br J Nutr. 2000;83:459-465. [PubMed] |
| 18. | Thomas Yeung CH, Yang L, Huang Y, Wang J, Chen ZY. Dietary conjugated linoleic acid mixture affects the activity of intestinal acyl coenzyme A: cholesterol acyltransferase in hamsters. Br J Nutr. 2000;84:935-941. [PubMed] |
| 19. | Liew C, Schut HA, Chin SF, Pariza MW, Dashwood RH. Protection of conjugated linoleic acids against 2-amino-3-methylimidazo[4,5-f]quinoline-induced colon carcinogenesis in the F344 rat: a study of inhibitory mechanisms. Carcinogenesis. 1995;16:3037-3043. [PubMed] |
| 20. | Ip C, Ip MM, Loftus T, Shoemaker S, Shea-Eaton W. Induction of apoptosis by conjugated linoleic acid in cultured mammary tumor cells and premalignant lesions of the rat mammary gland. Cancer Epidemiol Biomarkers Prev. 2000;9:689-696. [PubMed] |
| 21. | Miller A, Stanton C, Devery R. Cis 9, trans 11- and trans 10, cis 12-conjugated linoleic acid isomers induce apoptosis in cultured SW480 cells. Anticancer Res. 2002;22:3879-3887. [PubMed] |
| 22. | Yamasaki M, Chujo H, Koga Y, Oishi A, Rikimaru T, Shimada M, Sugimachi K, Tachibana H, Yamada K. Potent cytotoxic effect of the trans10, cis12 isomer of conjugated linoleic acid on rat hepatoma dRLh-84 cells. Cancer Lett. 2002;188:171-180. [PubMed] |