修回日期: 2007-05-01
接受日期: 2007-05-16
在线出版日期: 2007-07-08
目的: 探讨多巴脱羧酶(DDC)在胃癌侵袭转移过程中的作用.
方法: 体外合成多巴脱羧酶的小干扰RNA(siRNA-DDC), 转染人胃癌细胞系BGC823, 逆转录酶链式反应(RT-PCR)和免疫印迹法(Western blot)方法检测DDC基因和蛋白表达的变化, 体外侵袭实验检测转染后细胞侵袭能力的变化.
结果: RT-PCR和Western blot显示siRNA-DDC转染胃癌细胞系BGC823之后, 其DDC的基因和蛋白表达明显受到抑制(0.27±0.09 vs 0.89±0.14; 0.39±0.12 vs 1.26±0.19, 均P<0.05); 而未转染组和阴性对照组间并无明显差异. 体外侵袭实验显示转染后胃癌细胞数明显低于未转染组和阴性对照组(6.48±3.62 vs 23.72±3.24, 22.38±3.84, 均P<0.05). 提示抑制DDC基因表达能显著降低胃癌细胞的侵袭能力.
结论: siRNA-DDC能明显抑制胃癌细胞BGC823的DDC表达, 从而抑制胃癌细胞的侵袭转移能力.
引文著录: 赵丹懿, 徐惠绵, 尚超. 多巴脱羧酶小干扰RNA体外对胃癌细胞侵袭转移能力的影响. 世界华人消化杂志 2007; 15(19): 2097-2100
Revised: May 1, 2007
Accepted: May 16, 2007
Published online: July 8, 2007
AIM: To explore the effect of dopa decarboxylase (DDC) on the invasion and metastasis of gastric cancer cell.
METHODS: DDC-specific small interfering RNA was constructed in vitro and then transfected into human gastric cancer cell line BGC823. The mRNA and protein expression of DDC were examined by reverse transcriptase polymerase chain reaction (RT-PCR) and Western blotting methods, respectively. The invasive and metastatic ability of cancer cell were assessed by invasion assay in vitro.
RESULTS: After siRNA transfecting into human gastric cancer cell line BGC823, the expression of DDC mRNA and protein was significantly inhibited by RT-PCR and Western blot methods (0.27 ± 0.09 vs 0.89 ± 0.14; 0.39 ± 0.12 vs 1.26 ± 0.19, both P < 0.05); there were no significant changes in untransduced group and negative control group. The invasion assay demonstrated that the number of gastric cancer cell in transfection group was significantly lower than that in untransduced group and negative control group (6.48 ± 3.62 vs 23.72 ± 3.24, 22.38 ± 3.84, P < 0.05), which suggested that the inhibition effect of DDC gene expression can obviously decrease the invasion ability of gastric cancer cell.
CONCLUSION: The siRNA of DDC gene can effectively inhibit the mRNA and protein expression of DDC, and then restrain the invasion and metastasis ability of gastric cancer cell BGC823.
- Citation: Zhao DY, Xu HM, Shang C. Effect of dopa decarboxylase specific small interfering RNA on invasion and metastasis of gastric cancer cell. Shijie Huaren Xiaohua Zazhi 2007; 15(19): 2097-2100
- URL: https://www.wjgnet.com/1009-3079/full/v15/i19/2097.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i19.2097
胃癌是我国人群中发病率和死亡率均占第1位的恶性肿瘤, 而胃癌的转移是胃癌患者根治术后死亡的主要原因之一[1], 因此阐明胃癌转移的分子机制并发现新的防治靶点具有重要的理论和实践意义. 以往研究发现, 多巴脱羧酶(dopa decarboxylase, DDC)在胃癌侵袭转移过程中起重要作用. 我们发现, DDC基因与胃癌腹膜转移特异性相关. 探讨DDC基因在胃癌转移过程中的作用, 可以为今后胃癌的基因治疗以及转移预防提供新的靶点. 我们采用RNA干扰技术, 在体外合成能够特异性抑制DDC基因表达的siRNA, 转染人胃癌细胞株BGC823, 用RT-PCR和Western blot方法检测转染后胃癌细胞DDC基因的表达情况, 并通过体外侵袭实验观察转染后胃癌细胞侵袭能力的变化, 旨在探讨DDC基因在胃癌侵袭转移中的作用.
Ambion SilencerTM siRNA Construction Kit购自Ambion公司, 转染试剂TransMessenger购自Qiagen公司, RNA提取试剂TRIzol购自Invitrogen公司, 反转录试剂盒购自Promega公司, DDC多克隆抗体购自Santa Cruz公司, 蛋白印迹相关试剂购自碧云天公司, 人胃癌细胞系BGC823由中国医科大学细胞生物实验室提供. 胃癌细胞BGC823培养于含100 mL/L小牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI 1640培养基, 培养条件为37℃, 50 mL/LCO2. 实验选用对数生长期细胞, 通过2 g/L胰蛋白酶消化后收集. 小鼠成纤维细胞NIH3T3细胞的培养同前.
小干扰RNA(small interfering RNA, siRNA)体外合成引物设计由Ambion公司提供的网上在线设计工具, 网址为: http://www.ambion.com/techlib/misc/sirna_finder.html, 模板长29个碱基, 含与T7启动子序列互补的8个碱基和与靶基因对应的21个碱基. 实验中所用DDC模板序列为: 5'-AACTACATGGAAGGCATTGAGCCTGTCTC-3'(反义), 5'-AACTCAATGCCTTCCATGTAGCCTGTCTC-3'(正义)(124-143, NM 000790), 另外设计阴性对照, 序列为5'-AAGATCAAGCGGATTGACTAGCCTGTCTC-3'(反义), 5'-AACTACTTGACTGAATCCTCGCCTGTCTC-3'(正义). 用Ambion SilencerTM siRNA Construction Kit体外合成正义链和反义链RNA并退火形成双链RNA(double strand RNA, dsRNA).
siRNA转染前1 d, 将对数生长期的人胃癌细胞BGC823消化、离心、重悬, 4×105个/孔接种于6孔板上, d 2当细胞融合达80%左右时进行转染. 靶基因siRNA的转染用TransMessenger转染试剂(Qiagen, Chatsworth, CA). 按说明书操作, siRNA(每孔1 μg, 6孔板)通过Enhanser R试剂浓缩并与TransMessenger 4 μL形成复合物. 转染复合物稀释到900 μL无抗菌素培养基中培养中, 与细胞混合; 2 h后PBS洗1次, 然后用正常培养基培养. d 3分析mRNA抑制程度, d 5分析蛋白质抑制程度. d 7用体外侵袭实验分析细胞侵袭力.
1.2.1 RNA提取及RT-PCR检测: TRIzol法提取细胞总RNA, 反转录成cDNA. 人DDC上游引物: 5'-TTCAGGGCTTATCACTGACT-3', 下游引物: 5'-GCAGAAGAGCTTCATTCACT-3', 扩增长度为257 bp. 内参照人β-actin上游引物: 5'-CCAGATCATGTTTGAGACCT-3', 下游引物: 5'-TTGAAGGTAGTTTCGTGGAT-3', 扩增长度为480 bp. 反应体系: 95℃ 5 min, 94℃ 30 s, 56℃ 30 s, 72℃ 45 s, 循环30次. PCR产物在10 g/L琼脂糖凝胶中电泳, 自动电泳凝胶成像分析系统下成像分析. 软件分析条带的灰度值, 以β-actin基因为内参考修正目的条带的灰度值得到目的基因表达的相对值(后面的Western Blot结果也按此方法分析).
1.2.2 Western blot检测: 收集细胞, 加入裂解缓冲液静置10 min, 4℃ 12 000 r/min离心1 h, 取上清; 样品(蛋白)浓度的定量; 样品调成相同浓度, 加入5×SDS凝胶加样缓冲液, 沸水煮5 min; 蛋白电泳40 V 90 min然后转为80 V 120 min; 转印40 V 2 h; TBS浸泡10 min; 50 g/L脱脂奶粉封闭1 h, TTBS洗5 min×2; 一抗稀释500倍4℃杂交过夜; TTBS洗5 min×2; 二抗稀释1000倍4℃杂交2 h; TTBS洗5 min×2, ECL显色; 获取图像.
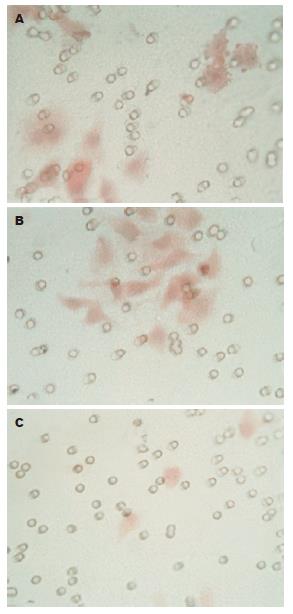
1.2.3 细胞体外侵袭实验: 转染胃癌细胞BGC823 7 d时, 用2 g/L胰蛋白酶消化、收集, 制成单细胞悬液, 调整细胞浓度为1×109个/L. 将Millicell培养小室(直径8 μm, 装有聚碳酸酯微孔膜, 附有人工基质Matrigel)放入24孔板中, 各取细胞悬液200 uL加入Millicell小室, 在小室的下室加入400 μL无血清培养24 h的小鼠成纤维细胞NIH3T3细胞上清液, 每处理组各设3个复孔. 培养8 h后取出小室, 用棉签轻擦净小室内的细胞, 并小心切取微孔膜, 950 mL/L酒精固定, 苏木素伊红染色. 随机于400倍显微镜下取上、下、左、右、中心共5个视野计数穿膜细胞数, 取各视野的平均数表示肿瘤细胞的侵袭能力.
统计学处理 利用SPSS11.5软件对组间差异进行方差分析.
siRNA-DDC分别转染BGC823细胞3 d后, 与阴性对照组相比, DDC mRNA表达明显下调, 其表达的相对值由0.89±0.14降至0.27±0.09(P<0.05), 而未转染组和阴性对照组间并无明显差异(图1).
siRNA-DDC转染BGC823细胞5 d后, 与阴性对照组相比, DDC蛋白表达明显下调, 其表达的相对值由1.26±0.19降至0.39±0.12(P<0.05), 而未转染组和阴性对照组间并无明显差异(图2).
细胞体外侵袭实验显示, 3组细胞均能穿过附有Matrigel胶的滤膜, 未转染组、阴性对照组和实验组的穿膜细胞数分别为23.72±3.24, 22.38±3.84和6.48±3.62. 实验组细胞数明显低于未转染组和阴性对照组(P<0.05), 而未转染组和阴性对照组之间细胞数目无明显差异, 提示抑制DDC基因表达能显著降低胃癌细胞的侵袭能力(图3).
胃癌在世界恶性肿瘤中居第2位, 在我国居恶性肿瘤之首, 其侵袭转移是导致患者死亡的最主要原因. DDC是一种将多巴(dopa)代谢为多巴胺(dopamine)的酶类, 在神经递质多巴胺和5-羟色胺的合成中起关键作用, 另外他还与血管生成、凋亡、细胞增殖有关[2-3]. 以往的研究表明多巴脱羧酶在神经母细胞瘤[4]和小细胞肺癌[5]中高表达, 而DDC在胃癌中的表达情况罕有报道. Sakakura et al[6]通过cDNA芯片筛选发现DDC与胃癌腹膜转移相关, 又通过实时PCR方法检测112例胃癌腹腔冲洗液, 结果显示DDC预测腹膜微转移敏感性为87%, 特异性为98%. 作者在前期实验中用RT-PCR方法对92例胃癌患者的腹腔冲洗液进行mRNA表达的检测, 发现DDC基因在62%的病例检测出表达, 可能是一个良好的胃癌转移标志物.
RNAi技术是Fire et al[7]发现的一种基因沉默技术, 他具有特异性、高效性、快速性的特点[7-8]. RNAi最直接的应用就是利用其特异性降解靶mRNA, 从而进行基因表达缺失下的功能研究, 为研究肿瘤复杂的基因功能变化提供了有力的研究工具[9]. 我们以DDC基因作为靶分子, 在体外合成特异性抑制其表达的siRNA, 转染人胃癌细胞系BGC823, 检测转染后胃癌细胞DDC基因的表达情况, 并通过体外侵袭实验观察转染后胃癌细胞侵袭能力的变化. 我们看到, 化学合成的siRNA-DDC转染胃癌BGC823细胞后, RT-PCR显示DDC基因表达下调, 而在未转染组和阴性对照组并未发现DDC基因表达抑制现象; 蛋白印迹检测转染后的细胞, 显示DDC蛋白表达下调, 而在未转染组和阴性对照组并未发现DDC蛋白表达抑制现象. 这些结果说明siRNA可以抑制胃癌细胞BGC823中DDC基因的表达. 细胞体外侵袭实验显示, 3组细胞均能穿过附有Matrigel胶的滤膜, 但实验组穿膜细胞数明显低于未转染组和阴性对照组, 而未转染组和阴性对照组之间的穿膜细胞数目无明显差异, 提示DDC基因表达下调能显著降低胃癌细胞的侵袭能力.
本研究表明, DDC的低表达可以抑制胃癌细胞的侵袭转移. 目前认为DDC基因主要通过神经递质及神经激素的合成来发挥其作用[10-12], 但其在胃癌侵袭转移过程中的具体功能仍不清楚. 相信随着今后研究的进展, 会为胃癌侵袭转移的治疗提供新的靶点.
胃癌的转移是胃癌患者术后死亡的重要原因之一, 阐明胃癌转移的分子机制并发现新的防治靶点具有重要的理论和实践意义.RNA干扰(RNAi)技术能针对目的基因表达进行高效、特异的阻断, 因其简便、快速、经济, 目前已成为探寻肿瘤相关基因领域的一个重要方法.
RNAi最直接的应用就是利用其特异性降解靶mRNA的特点, 从而进行基因表达缺失的功能研究. 多巴脱羧酶(DDC)作为一种神经内分泌肿瘤的特异性标志物, 多与神经母细胞瘤、小细胞肺癌以及前列腺癌等的发生发展有关, 近来有研究发现其与胃癌的侵袭转移有关, 但其中的具体机制尚不明了.
本研究发现体外合成的siRNA-DDC可以有效抑制胃癌细胞BGC823中DDC在mRNA和蛋白质水平上的表达, 为进一步研究DDC在胃癌发生发展过程中的作用奠定了基础.
本研究发现通过体外合成的siRNA-DDC抑制胃癌细胞BGC823中DDC在mRNA和蛋白水平上的表达, 可以降低胃癌细胞侵袭转移的能力, 这为今后胃癌侵袭转移的治疗提供新的靶点.
多巴脱羧酶(dopadecarboxylase, DDC)基因位于染色体7q11, 是一种将多巴(DOPA)代谢为多巴胺(dopamine)的酶类, 在神经递质多巴胺和5-羟色胺的合成中起关键作用, 还与血管生成、凋亡、细胞增殖有关. 以往的研究表明多巴脱羧酶作为一种神经内分泌肿瘤的特异性标志物, 多与神经母细胞瘤、小细胞肺癌以及前列腺癌等的发生发展有关, 而在胃癌中的表达情况罕有报道.
本文研究多巴脱羟酶小干扰RNA对胃癌细胞侵袭能力的影响, 立题新颖, 所采用的技术先进, 方法得当, 得出的结果可信, 为胃癌的治疗提供理论基础和指导意义.
编辑: 潘伯荣 电编:何基才
| 2. | Gazdar AF, Helman LJ, Israel MA, Russell EK, Linnoila RI, Mulshine JL, Schuller HM, Park JG. Expression of neuroendocrine cell markers L-dopa decarboxylase, chromogranin A, and dense core granules in human tumors of endocrine and nonendocrine origin. Cancer Res. 1988;48:4078-4082. [PubMed] |
| 3. | Linnoila RI, Mulshine JL, Steinberg SM, Funa K, Matthews MJ, Cotelingam JD, Gazdar AF. Neuroendocrine differentiation in endocrine and nonendocrine lung carcinomas. Am J Clin Pathol. 1988;90:641-652. [PubMed] |
| 4. | Jensen SM, Gazdar AF, Cuttitta F, Russell EK, Linnoila RI. A comparison of synaptophysin, chromogranin, and L-dopa decarboxylase as markers for neuroendocrine differentiation in lung cancer cell lines. Cancer Res. 1990;50:6068-6074. [PubMed] |
| 5. | Gilbert J, Haber M, Bordow SB, Marshall GM, Norris MD. Use of tumor-specific gene expression for the differential diagnosis of neuroblastoma from other pediatric small round-cell malignancies. Am J Pathol. 1999;155:17-21. [PubMed] |
| 6. | Sakakura C, Takemura M, Hagiwara A, Shimomura K, Miyagawa K, Nakashima S, Yoshikawa T, Takagi T, Kin S, Nakase Y. Overexpression of dopa decarboxylase in peritoneal dissemination of gastric cancer and its potential as a novel marker for the detection of peritoneal micrometastases with real-time RT-PCR. Br J Cancer. 2004;90:665-671. [PubMed] |
| 7. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] |
| 8. | Yang D, Lu H, Erickson JW. Evidence that processed small dsRNAs may mediate sequence-specific mRNA degradation during RNAi in Drosophila embryos. Curr Biol. 2000;10:1191-1200. [PubMed] |
| 9. | Xue Y, Bi F, Zhang X, Pan Y, Liu N, Zheng Y, Fan D. Inhibition of endothelial cell proliferation by targeting Rac1 GTPase with small interference RNA in tumor cells. Biochem Biophys Res Commun. 2004;320:1309-1315. [PubMed] |
| 10. | Berry MD, Juorio AV, Li XM, Boulton AA. Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochem Res. 1996;21:1075-1087. [PubMed] |
| 11. | Medina MA, Quesada AR, Nunez de Castro I, Sanchez-Jimenez F. Histamine, polyamines, and cancer. Biochem Pharmacol. 1999;57:1341-1344. [PubMed] |
| 12. | Uccella S, Cerutti R, Vigetti D, Furlan D, Oldrini R, Carnevali I, Pelosi G, La Rosa S, Passi A, Capella C. Histidine decarboxylase, DOPA decarboxylase, and vesicular monoamine transporter 2 expression in neuroendocrine tumors: immunohistochemical study and gene expression analysis. J Histochem Cytochem. 2006;54:863-875. [PubMed] |