修回日期: 2007-05-01
接受日期: 2007-05-22
在线出版日期: 2007-06-28
目的: 建立人胃癌顺铂耐药细胞系.
方法: 采用逐步递增顺铂浓度, 间歇作用体外诱导法建立人胃癌顺铂耐药细胞系SGC7901/DDP, 每月作相关检测; MTT法测定药物敏感性; 光镜、电镜、MTT法计数活细胞、流式细胞仪等方法观察其生物学特征的改变.
结果: 历时4 mo建成人胃癌顺铂耐药细胞系SGC7901/DDP, 1, 2, 3, 4 mo的耐药指数分别为2.13, 5.32, 12.60, 12.93, 并且与5-氟尿嘧啶、丝裂霉素等多种抗癌药有不同程度的交叉耐药性; SGC7901/DDP的细胞形态逐渐发生改变; 体外群体倍增时间较亲代细胞逐渐延长; 细胞周期分析发现其S期与G2/M期细胞逐渐减少, G0/G1期细胞逐渐增多.
结论: SGC7901/DDP细胞具有耐药表型特征, 耐药性能稳定, 增殖能力逐渐下降.
引文著录: 潘洪明, 费洪新, 杜静平, 陈正华, 张涛. 人胃癌顺铂耐药细胞系的建立过程. 世界华人消化杂志 2007; 15(18): 2009-2013
Revised: May 1, 2007
Accepted: May 22, 2007
Published online: June 28, 2007
AIM: To establish a cisplatin-induced human gastric cancer drug-resistant cell line and study changes in its resistance.
METHODS: A resistant gastric cancer cell line (SGC7901/DDP) was established by gradually increasing the dose of cisplatin with intermittent, monthly administration. Drug sensitivity was detected by MTT assay. Changes in biological characteristics were determined using light microscopy, electron microscopy, cell counting by MTT assay, and flow cytometry.
RESULTS: The SGC7901/DDP cell line was developed after 4 mo, with stable resistance to cisplatin. The resistance index for each month was 2.13, 5.32, 12.60 and 12.93, respectively. SGC7901/DDP cells exhibited cross-resistance to many other chemotherapeutic agents (e.g., 5-fuorouracil and mitomycin C). The morphology of SGC7901/DDP cells gradually changed; doubling time was gradually prolonged, and the cell numbers in S- and G2/M-phases gradually decreased, while that in G0/G1 phase gradually increased, compared with parent cells.
CONCLUSION: The SGC7901/DDP cell line showed a typical and stable resistant phenotype, multiplication of the SGC7901/DDP cell line gradually decreased, and MTT assay and electron microscopy determined the resistance of the SGC7901/DDP cell line.
- Citation: Pan HM, Fei HX, Du JP, Chen ZH, Zhang T. Construction of a cisplatin-induced human gastric cancer drug-resistant cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(18): 2009-2013
- URL: https://www.wjgnet.com/1009-3079/full/v15/i18/2009.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i18.2009
顺铂(cisplatin, DDP)抗瘤谱广, 对睾丸肿瘤、卵巢癌、肺癌、鼻咽癌、淋巴瘤、膀胱癌等有效, 是周期非特异性药物, 目前临床大量使用. 但是由于耐药性的产生使其不能发挥应有的治疗作用, 导致化疗的失败. 肿瘤细胞发生耐药的机制是十分复杂的, 在体外建立多药耐药细胞系是研究肿瘤产生多药耐药性(multidrug resistance, MDR)[1-2]的重要手段. 鉴于目前国内外尚缺乏人胃癌SGC7901耐DDP的细胞模型. 我们采用逐步递增DDP的浓度、间歇作用体外诱导法, 建立了人胃癌SGC7901顺铂耐药细胞系, 研究耐药过程中的变化, 为深入研究人胃癌SGC7901顺铂耐药的机制和筛选耐药逆转剂提供理想的模型.
DDP山东齐鲁制药厂生产; 5-氟尿嘧啶(5-FU)上海旭东海普药业有限公司; 长春新碱(VCR)上海华联药业有限公司生产; 丝裂霉素(MMC)日本Kyowa Hakko公司生产; 阿霉素(ADM)澳大利亚F. H. Faulding公司生产; RPMI1640由Gibco/BRL公司提供; MTT试剂盒购自上海华舜生物工程有限公司. SGC7901为人胃癌细胞系, 亚盛集团博士后科研(北京)工作站提供. 细胞培养在经过0.22 µm滤膜过滤的RPMI1640培养液中(含100 mL/L热灭活胎牛血清, 2 g/L NaHCO3, 青霉素100 U/mL和链霉素100 mg/L), 在37℃, 50 mL/L的CO2, 饱和湿度下培养, 用PBS配制的1.5 g/L的胰蛋白酶(含有0.2 g/L的EDTA)消化细胞传代.
采用逐步递增DDP浓度间歇作用的方法诱导细胞耐药. 取对数生长期的细胞SGC7901细胞接种于含有RPMI1640培养液中, 从低浓度0.06 mg/L作用48 h后弃去含药的培养液, 加入新鲜的培养液, 继续培养, 待其恢复正常生长, 消化传代后继续用0.06 mg/L的药物浓度处理48 h, 如此反复换液、传代逐步提高DDP浓度间歇诱导细胞, 最终获得一株能耐受0.6 mg/L的细胞系, 命名为SGC7901/DDP, 并且将其培养在含有DDP 0.1 mg/L的完全培养液中.
1.2.1 细胞生长曲线: 将5×107个/L细胞接种于8块96孔培养板中, 每孔200 µL, 一种细胞设3个复孔, 37℃, 50 mL/L的CO2孵箱内培养. 每天取1块培养板, 弃培养液, 加入无血清培养液180 µL, 每孔加入5 g/L MTT 20 µL, 继续培养4 h, 终止培养, 弃培养液, 加入二甲基亚砜150 µL, 振荡5 min, 用自动酶标仪(Bio-Bad E2550型, USA)测定570 nm光密度. 以空白对照孔调零, 时间为横坐标, 光密度为纵坐标, 绘制细胞生长曲线, 求出群体倍增时间, 分析生长曲线.
1.2.2 MTT法测定抗癌药物的细胞毒性: 在96孔培养板内每孔加入5×107个/L单细胞悬液200 µL, 并且加入倍比稀释成5种浓度的各种抗癌药物各20 µL, 每一种浓度重复3个孔, 对照组加入等体积的PBS, 并且设立空白对照组, 放置于37℃, 50 mL/L CO2孵箱中培养68 h后吸去上清液, 每孔中加入无血清的培养液180 µL及5 g/L MTT 20 µL, 继续培养 4 h后小心吸去上清液, 每孔加入二甲基亚砜150 µL, 置于微量振荡器上振荡5 min, 自动酶标仪(Bio-Bad E2550型, USA)测量各孔的吸光度A值, 检测波长为570 nm[3]. 按抑制率 = (1-A用药组/A细胞对照组)×100%计算每一种浓度的抑制率, 并根据中效方程式[4]计算出各种抗癌药物的半数抑制浓度(IC50)及其耐药指数(resistance index, RI), RI = IC50(耐药细胞)/IC50 (亲本细胞).
1.2.3 细胞形态和周期: 将5×107个/L单细胞悬液接种于内铺小玻片的24孔培养板内, 置于37℃, 50 mL/L CO2孵箱内培养72 h后用PBS洗涤2次, 瑞氏染液染色10 min, 在用PBS洗涤2次, 室温干燥, 中性树胶封片, 光镜下观察. 用含有胰蛋白酶和EDTA的消化液处理细胞, 收集1×107个细胞, 用25 g/L的戊二醛固定, 继续用20 g/L的四氧化锇固定, 脱水、包埋、切片和染色按常规处理, 透射电镜(HITACHI-600型, 日本)观察. 再收集1×109个/L细胞, PBS洗涤2次, 700 mL/L冷乙醇固定过夜, PBS洗涤2次, PI染液冰浴30 min, 在流式细胞仪上(FACS Calibur BD, USA)分析细胞周期分布.
统计学处理 实验数据用SAS统计软件处理, 采用χ2检验进行分析.
SGC7901/DDP细胞对DDP的1, 2, 3, 4 mo耐药指数分别是2.1, 5.3, 12.6, 12.9, 并且对另外4种临床常用的抗癌药物也有不同程度的耐药(表1).
| t | 细胞 | DDP | 5-FU | MMC | VCR | ADM |
| 0 mo IC50(g/L) | SGC7901 | 0.244 | 0.432 | 0.149 | 0.196 | 0.102 |
| SGC7901/DDP | 0.279 | 0.421 | 0.157 | 0.210 | 0.096 | |
| RI | 1.1 | 1.0 | 1.0 | 1.0 | 0.9 | |
| 1 mo IC50(g/L) | SGC7901 | 0.265 | 0.551 | 0.163 | 0.091 | 0.213 |
| SGC7901/DDP | 0.564 | 0.954 | 0.213 | 0.098 | 0.256 | |
| RI | 2.1 | 1.7 | 1.3 | 1.1 | 1.2 | |
| 2 mo IC50(gL) | SGC7901 | 0.255 | 0.562 | 0.143 | 0.101 | 0.250 |
| SGC7901/DDP | 1.356 | 1.151 | 0.421 | 0.133 | 0.621 | |
| RI | 5.3 | 2.0 | 2.9 | 1.3 | 2.5 | |
| 3 mo IC50(g/L) | SGC7901 | 0.199 | 0.466 | 0.244 | 0.221 | 0.332 |
| SGC7901/DDP | 2.521 | 1.596 | 0.658 | 0.253 | 0.724 | |
| RI | 12.6 | 3.4 | 2.7 | 1.1 | 2.2 | |
| 4 mo IC50(g/L) | SGC7901 | 0.231 | 0.324 | 0.196 | 0.354 | 0.168 |
| SGC7901/DDP | 2.986 | 1.624 | 0.965 | 0.413 | 0.814 | |
| RI | 12.9 | 5.0 | 4.9 | 1.2 | 4.8 |
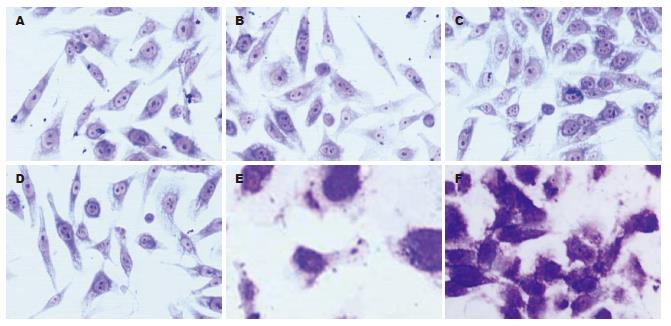
光镜下SGC7901细胞与SGC7901/DDP细胞均呈单层排列, 细胞大小不一, 为多角形; SGC7901细胞边界清楚, 核大, 圆形或椭圆形; SGC7901/DDP细胞随着药物剂量的逐渐加大, 时间逐渐延长, 与加药4 mo出现边界不清, 体积略增大, 核不规则, 出现巨细胞(图1). 透射电镜下, 顺铂加入药物1 mo后SGC7901与SGC7901/DDP细胞微绒毛依然丰富, 顺铂加入药物2 mo后SGC7901与SGC7901/DDP线粒体数目没有差别, 顺铂加入3 mo后SGC7901与SGC7901/DDP糖原减少, 顺铂加入药物4 mo后SGC7901与SGC7901/DDP线粒体数目减少, 可见到假性包涵体.
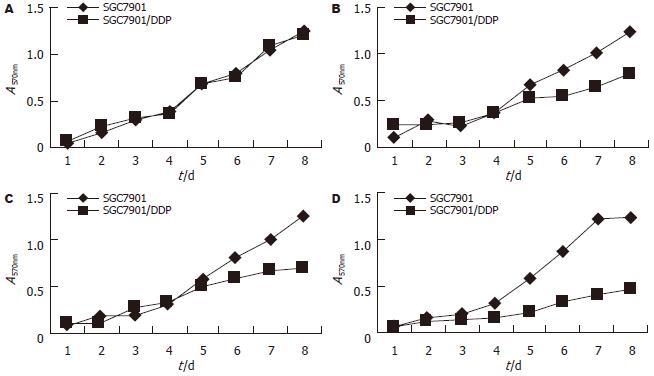
SGC7901细胞与SGC7901/DDP细胞的增殖速度不同, 两者的群体倍增时间1 mo为57.36和53.76 h; 2 mo为44.88和56.16 h; 3 mo为47.04和68.88 h; 4 mo为54.48和77.52 h; 耐药细胞较亲代细胞在相同的时间条件下分别延长了3.36, 11.28, 21.84和23.04 h, 可以发现细胞的群体倍增时间是逐渐延长的(图2).
肿瘤细胞产生耐药的机制是很多的. 在体外建立理想的细胞系仍是研究肿瘤耐药产生的生物学和细胞生物学变化的前提和基础. 目前国内外建立肿瘤MDR细胞系的方法通常是药物浓度递增持续法[5](stepwise continuous selection)和大剂量间歇诱导法[2](high dose intermittent selection). 研究表明, MDR产生是与癌细胞表面过剩表达一种P糖蛋白(P-glycoprotein, P-gp)有关[8], P-gp, Mr 1.7×105[6]. 他具有将抗癌药泵出细胞, 使细胞内药物浓度降低的功能. 最近发现多药耐药基因相关蛋白(multidrug resistance-associated protein, MRP)[7]与非P-gp介导的MDR 有关[8]. 引起耐药机制可能是P-gp和MRP的作用底物不同所造成. DDP的转运主要由MRP完成[9]. 尽管MRP基因的过度表达在胃癌的多药耐药机制中起非常重要的作用, 但不能解释全部多药耐药现象. 我们采用逐步递增顺铂浓度, 间歇作用体外诱导法, 历时4 mo建成人胃癌顺铂耐药细胞系SGC7901/DDP. 光镜下观察SGC7901/DDP细胞与其亲本SGC7901细胞存在差异, 体积略增大, 并且伴有巨细胞的形成, 巨细胞的出现表明细胞受到损伤和细胞分裂减少. 在肿瘤的超微结构中, 可以见到细胞核大畸形, 假性包涵体, 细胞表面微绒毛减少, 表明细胞代谢、分裂活动减弱. 通过绘制细胞生长曲线测定[10]群体倍增时间发现, 1, 2, 3, 4 mo耐药细胞较亲代细胞延长分别为3.36, 11.28, 21.84, 23.04 h. 关于肿瘤倍增时间与化疗疗效的关系, 目前认为肿瘤的倍增时间越短, 对化疗越敏感, 疗效越好; 反之, 肿瘤的倍增时间越长, 对化疗的敏感性就下降了. 此研究中SGC7901/DDP细胞的倍增时间延长, 则对化疗的敏感性下降, 治疗耐药胃癌就很棘手. 另外FCM显示SGC7901/DDP细胞周期发现G0/G1期细胞增多, S期和G2/M期减少(P<0.01), 也证实SGC7901/DDP细胞增殖速度减慢.
体外建立的耐药细胞对DDP的相对耐受度较亲代细胞1, 2, 3, 4 mo分别提高的指数是2.13, 5.32, 12.60, 12.93. 表明SGC7901细胞耐药的产生是逐渐发生的, 一般是持续作用3 mo就已经使细胞耐药了, 但是为了使细胞的耐药性能稳定下来, 就应该在持续1 mo加入较大的剂量的药物, 使细胞总是处于一个较大的剂量的药物环境中, 耐药性能方可以稳定下来. SGC7901/DDP细胞脱离DDP作用后2 mo后其对DDP的耐药指数有所下降, 但是仍然保持在65%以上, 表现出较为稳定的耐药性, SGC7901/DDP细胞冻存后复苏后仍然可以稳定生长、增殖. 同时该细胞系不仅对DDP产生耐药, 而且对从未接触的5-FU, MMC, VCR, ADM等多种抗癌药物也产生了耐药性, Snow et al[11]认为耐药指数小于5是低度耐药, 耐药指数5-15是中度耐药, 耐药指数大于15是高度耐药. 按照此标准, SGC7901/DDP细胞DDP, MMC, 5-FU, ADM属于中度耐药, 对VCR属于低度耐药, 说明SGC7901/DDP细胞系耐药性能稳定, 是研究DDP的耐药机制以及为筛选逆转剂建立理想的耐药细胞模型.
总之, 实验中细胞生长曲线、MTT药物敏感性实验、电镜、细胞周期等检测方法是逐渐改变的, 其中MTT药物敏感性实验和电镜与其他的检测相比可以较早地反映出细胞耐药的特征, 但由于电镜成本较高, 建立耐药细胞系的过程中MTT药物敏感性实验仍然是首选的检测方法.
肿瘤细胞的耐药机制十分复杂, 肿瘤多药耐药现象是肿瘤化疗研究的热点. 在体外建立多药耐药细胞系是研究肿瘤产生多药耐药性的重要手段.
多药耐药性:指肿瘤细胞对某种抗肿瘤药物出现耐药性的同时, 对其他多种结构不同、作用靶位点不同的抗肿瘤药物也有耐药性. P-糖蛋白:是一种能量依赖性转移泵, 这种跨膜糖蛋白由mdr1基因编码, 翻译为1280个氨基酸残基, 氨基端与羧基端两段氨基酸序列对称, 同源性达78%, 每一部分各有6个α-螺旋横跨细胞膜和一个胞内ATP结合点, 分子量为170 kDa.
本实验研究发现化疗药物(顺铂)的耐药特征, 对于指导临床用药、发现耐药菌株有一定的临床意义.
编辑: 程剑侠 电编:张敏
| 1. | Hong L, Zhao Y, Wang J, Han Y, Guo W, Jin H, Zhai H, Bai F, Zhang X, Qiao T. Reversal of Multidrug Resistance of Adriamycin-resistant Gastric Adenocarcinoma Cells Through the Up-regulation of DARPP-32. Dig Dis Sci. 2007;. [PubMed] |
| 2. | Kwak MK, Lee HJ, Hur K, Park DJ, Lee HS, Kim WH, Lee KU, Choe KJ, Guilford P, Yang HK. Expression of Kruppel-like factor 5 in human gastric carcinomas. J Cancer Res Clin Oncol. 2007;. [PubMed] |
| 3. | Jie Liang, Yanglin Pan, Dexin Zhang, Changcun Guo, Yongquan Shi, Jingbo Wang, Yu Chen, Xin Wang, Jie Liu, Xuegang Guo, Zheng Chen, Taidong Qiao, Daiming Fan. Cellular prion protein promotes proliferation and G1/S transition of human gastric cancer cells SGC7901 and AGS. The FASEB Journal. 2007;21:2247-2256. |
| 4. | 韩 锐. 肿瘤化学预防及药物治疗. 北京: 北京医科大学、中国协和医科大学联合出版社 1991; 315-320. |
| 5. | Giovanni Carlo Cesana, Fabrizio Romano, Gaia Piacentini, Marco Scotti, Ambrogio Brenna, Giorgio Bovo, Massimo Vaghi, Giacomo Aletti, Roberto Caprotti, Howard Kaufman, Franco Uggeri. Low-dose Interleukin-2 Administered Pre-operatively to Patients with Gastric Cancer Activates Peripheral and Peritumoral Lymphocytes But Does Not Affect Prognosis. Annals of Surgical Oncology. 2007;14:1295-1304. |
| 6. | Gouaze V, Yu JY, Bleicher RJ, Han TY, Liu YY, Wang H, Gottesman MM, Bitterman A, Giuliano AE, Cabot MC. Overexpression of glucosylceramide synthase and P-glycoprotein in cancer cells selected for resistance to natural product chemotherapy. Mol Cancer Ther. 2004;3:633-639. [PubMed] |
| 7. | Hao Z, Li X, Qiao T, Du R, Hong L, Fan D. CIAPIN1 confers multidrug resistance by upregulating the expression of MDR-1 and MRP-1 in gastric cancer cells. Cancer Biol Ther. 2006;5:261-266. [PubMed] |
| 8. | Xia S, Yu SY, Yuan XL, Xu SP. Effects of hypoxia on expression of P-glycoprotein and multidrug resis-tance protein in human lung adenocarcinoma A549 cell line. Zhonghua Yi Xue Za Zhi. 2004;84:663-666. [PubMed] |
| 9. | Chung YM, Yoo YD, Park JK, Kim YT, Kim HJ. Increased expression of peroxiredoxin II confers resistance to cisplatin. Anticancer Res. 2001;21:1129-1133. [PubMed] |
| 10. | Han Y, Bu LM, Ji X, Liu CY, Wang ZH. Modulation of multidrug resistance by andrographolid in a HCT-8/5-FU multidrug-resistant colorectal cancer cell line. Chin J Dig Dis. 2005;6:82-86. [PubMed] |
| 11. | Snow K, Judd W. Characterisation of adriamycin- and amsacrine-resistant human leukaemic T cell lines. Br J Cancer. 1991;63:17-28. [PubMed] |