修回日期: 2007-03-01
接受日期: 2007-03-01
在线出版日期: 2007-06-18
目的: 建立结肠癌细胞耐药模型LoVo/5-FU并初步筛选可能的耐药相关基因.
方法: 采用5-FU浓度递增法建立人结肠癌细胞耐药模型LoVo/5-FU, 观察其生长规律并绘制细胞生长曲线; 用MTT法鉴定耐药细胞株耐药性并计算耐药指数(RI); 用基因芯片技术检测耐药细胞株LoVo/5-FU与其亲本细胞株LoVo中的差异表达基因, 从中筛选出可能的耐药相关基因; 用半定量RT-PCR方法对筛选出的部分耐药相关基因在耐药细胞及其亲本细胞中的表达情况进行验证.
结果: LoVo/5-FU细胞与LoVo细胞相比, 生长缓慢, 细胞体积增大. LoVo/5-FU对5-FU、ADM、MMC耐药, 而对CDDP无耐药性(RI: 7.69, 2.78, 1.43和0.96). 通过基因芯片筛选出差异表达基因425个, 可能的耐药相关基因包括CYP1B1, NAT2, RNF20, SNAI2, MAP3K2, 其中CYP1B1在LoVo/5-FU与LoVo中的表达有明显差异(Cy5/Cy3 = 5.877).
结论: LoVo/5-FU细胞株耐药性稳定, 耐药机制可能与CYP1B1, NAT2等耐药相关基因有关.
引文著录: 盛雅萍, 李建芳, 刘炳亚, 罗建明, 郑磊贞, 陈强, 郭伟剑. 结肠癌耐药细胞株LoVo/5-FU的建立及其差异表达基因的筛选. 世界华人消化杂志 2007; 15(17): 1899-1904
Revised: March 1, 2007
Accepted: March 1, 2007
Published online: June 18, 2007
AIM: To establish a Lovo/5-FU of human drug-resistance colon carcinoma cell line, and to screen possible drug resistance-associated genes.
METHODS: LoVo/5-FU of a human drug-resistance colon carcinoma cell line was induced by continuously exposing human colon carcinoma cells to gradually increasing concentrations of 5-FU. The growth law was observed and the growth curve protracted. The drug resistance of LoVo/5-FU was measured by MTT assay and the drug resistant index (RI) was calculated. Genes expressing differently between LoVo/5-FU and its parent cell line Lovo were screened using a gene chip, and several selected associated drug resistance genes were confirmed by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Compared with parental cells, the resistance cell line had a slower growth rate and larger morphology. The LoVo/5-FU cell line showed drug resistance to 5-FU, adriamycin (ADM), mitomycin (MMC), but not to cisplatin (CDDP) (RI: 7.69, 2.78, 1.43, and 0.96). There were 425 differently expressed genes associated with drug resistance by the gene chip screening method. The possible drug resistance-related genes included CYP1B1, NAT2, RNF20, SNAI2, and MAP3K2. The expression of CYP1B1 had a significant difference between the LoVo/5-FU cell line and the parent cell line (Cy5/Cy3 = 5.877). RT-PCR results were consistent with the gene chip results.
CONCLUSION: The altered biological properties of LoVo/5-FU may be related to its drug resistance phenotype. Several genes, such as CYP1B1, are possibly involved in the mechanism of drug resistance.
- Citation: Sheng YP, Li JF, Liu BY, Luo JM, Zheng LZ, Chen Q, Guo WJ. Establishment and selection of genes expressing differently in a human colon carcinoma LoVo/5-FU cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(17): 1899-1904
- URL: https://www.wjgnet.com/1009-3079/full/v15/i17/1899.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i17.1899
大肠癌是消化系统常见的肿瘤, 其治疗主要是手术, 化疗则可减少复发和提高生存率. 但以5-氟尿嘧啶(5-FU)为主的化疗疗效仍不能令人满意, 其主要原因是化疗过程中出现肿瘤细胞耐药. 因此, 肿瘤耐药基因的研究可能在将来为选择决定化疗方案提供参考依据. 而基因芯片技术在肿瘤耐药研究中的应用对肿瘤耐药机制研究, 新的耐药基因发现及耐药个体化诊断具极大促进作用. 我们用5-FU对LoVo细胞进行长期诱导获得耐药模型LoVo/5-FU细胞株, 并对其生物学特性进行研究. 同时, 通过基因芯片检测筛选可能的耐药相关基因, 并对筛选出的基因进行RT-PCR验证.
RPMI1640(杭州吉诺生物医药技术有限公司); 小牛血清(杭州四季青生物公司); TRIzol溶液(Invitrogen公司); AMV逆转录酶, Rnase抑制剂, 逆转录试剂盒(A3500), Taq聚合酶, dNTP和PCR标志(Promega公司); 基因芯片(上海博星基因芯片有限公司); 引物由上海英骏生物公司合成; 噻唑蓝(MTT, Sigma公司); 氟尿嘧啶(5-FU), 丝裂霉素(MMC), 阿霉素(ADM), 顺铂(CDDP)均为国产药物.
1.2.1 细胞培养及耐药细胞系的建立: 结肠癌LoVo细胞在37℃, 50 mL/L CO2, 饱和湿度的培养箱中培养, 培养液为含100 mL/L热灭活小牛血清, 青霉素100 kU/L和链霉素100 mg/L的RPMI1640培养液. 采用药物(5-FU)持续接触浓度递增诱导法建立人结肠癌耐药细胞系LoVo/5-FU, 可在含5-FU浓度为5.0-6.0 mg/L的培养液中稳定生长.
1.2.2 生物学特性观察: 细胞一般形态学观察: 在Olympus光学显微镜下观察其形态. 生长曲线测定: 取对数生长期的LoVo和LoVo/5-FU细胞, 用2.5 g/L胰酶消化, RPMI1640培养液制成单细胞悬液, 接种到24孔板中(每孔5×103个, 各3复孔×7 d), 37℃, 50 mL/L CO2, 饱和湿度下培养, 每日消化3孔进行计数, 连续7 d, 绘制生长曲线.
1.2.3 药敏实验: 用MTT法检测LoVo和LoVo/5-FU细胞对5-FU, ADM, MMC, CDDP的敏感性. LoVo/5-FU细胞在不含5-FU的RPMI1640培养液中培养2 wk后备用. 取对数生长期的LoVo和LoVo/5-FU细胞, 用2.5 g/L胰酶消化, RPMI1640培养液制成单细胞悬液, 接种到96孔板(100 μL/孔, 5×103/孔), 培养24 h, 加入不同浓度的上述药物(设4复孔和阴性对照), 再培养72 h, 每孔加入MTT液20 μL培养4 h, 离心, 弃上清, 加入二甲亚砜100 μL/孔, 震荡摇匀, 紫色颗粒溶解后上Quant酶标仪测定吸光度, 波长570 nm, 以药物浓度为横轴, 细胞存活率为纵轴, 绘制浓度-效应曲线, 确定半数抑制浓度(IC50), 计算耐药指数(RI) = 耐药细胞IC50/亲本细胞IC50.
1.2.4 基因芯片检测: 取生长良好的LoVo和LoVo/5-FU细胞提取RNA后进行基因芯片检测, 检测由上海博星基因芯片公司代为进行(芯片型号: Biostar H-40S). 该芯片共有人类cDNA克隆4000多个, 包括OTS(原癌基因和抑癌基因), ARP-SRP(细胞凋亡和应激反应蛋白相关基因), CCCP(细胞周期蛋白相关基因), FMS(细胞骨架和运动蛋白相关基因), SRRP(DNA合成, 修复和重组蛋白相关基因), CR(细胞受体相关基因), ECSCP(细胞信号和传递蛋白相关基因), GC(发育相关基因)等. 判断基因差异表达的筛选标准: 耐药细胞组与亲本细胞组的检测结果比值>2.0(上调2倍)或<0.5(下调2倍). 如比值>5.0或<0.2认为基因表达差异有极显著性.
1.2.5 半定量RT-PCR: 采用TRIzol一步法提取LoVo和LoVo/5-FU细胞的RNA, 具体步骤见Invitrogen公司的操作法; 以1 μg总RNA进行逆转录合成cDNA, 操作步骤见AMV逆转录体系(A3500)的方法, 分别进行不同循环数的PCR循环, 以确定最佳扩增循环数(26-28个), 并进行温度梯度PCR, 以确定各对引物的最佳退火温度. PCR引物的设计采用Primer3软件, 经BLAST验证后由上海英骏生物公司合成, 序列如下: b-actin正义链5'ccactggcatcgtgatggac3', b-actin反义链5'gcggatgtccacgtcacact3'(产物427 bp); CYP1B1正义链5'caggcagaattggatcaggt3', CYP1B1反义链5'tcatcactctgctggtcagg3'(产物315 bp); NAT2正义链5'accattgacggcaggaatta3', NAT2反义链5'gatgaagcccaccaaacagt3'(产物377 bp); RNF20正义链5'gaactctttcctcgcacagg3', RNF20反义链5'ccgaagtttcttcagctcac3'(产物388 bp); SNAI2正义链5'ctttttcttgccctcactgc3', SNAI2反义链5'ttgaaatgatttggcagcaa3'(产物530 bp); MAP3K2正义链5'gaccagcttacggtctcctg3', MAP3K2反义链5'tccttgctggtctcaggact3'(产物320 bp). 以b-actin mRNA水平作为内参照, 每个PCR产物取10 mL在20 g/L琼脂糖凝胶上电泳, 用Alpha Innotech的凝胶成像系统(FluorChem IS-9900), Alpha Ease FC软件对电泳条带进行分析.
采用药物浓度递增法, 历经12 mo, 建立人结肠癌耐药细胞系LoVo/5-FU. 5-FU起始浓度为0.1 μg/L, 最终细胞能在含5-FU浓度为5.0-6.0 mg/L的培养液中稳定生长.
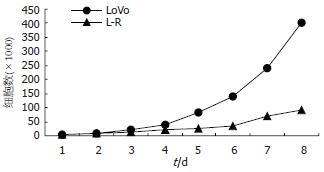
LoVo细胞呈短梭形; LoVo/5-FU细胞呈长梭形, 且体积大于LoVo细胞. LoVo/5-FU细胞的增殖速度较LoVo细胞显著减缓(图1).
耐药株不仅对5-FU耐药, 而且对ADM, MMC有交叉耐药, 但对CDDP无耐药性(表1).
| 耐药倍数(RI) = 耐药细胞IC50/亲本细胞IC50 | |
| 5-FU | 7.69 |
| ADM | 2.78 |
| MMC | 1.43 |
| CDDP | 0.96 |
有差异表达的基因共425个, 其中表达上调的共203个, 表达下调的共222个, 从中选取5个基因用于RT-PCR验证(表2).
| 基因序号 | 基因名称 | Cy5/Cy3* |
| 3855c02 | Homo sapiens cytochrome P450, family 1, subfamily B, polypeptide 1. (CYP1B1) | 5.877 |
| 3854a04 | Homo sapiens N-acetyltransferase 2 (arylamine N-acetyltransferase, NAT2) | 5.755 |
| 1256h07 | Homo sapiens ring finger protein 20 (RNF20) | 2.762 |
| 3599e01 | Homo sapiens snail homolog 2 (Drosophila) (SNAI2) | 2.272 |
| 1553a08 | Homo sapiens mitogen-activated protein kinase kinase kinase 2 (MAP3K2) | 2.126 |
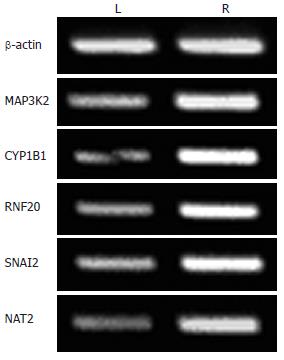
运用半定量RT-PCR方法分别检测LoVo和LoVo/5-FU细胞中CYP1B1, NAT2, RNF20, SNAI2, MAP3K2基因在转录水平的差异表达. 结果显示, 耐药细胞中CYP1B1 mRNA表达明显上调; NAT2, RNF20, SNAI2, MAP3K2 mRNA表达亦上调, 但不如前者明显(图2). CYP1B1, NAT2, RNF20, SNAI2, MAP3K2基因的RT-PCR验证结果基因表达差异情况与芯片筛查结果一致.
本实验建立了LoVo/5-FU耐药细胞株, 对5-FU的相对耐受度较亲代细胞提高了7.69倍, 与亲代细胞相比耐药细胞生长速度减慢, 细胞体积增大. 他是一种继发性耐药细胞株, 具有多药耐药特性, 对ADM, MMC等化疗药物存在交叉耐药现象.
肿瘤细胞与抗癌药物接触后, 不仅能对所用药物产生耐药性, 对结构和功能不同的其他药物也能产生耐药性, 而肿瘤细胞对化疗药物的耐药性是化疗失败的主要原因. 以往对5-FU耐药机制的研究主要涉及: 5-FU靶酶胸苷酸合成酶(TS)活性改变[1-2], 5-FU代谢限速酶二氢嘧啶脱氢酶(DPD)活性改变[3-4], 胸腺嘧啶核苷激酶(TK)活性改变[3], 叶酸代谢相关酶活性改变[5], DNA修复机制异常, 信号传导异常等. 在分子水平理解肿瘤耐药机制对制定化疗和耐药逆转方案, 提高治疗效果是非常重要的, 而基因芯片技术为分析基因组表达水平差异或变化提供了强有力的工具[6]. 本研究应用基因芯片技术对人结肠癌5-FU耐药细胞LoVo/5-FU及其亲本细胞LoVo进行筛查, 结果表明, 与亲本细胞LoVo相比, 耐药细胞LoVo/5-FU的CYP1B1, NAT2, RNF20, SNAI2, MAP3K2均上调>2.0倍. 对上述5种基因的RT-PCR验证结果与基因芯片的筛查结果一致, 其中CYP1B1基因的表达差异尤其明显. 基因芯片的筛查不仅有助于确定与肠癌耐药细胞耐药相关的特殊基因, 阐明与诊断及预后相关的分子标志, 而且对肿瘤药物的开发也将产生深远影响.
CYPIB1即cytochrome P450, subfamily1, polypeptide1, 属于混合功能单氧化酶这个多基因超家族的一员, 后者是药物代谢过程中最重要的酶. 关于CYP1B1与化疗药物耐药性的研究很多, 一些研究证实CYP家族可活化或失活化疗药物, 由此影响肿瘤对抗癌药物治疗的敏感性[7-9]. McFadyen et al[7]在对CYP1B1作为新的抗肿瘤药物耐受机制的研究中发现CYP1B1可降低细胞对某些抗肿瘤药物的敏感性. 一些P450酶,尤其是CYP1B1, 在肿瘤细胞中过表达可能代表新型的抗肿瘤靶点, 通过在肿瘤部位(即抗肿瘤药物作用部位)提供P450介导的代谢[10]. Rochat et al[11]通过研究认为CYP诱导活化可能与产生耐药有关, 通过加速抗癌药物的降解, 尤其是靶细胞中. 最近一项关于芳香化合物代谢的研究发现CYP1B1*1/*2基因型赋予细胞对苯并芘的DNA损伤效应的耐受性[12]. 至今CYP1B1与5-FU耐药的关系尚未见报道, 而本研究结果显示他与肠癌细胞的5-FU耐药高度相关.
NAT即N-acetyltransferase(N-乙酰转移酶), 包括3个基因: NAT1, NAT2, NATP(为假基因). 芳香胺N-乙酰转移酶是Ⅱ期异生化合物代谢酶, 促进乙酰辅酶A依赖的N-和O-乙酰化反应, 其中NAT2根据乙酰化活性分为快乙酰化(RA), 中速乙酰化(IA)和慢乙酰化(SA). 最近一项关于药物代谢基因突变相关化学敏感性的研究发现,那些具有慢乙酰化(即SA)的个体更容易有高度化学敏感性[13]. NAT2是许多化合物(包括潜在的致癌物质)代谢中的一个重要的酶, 他与耐药性的相关研究很少. Husain et al[14]提出人类NAT2基因多态性与药物毒性和/或不同组织的肿瘤发生有关. Bradshaw et al[15]用CJM126诱导出乳腺癌细胞耐药株MCF-7(10 nmol/L CJM126)及MCF-7(10 mmol/L CJM126), 分别对CJM126相应剂量耐受, 同时对结构、作用机制类似药物交叉耐受. 二者NAT1和NAT2蛋白均有表达, 尤其是NAT2高表达与MCF-7(10 nmol/L CJM126)细胞增强的乙酰化能力有关. 其他相关研究亦报道NAT2引起的乙酰化在药物反应中具一定影响[16-18].
RNF20是Bre1的同源物之一, 另一个为RNF40. Hwang et al[19]研究发现, S cerevisiae protein, Bre1, 作为一个进化上保守的环指蛋白, 是体内组蛋白H2B泛素化和H3在lys4上甲基化所必需的, 对突变的分析证实了其在控制细胞大小中的作用. Kim et al[20]证实了人类RNF20是核蛋白, 他提高了H2B在lys120泛素化的整体水平, 并加强了激活物依赖性的转录. Zhu et al[21]发现RNF20过表达导致H2B单泛素化增强, 随之引起H3lysines 4和79甲基化水平升高, 刺激HOX基因表达. 有关RNF20与耐药性的研究不多, Rao et al[22]曾报道RNF2与耐药有关, 不知是否指同一蛋白. Rao et al[22]在一项对RNF2与人类P-糖蛋白连接区相互作用的研究中发现RNF2调节细胞内P-糖蛋白数量, 通过其下游调节途径在肿瘤耐药形成中起重要作用.
SNAI2(SLUG)是Snail相关锌指蛋白转录因子, 对神经嵴起源细胞的正常发育很重要. Perez-Mancera et al[23]发现, SLUG过表达可能导致先心病和肿瘤(主要是间叶细胞肿瘤)的发生. 关于SLUG与耐药性的研究亦不多见, Catalano et al[24]在关于多药耐药恶性间皮瘤细胞中干细胞因子/c-Kit/slug信号传导的诱导的研究显示, 诱导SLUG在该耐药株的广谱耐药中起重要作用. 最近在对乳腺癌耐药细胞株中基因表达的研究发现, 在HER2阳性的乳腺癌trastuzumab耐药细胞株(JIMT-1)中有SLUG基因扩增[25].
MAP3K2, 即MAP/ERK kinase kinase 2; MEKK2. MEKK2属于mitogen-activated protein kinase (MAPK) kinase kinase基因家族, 与MAPK信号传导途径调节有关. 关于MAPK与耐药性的研究也很多, 认为其促进与抑制耐药形成的观点都有, 且曾有研究发现他与乳腺癌细胞的5-FU耐药有关. Hirose et al[26]研究发现, p38 MAPK途径促使DNA错配修复系统至G2检查点, 并导致DNA甲基化药物的耐药. Ding et al[27]对信号传导途径间相互关系与多药耐药蛋白MDR-1的研究表明ERK1/2 MAPK途径可能与耐药产生有关. Gutierrez et al[28]通过研究发现ER, HER-2, p38及ERK间的相互联系可能与乳腺癌对他莫昔芬耐受有关. Wu et al[29]在KT乳腺癌细胞的5-FU耐药株中发现MAPK活化增强. 另一项关于乳腺癌的研究发现持续的ERK激活与乳腺癌细胞株的获得性TRAIL耐受有关[30]. 而一项关于胰腺癌的研究也发现MAPK与胰腺癌细胞的化学耐受性有关[31]. Sun et al[32]亦通过研究发现DDB2过表达引起的p38信号传导减弱可能是获得性TNF-α耐受的原因之一. 与此相反, Villedieu et al[33]经研究发现顺铂治疗乳腺癌产生的耐药与ERK及p38 MAPK进行性活性丧失有关. 我们的研究结果则显示MAPK有促进耐药形成的作用. 由于信号传导途径中的蛋白激酶与肿瘤耐药相关, 这类蛋白激酶(包括p38 MAPK)的抑制剂作为靶向治疗的研究得到极大发展. 上述5种可能的耐药相关基因在耐药细胞LoVo/5-FU的具体耐药机制还有待于进一步研究.
大肠癌是消化系统常见的肿瘤, 其治疗主要是手术, 化疗则可减少复发和提高生存率. 但以5-氟尿嘧啶(5-FU)为主的化疗疗效仍不能令人满意, 其主要原因是化疗过程中出现肿瘤细胞耐药. 肿瘤细胞与抗癌药物接触后, 不仅能对所用药物产生耐药性, 对结构和功能不同的其他药物也能产生耐药性, 而肿瘤细胞对化疗药物的耐药性是化疗失败的主要原因. 因此, 肿瘤耐药基因的研究可能在将来为选择决定化疗方案提供参考依据.
基因芯片技术在肿瘤耐药研究中的应用对肿瘤耐药机制研究, 新的耐药基因发现及耐药个体化诊断具极大促进作用. 基因芯片的筛查不仅有助于确定与肠癌耐药细胞耐药相关的特殊基因, 阐明与诊断及预后相关的分子标志, 而且对肿瘤药物的开发也将产生深远影响.
本研究用5-FU对LoVo细胞进行长期诱导获得耐药模型LoVo/5-FU细胞株, 并对其生物学特性进行研究;同时, 通过基因芯片检测筛选可能的耐药相关基因, 并对筛选出的基因进行RT-PCR验证, 不仅有助于确定与肠癌耐药细胞耐药相关的特殊基因, 而且对逆转肿瘤耐药相关药物的寻找和开发也有一定的意义.
本文选择自己建立的结肠癌细胞耐药模型LoVo/5-FU为研究对象, 采用基因芯片技术筛选差异基因的表达, 做了较为详细的工作, 也取得了阶段性结果, 为后期机制的探讨奠定基础, 具有较高的学术价值.
编辑: 王晓瑜 电编:张敏
| 1. | Sharp L, Little J. Polymorphisms in genes involved in folate metabolism and colorectal neoplasia: a HuGE review. Am J Epidemiol. 2004;159:423-443. [PubMed] |
| 2. | Belvedere O, Puglisi F, Di Loreto C, Cataldi P, Guglielmi A, Aschele C, Sobrero A. Lack of correla-tion between immunohistochemical expression of E2F-1, thymidylate synthase expression and clinical response to 5-fluorouracil in advanced colorectal cancer. Ann Oncol. 2004;15:55-58. [PubMed] |
| 4. | Donnelly JG. Pharmacogenetics in cancer chemotherapy: balancing toxicity and response. Ther Drug Monit. 2004;26:231-235. [PubMed] |
| 5. | Sohn KJ, Smirnakis F, Moskovitz DN, Novakovic P, Yates Z, Lucock M, Croxford R, Kim YI. Effects of folylpolyglutamate synthetase modulation on chemosensitivity of colon cancer cells to 5-fluorouracil and methotrexate. Gut. 2004;53:1825-1831. [PubMed] |
| 7. | McFadyen MC, McLeod HL, Jackson FC, Melvin WT, Doehmer J, Murray GI. Cytochrome P450 CYP1B1 protein expression: a novel mechanism of anticancer drug resistance. Biochem Pharmacol. 2001;62:207-212. [PubMed] |
| 8. | Rochat B, Morsman JM, Murray GI, Figg WD, McLeod HL. Human CYP1B1 and anticancer agent metabolism: mechanism for tumor-specific drug inactivation? J Pharmacol Exp Ther. 2001;296:537-541. [PubMed] |
| 9. | Patterson LH, Murray GI. Tumour cytochrome P450 and drug activation. Curr Pharm Des. 2002;8:1335-1347. [PubMed] |
| 10. | McFadyen MC, Melvin WT, Murray GI. Cytochrome P450 enzymes: novel options for cancer therapeutics. Mol Cancer Ther. 2004;3:363-371. [PubMed] |
| 11. | Rochat B. Role of cytochrome P450 activity in the fate of anticancer agents and in drug resistance: focus on tamoxifen, paclitaxel and imatinib metabolism. Clin Pharmacokinet. 2005;44:349-366. [PubMed] |
| 12. | Garte S, Taioli E, Raimondi S, Paracchini V, Binkova B, Sram RJ, Kalina I, Popov TA, Singh R, Farmer PB. Effects of metabolic genotypes on intermediary biomarkers in subjects exposed to PAHS: results from the EXPAH study. Mutat Res. 2007;620:7-15. [PubMed] |
| 13. | Schnakenberg E, Fabig KR, Stanulla M, Strobl N, Lustig M, Fabig N, Schloot W. A cross-sectional study of self-reported chemical-related sensitivity is associated with gene variants of drug-metabolizing enzymes. Environ Health. 2007;6:6. [PubMed] |
| 14. | Husain A, Zhang X, Doll MA, States JC, Barker DF, Hein DW. Identification of N-acetyltransferase 2 (NAT2) transcription start sites and quantitation of NAT2-specific mRNA in human tissues. Drug Metab Dispos. 2007;35:721-727. [PubMed] |
| 15. | Bradshaw TD, Chua MS, Orr S, Matthews CS, Stevens MF. Mechanisms of acquired resistance to 2-(4-aminophenyl)benzothiazole (CJM 126, NSC 34445). Br J Cancer. 2000;83:270-277. [PubMed] |
| 16. | Weiner M, Burman W, Vernon A, Benator D, Peloquin CA, Khan A, Weis S, King B, Shah N, Hodge T. Low isoniazid concentrations and outcome of tuberculosis treatment with once-weekly isoniazid and rifapentine. Am J Respir Crit Care Med. 2003;167:1341-1347. [PubMed] |
| 17. | Huang YS, Chern HD, Su WJ, Wu JC, Lai SL, Yang SY, Chang FY, Lee SD. Polymorphism of the N-acetyltransferase 2 gene as a susceptibility risk factor for antituberculosis drug-induced hepatitis. Hepatology. 2002;35:883-889. [PubMed] |
| 18. | Tanigawara Y, Kita T, Aoyama N, Gobara M, Komada F, Sakai T, Kasuga M, Hatanaka H, Sakaeda T, Okumura K. N-acetyltransferase 2 genotype-related sulfapyridine acetylation and its adverse events. Biol Pharm Bull. 2002;25:1058-1062. [PubMed] |
| 19. | Hwang WW, Venkatasubrahmanyam S, Ianculescu AG, Tong A, Boone C, Madhani HD. A conserved RING finger protein required for histone H2B monoubiquitination and cell size control. Mol Cell. 2003;11:261-266. [PubMed] |
| 20. | Kim J, Hake SB, Roeder RG. The human homolog of yeast BRE1 functions as a transcriptional coactivator through direct activator interactions. Mol Cell. 2005;20:759-770. [PubMed] |
| 21. | Zhu B, Zheng Y, Pham AD, Mandal SS, Erdjument-Bromage H, Tempst P, Reinberg D. Monoubiquitination of human histone H2B: the factors involved and their roles in HOX gene regulation. Mol Cell. 2005;20:601-611. [PubMed] |
| 22. | Rao PS, Mallya KB, Srivenugopal KS, Balaji KC, Rao US. RNF2 interacts with the linker region of the human P-glycoprotein. Int J Oncol. 2006;29:1413-1419. [PubMed] |
| 23. | Perez-Mancera PA, Gonzalez-Herrero I, Maclean K, Turner AM, Yip MY, Sanchez-Martin M, Garcia JL, Robledo C, Flores T, Gutierrez-Adan A. SLUG (SNAI2) overexpression in embryonic development. Cytogenet Genome Res. 2006;114:24-29. [PubMed] |
| 24. | Catalano A, Rodilossi S, Rippo MR, Caprari P, Procopio A. Induction of stem cell factor/c-Kit/slug signal transduction in multidrug-resistant malignant mesothelioma cells. J Biol Chem. 2004;279:46706-46714. [PubMed] |
| 25. | Rennstam K, Jonsson G, Tanner M, Bendahl PO, Staaf J, Kapanen AI, Karhu R, Baldetorp B, Borg A, Isola J. Cytogenetic characterization and gene expression profiling of the trastuzumab-resistant breast cancer cell line JIMT-1. Cancer Genet Cytogenet. 2007;172:95-106. [PubMed] |
| 26. | Hirose Y, Katayama M, Stokoe D, Haas-Kogan DA, Berger MS, Pieper RO. The p38 mitogen-activated protein kinase pathway links the DNA mismatch repair system to the G2 checkpoint and to resistance to chemotherapeutic DNA-methylating agents. Mol Cell Biol. 2003;23:8306-8315. [PubMed] |
| 27. | Ding S, Chamberlain M, McLaren A, Goh L, Duncan I, Wolf CR. Cross-talk between signalling pathways and the multidrug resistant protein MDR-1. Br J Cancer. 2001;85:1175-1184. [PubMed] |
| 28. | Gutierrez MC, Detre S, Johnston S, Mohsin SK, Shou J, Allred DC, Schiff R, Osborne CK, Dowsett M. Molecular changes in tamoxifen-resistant breast cancer: relationship between estrogen receptor, HER-2, and p38 mitogen-activated protein kinase. J Clin Oncol. 2005;23:2469-2476. [PubMed] |
| 29. | Wu Y, Hiwasa T, Isogai E, Sonoda T, Kita K, Chen Z, Sugaya S, Yamamori H, Tanzawa H, Suzuki N. Activation of MAP kinases by 5-fluorouracil in a 5-fluorouracil-resistant variant human cell line derived from a KT breast cancer cell line. Int J Oncol. 1998;13:1241-1245. [PubMed] |
| 30. | Lee TJ, Lee JT, Park JW, Kwon TK. Acquired TRAIL resistance in human breast cancer cells are caused by the sustained cFLIP(L) and XIAP protein levels and ERK activation. Biochem Biophys Res Commun. 2006;351:1024-1030. [PubMed] |
| 31. | Zhao Y, Shen S, Guo J, Chen H, Greenblatt DY, Kleeff J, Liao Q, Chen G, Friess H, Leung PS. Mitogen-activated protein kinases and chemoresistance in pancreatic cancer cells. J Surg Res. 2006;136:325-335. [PubMed] |
| 32. | Sun CL, Chao CC. Potential attenuation of p38 signaling by DDB2 as a factor in acquired TNF resistance. Int J Cancer. 2005;115:383-387. [PubMed] |
| 33. | Villedieu M, Deslandes E, Duval M, Heron JF, Gauduchon P, Poulain L. Acquisition of chemoresistance following discontinuous exposures to cisplatin is associated in ovarian carcinoma cells with progressive alteration of FAK, ERK and p38 activation in response to treatment. Gynecol Oncol. 2006;101:507-519. [PubMed] |