修回日期: 2007-03-21
接受日期: 2007-03-31
在线出版日期: 2007-06-08
目的: 研究聚腺苷酸二磷酸核糖转移酶-1(PARP-1)抑制剂PJ34对人肝癌细胞株HepG2增殖的影响及其作用机制, 以及PJ34是否进一步增强γ射线对肝癌细胞的增殖抑制作用.
方法: 细胞增殖实验观察不同浓度的PJ34, 以及PJ34合并γ射线照射对HepG2细胞增殖的影响, 流式细胞仪检测PJ34对HepG2细胞凋亡的影响.
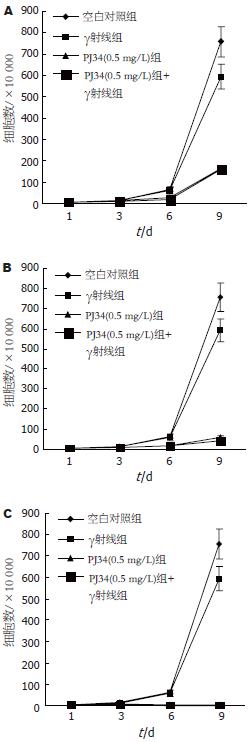
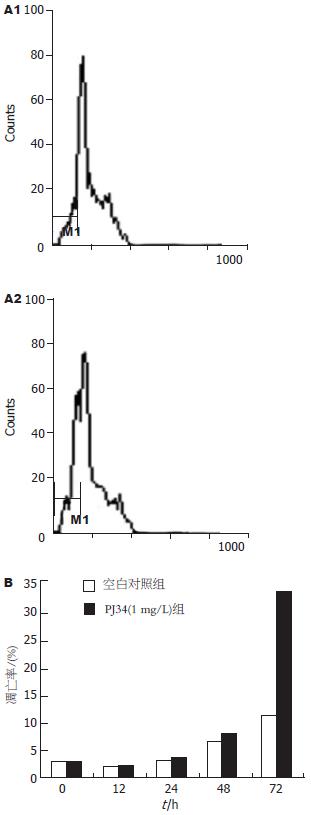
结果: PJ34对HepG2细胞的增殖有显著的抑制作用(t = 15.175, P<0.01). 随着PJ34浓度的增加, 其抑制作用进一步增强. 1Gy的γ射线照射对HepG2细胞的增殖有明显抑制作用, 但γ射线照射联合PJ34与单用PJ34或γ射线照射对肝癌细胞的增殖抑制作用相比较无明显统计学差异(t = -1.413, P>0.05). PJ34能诱导HepG2细胞凋亡, 72 h时凋亡率明显高于对照组, 二者有显著性差异(33.2% vs 11.4%, P<0.01).
结论: PARP-1抑制剂PJ34通过诱导HepG2细胞凋亡抑制人肝癌细胞的增殖; PJ34并不显著增加γ射线对HepG2细胞增殖的抑制作用.
引文著录: 周欣, 黄志勇, 陈孝平, 黄胜辉. PARP-1抑制剂PJ34对人肝癌细胞株HepG2的抑制作用. 世界华人消化杂志 2007; 15(16): 1806-1809
Revised: March 21, 2007
Accepted: March 31, 2007
Published online: June 8, 2007
AIM: To evaluate the inhibitory effect and its mechanism of poly (ADP-ribose) polymerase-1 inhibitor, PJ34, on the growth of human hepatoma cell line, and investigate whether PJ34 can further enhance the suppression of γ-rays on HepG2 cell growth.
METHODS: Cell proliferation test was conducted to observe the effects of various concentrations of PJ34 or PJ34 in combination with γ-rays on the growth of HepG2 cells. Flow cytometry was used to examine the apoptosis rate in the PJ34-treated HepG2 cells.
RESULTS: PJ34 significantly suppressed the growth of HepG2 cells (t = 15.175, P < 0.01). The suppressive effects were enhanced with the increase of PJ34 concentration. 1Gy γ-rays also significantly inhibited HepG2 cell growth, but there was no significant difference in cell growth between the group with γ-rays or PJ34 alone and the group with combination (t = -1.413, P > 0.05) PJ34 induced apoptosis of HepG2 cells, and the apoptosis rate of PJ34-treated cells was significantly higher than that of the control cells at 72 h (33.2% vs 11.4%, P < 0.01).
CONCLUSION: PARP-1 inhibitor PJ34 can directly inhibit the cell growth of HepG2 cells through inducing cell apoptosis. However, PJ34 does not significantly increase the inhibitory effects of γ-rays on HepG2 cells.
- Citation: Zhou X, Huang ZY, Chen XP, Huang SH. Suppressive effect of poly (ADP-ribose) polymerase-1 inhibitor PJ34 on human hepatoma cell line HepG2. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1806-1809
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1806.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1806
肝癌是我国常见的恶性肿瘤之一, 其手术切除率低, 易复发和转移, 目前尚无有效的药物治疗, 预后差. 因此, 寻找新的有效的药物, 对肝癌的治疗具有重要的意义. PJ34[N-(6-oxo-5, 6-dihydrophenanthridin-2-yl)-N, N-dimethylacetamide. HCl]是选择性PARP-1抑制剂, 能有效的抑制PARP-1活性. 在PARP-1活性增高的肿瘤中, 选择性抑制PARP-1活性, 能抑制恶性黑色素瘤、中枢神经系统肿瘤、乳腺癌等恶性肿瘤的生长[1-3]. 我们在前期研究中发现, 人肝癌组织及肝癌细胞株HepG2中PARP-1的表达增高[4], 因此抑制PARP-1活性可能达到治疗肝癌的目的. 本研究选择人肝癌细胞株HepG2首先在体外研究PARP-1抑制剂PJ34对HepG2细胞的抑制作用.
HepG2细胞株为华中科技大学同济医学院附属同济医院肝脏外科实验室提供. 用含100 mL/L的胎牛血清的DMEM培养液于37oC、50 mL/L CO2培养箱培养. PJ34购自美国Inotek Pharmaceutical公司.
1.2.1 细胞增殖实验: 将对数生长期的HepG2细胞消化后制成单细胞悬液, 并计数. 将5×104个细胞置于直径为6 cm的培养皿中培养, 分为空白对照组和实验组, 每组9个培养皿. 实验组HepG2细胞以分别含0.5, 1.0, 2.0 mg/L的PJ34的DMEM培养液培养, 空白对照组以常规DMEM培养液培养. γ射线照射剂量为1Gy, 细胞种植贴壁后的次日开始第一次照射, 细胞每3天更换培养液1次, 每次换液后的次日照射1次, 共照射3次. 对照组与实验组同时换液, 但不接受照射. 实验组和对照组的细胞分别于培养3, 6和9 d后计数, 每次计数3个培养皿, 取平均值.
1.2.2 细胞凋亡的测定: 将HepG2细胞植入6孔培养板中, 以100 mL/L的胎牛血清的DMEM培养液培养, 待细胞增殖至对数生长期, 实验组HepG2细胞中加入终浓度为1.0 mg/L的PJ34溶液培养细胞, 而对照组细胞在不含PJ34的培养液中培养, 分别于培养后12, 24, 48, 72 h收集细胞, 用PBS溶液洗涤、离心后, 冰乙醇固定, 离心去乙醇, 加入碘化丙啶(PI)染液(含RNAse)过夜. 采用PI染色法, 在FACSort流式细胞仪(美国)下分析DNA含量.
统计学处理 采用配对t检验分析PJ34对HepG2细胞增殖的影响和χ2检验分析PJ34对HepG2细胞凋亡的影响, 应用SPSS12.0统计软件对实验结果进行统计学处理.
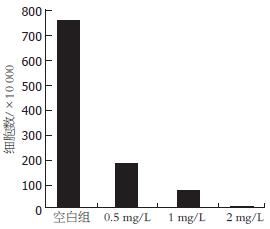
当PJ34浓度为0.5 mg/L, 与对照组相比, HepG2细胞在给予PJ34培养第6天时开始出现增殖明显减慢, 至第9天, 增殖抑制达到高峰, 与空白对照组相比较有明显的差异(t = 15.175, P<0.01, 图1A). 当PJ34的浓度增加至1 mg/L和2 mg/L时,同样观察到PJ34对HepG2细胞的增殖抑制作用(图1B-C), 且PJ34对HepG2的增殖抑制作用随着PJ34浓度升高而进一步增强, 0.5, 1和2 mg/L浓度PJ34培养HepG2于培养第9天计数的细胞平均数呈递减趋势(图2). 当以剂量为1Gy的γ射线照射HepG2细胞时, HepG2细胞的增殖明显受抑, 但γ射线照射联合不同浓度的PJ34培养对HepG2细胞的抑制作用与单用PJ34或γ射线照射对HepG2细胞的增殖抑制作用比较无显著统计学差异(t = -1.413, P>0.05).
对1 mg/L PJ34培养的HepG2细胞和不含PJ34培养的对照组细胞于培养后12, 24, 48和72 h行流式细胞仪检测, 结果显示, 含1 mg/L PJ34培养的HepG2细胞在培养后第12, 24, 48, 72小时, 其细胞凋亡率逐渐增高, 于72 h时凋亡率达到33.2%, 而对照组细胞72 h时凋亡率为11.4%, 二者有显著性差异(P<0.01, 图3A-B). 其空白对照组的细胞凋亡率随着时间的延长稍有升高, 这可能与培养过程中自然凋亡细胞的积累有关.
聚腺苷酸二磷酸核糖转移酶-1[poly(ADP-ribose) polymerase-1, PARP-1]是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 他在DNA修复和细胞凋亡中发挥至关重要的作用. PAPR-1的缺失使细胞对DNA损伤因子易感, 可能与某些肿瘤的发生有关[5], 同时, 抑制PARP-1可能减少DNA修复, 增强肿瘤的放疗或化疗效果[6]. Nozaki et al[7]通过破坏PARP外显子1产生PARP-1 -/-小鼠, 给予氧化偶氮甲烷(AOM)后PARP-1 -/-小鼠结肠腺瘤和腺癌、肝脏结节发生率均明显高于PARP +/+组, 提示PARP-1缺失与结肠肿瘤的发生有关. 而Nomura et al[8]利用P32标记NAD后多聚ADP核糖基化的蛋白凝胶电泳发现, 肝癌组织中116 kDa蛋白条带明显高于邻近非肿瘤组织, 提示PARP-1在肝癌组织中可能高表达. 我们最近的研究表明, 人肝癌组织中PARP-1的表达明显高于其癌周肝组织[4]. 虽然我们对PARP-1在肝癌中高表达的意义并不完全清楚, 推测可能与乙肝病毒感染和化学致癌剂产生的DNA损伤诱导机体启动DNA损伤修复机制有关. 因此, 抑制PARP-1, 阻止肝癌中PARP-1介导的DNA损伤修复机制, 则可使已损伤的DNA得不到修复, 从而对肝癌细胞的增殖产生抑制作用, 并可能增强放、化疗对肝癌细胞DNA损伤, 进一步提高放、化疗对肝癌的抑制作用.
我们的研究发现, PARP-1抑制剂PJ34能够对肝癌细胞株HepG2细胞的增殖产生明显的抑制作用, 且有明显的量效关系. PJ34虽然能一定程度增强γ射线照射对HepG2的增殖抑制作用, 但联合应用PJ34和γ射线照射对HepG2细胞的抑制作用与单用PJ34或单纯γ射线照射相比较无统计学差异. 这可能与单用PJ34本身已对HepG2细胞的增殖产生了显著的抑制, 致使对γ射线对HepG2细胞的抑制作用的增强效果不再显著有关. 对PARP-1抑制剂诱导肿瘤细胞凋亡的分子机制的已在对乳腺癌的治疗有研究报道[9], 即半胱-天冬蛋白酶Casepase7和Casepase3可以通过识别PARP-1核定位信号(NLS)的DEVD模序, 促使DNA结合域与催化域分离导致PARP-1分裂成p89和p24两个片段, 后者可不可逆结合于DNA断端, 抑制PARP-1与DNA断端结合能力, 导致PARP-1损伤修复作用丧失, 诱发凋亡[10]. 我们的研究还表明, 给予PJ34培养的HepG2细胞72 h时凋亡率明显增高, 其凋亡率与空白组有显著性差异, 证明PJ34同样能显著诱导肝癌细胞株HepG2的凋亡.
目前, PARP-1的抑制剂在国外已经在对恶性黑色素瘤、中枢神经系统肿瘤、乳腺癌等恶性肿瘤的治疗中进入I期临床实验阶段[2-3], 但对PARP-1的抑制剂是否可用于对肝癌的治疗尚无研究报道. 该研究首次揭示PARP-1的抑制剂PJ34能直接抑制肝癌细胞的增殖, 其机制是通过诱导肝癌细胞凋亡. 虽然这一观察有待于在动物实验中来进一步证实, 该研究的重要意义在于揭示PARP-1抑制剂PJ34对肝癌细胞有直接抑制作用, 为我们的肝癌治疗的研究提供了一个新的药物治疗靶点. 相信随着对PARP-1抑制剂治疗肝癌研究的深入, 以及联合其他抗肿瘤治疗手段的应用, PARP-1抑制剂可能在将来肝癌治疗中发挥重要的作用.
PARP-1是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 他参与的聚ADP核糖化是真核细胞中蛋白质翻译后的重要修饰方法之一, 在DNA修复、细胞凋亡和肿瘤发生过程中发挥着至关重要的作用.
本研究揭示PARP-1抑制剂PJ34能够对肝癌细胞株HepG2细胞的增殖产生明显的抑制作用, 且有明显的量效关系. 通过抑制PARP-1活性对肝癌可能具有潜在治疗价值, 并可能成为肝癌治疗的新方法.
1 PARP-1: 聚腺苷酸二磷酸核糖转移酶-1[poly(ADPribose)polymerase-1]是存在于真核细胞中催化聚ADP核糖化的细胞核酶, 他在DNA修复和细胞凋亡中发挥至关重要的作用. PAPR-1的缺失使细胞对DNA损伤因子易感, 可能与某些肿瘤的发生有关. 2 PJ34:[N-(6-oxo-5, 6-dihydrophenanthridin-2-yl)-N, N-dimethylacetamide. HCl]是选择性PARP-1抑制剂, 能有效的抑制PARP-1活性.
本文作者针对PARP-1抑制剂PJ34对人肝癌细胞株HepG2增殖的影响进行了研究, 研究结果为肝癌治疗提供了一个新的药物治疗靶点, 具有实际意义.
编辑: 张焕兰 电编:何基才
| 1. | Haince JF, Rouleau M, Hendzel MJ, Masson JY, Poirier GG. Targeting poly(ADP-ribosyl)ation: a promising approach in cancer therapy. Trends Mol Med. 2005;11:456-463. [PubMed] |
| 2. | Available from: http://www.eddn.org/clinicalTr_caResUK.html. |
| 3. | Tentori L, Leonetti C, Scarsella M, Vergati M, Xu W, Calvin D, Morgan L, Tang Z, Woznizk K, Alemu C. Brain distribution and efficacy as chemosensitizer of an oral formulation of PARP-1 inhibitor GPI 15427 in experimental models of CNS tumors. Int J Oncol. 2005;26:415-422. [PubMed] |
| 5. | Dandri M, Burda MR, Burkle A, Zuckerman DM, Will H, Rogler CE, Greten H, Petersen J. Increase in de novo HBV DNA integrations in response to oxidative DNA damage or inhibition of poly (ADP-ribosyl) ation. Hepatology. 2002;35:217-223. [PubMed] |
| 6. | Farmer H, McCabe N, Lord CJ, Tutt AN, Johnson DA, Richardson TB, Santarosa M, Dillon KJ, Hickson I, Knights C. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 2005;434:917-921. [PubMed] |
| 7. | Nozaki T, Fujihara H, Watanabe M, Tsutsumi M, Nakamoto K, Kusuoka O, Kamada N, Suzuki H, Nakagama H, Sugimura T. Parp-1 deficiency implicated in colon and liver tumorigenesis induced by azoxymethane. Cancer Sci. 2003;94:497-500. [PubMed] |
| 8. | Nomura F, Yaguchi M, Togawa A, Miyazaki M, Isobe K, Miyake M, Noda M, Nakai T. Enhancement of poly-adenosine diphosphate-ribosylation in human hepatocellular carcinoma. J Gastroenterol Hepatol. 2000;15:529-535. [PubMed] |
| 9. | Yu SW, Wang H, Poitras MF, Coombs C, Bowers WJ, Federoff HJ, Poirier GG, Dawson TM, Dawson VL. Mediation of poly (ADP-ribose) polymerase-1-dependent cell death by apoptosis-inducing factor. Science. 2002;297:259-263. [PubMed] |
| 10. | Veuger SJ, Curtin NJ, Richardson CJ, Smith GC, Durkacz BW. Radiosensitization and DNA repair inhibition by the combined use of novel inhibitors of DNA-dependent protein kinase and poly (ADP-ribose) polymerase-1. Cancer Res. 2003;63:6008-6015. [PubMed] |