修回日期: 2007-01-01
接受日期: 2007-01-10
在线出版日期: 2007-06-08
目的: 应用组织芯片技术考察骨桥蛋白(osteopontin, OPN)和Syndecan-1在原发性肝细胞癌(hepatocellular carcinoma, HCC)中的表达及与临床病理参数之间的相关性, 分析两者在HCC发生发展过程中的可能机制.
方法: 应用S-P法对高通量肝癌组织芯片(478点阵, 产品批号: OD-CT-DgLiv01-001)进行染色, 检测OPN和Syndecan-1蛋白在肝癌、肝硬化和正常肝组织中的表达.
结果: OPN在HCC、肝硬化和正常肝组织中的阳性率分别为73.3%, 47.4%和22.2%, 差异具有显著性(P<0.05, P<0.05); Syndecan-1在HCC、肝硬化和正常肝组织中的阳性率分别为19.6%, 35.0%和90%, 亦有显著性差异(P< 0.05, P<0.01). 单因素分析结果显示OPN的表达与肿瘤包膜的完整性(χ2 = 4.52, P<0.05), 门静脉有无癌栓(χ2 = 4.28, P<0.05)及肿瘤的转移相关(χ2 = 7.21, P<0.05), 与其他临床病理特征没有相关性; Syndecan-1的表达与肿瘤有无包膜(χ2 = 5.58, P<0.01), 病理分级(χ2 = 4.35, P<0.01)以及肿瘤转移与否相关(χ2 = 3.37, P<0.05), 与其他临床病理特征没有相关性. 蛋白之间的相关性分析显示, OPN与Syndecan-1之间存在负相关(r = -0.439, P< 0.01).
结论: 组织芯片是一种可高效率和高通量研究肿瘤分子病理的技术平台; HCC的发生发展与癌细胞OPN的过表达和Syndecan-1表达下调可能有关, OPN可能通过下调Syndecan-1的表达, 降低肿瘤细胞之间的黏附性, 从而促进肿瘤的转移.
引文著录: 刘秀峰, 施瑞华, 张国新, 王学浩, 郜恒骏, 秦叔逵. OPN和Syndecan-1在原发性肝癌中的表达及与临床病理参数之间的相关性. 世界华人消化杂志 2007; 15(16): 1800-1805
Revised: January 1, 2007
Accepted: January 10, 2007
Published online: June 8, 2007
AIM: To explore the expression of osteopontin (OPN) and syndecan-1 as well as their correlations with the clinical pathological characteristics of hepatocellular carcinoma (HCC) by tissue microarray (TMA) technique, and analyze the potential mechanisms during the development and progression of HCC.
METHODS: The expression patterns of OPN and syndecan-1 proteins in HCC, liver cirrhosis (LC) and normal liver tissue (NLT) were investigated using high throughput TMA specified to HCC (478 spots, product batch No: OD-CT-DgLiv01-001) by SP method.
RESULTS: The positive rate of OPN in HCC was significantly higher than that in LC or NLT (73.3% vs 47.4%, 22.2%, both P < 0.05). Correspondingly, the positive rate of Syndecan-1 expression was significantly lower than that in LC or NLT (19.6% vs 35.0%, 90.0%, P < 0.05, P < 0.01). The results of single-factor analysis showed that OPN expression was correlated with the integrality of tumor membrane (χ2 = 4.52, P < 0.05), the formation of embolus in portal vein (χ2 = 4.28, P < 0.05) and metastases (χ2 = 7.21, P < 0.05). Syndecan-1 expression was correlated with the integrality of tumor membrane (χ2 = 5.58, P < 0.01), metastases (χ2 = 3.37, P < 0.05) and pathological grades (χ2 = 4.35, P < 0.01). Moreover, OPN was negatively correlated with syndecan-1 (r = -0.439, P < 0.01).
CONCLUSION: TMA is a high-throughput platform by which molecular pathology of cancer can be studied effectively. Over-expression of OPN and down-regulation of syndecan-1 may be involved in the development and progression of HCC, suggesting that OPN may decrease the adhesiveness of tumor cells and promote the metastasis by down-regulating the expression of syndecan-1.
- Citation: Liu XF, Shi RH, Zhang GX, Wang XH, Gao HJ, Qin SK. Study on the expression of Osteopontin and Syndecan-1 and their correlations with the clinical pathological characteristics of hepatocellular carcinoma by tissue microarray technique. Shijie Huaren Xiaohua Zazhi 2007; 15(16): 1800-1805
- URL: https://www.wjgnet.com/1009-3079/full/v15/i16/1800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i16.1800
原发性肝细胞癌目前是世界上死亡率第3位的恶性肿瘤, 在亚洲和非洲发生率很高, 近年在欧美国家发病率呈上升趋势. 尽管HCC的临床研究取得了较大进步, 但其复发率仍然较高. 我们在前期应用基因芯片对HCC的差异基因表达谱进行筛选时, 发现osteopontin(OPN)和Syndecan-1基因分别出现了上调和下调表达.
OPN是一个有多种功能的分泌型钙结合磷酸化糖蛋白, 在多种实体瘤中均有表达, 目前该基因在HCC中的研究是热点课题; Syndecan-1属于黏附分子家族成员, 研究发现其分子的表达在控制恶性肿瘤细胞生长和转移等过程中具有重要作用. 本研究在基因芯片工作的基础上应用高通量肝癌特异性组织芯片(478点阵)(TMA), 考察两者在HCC中的表达及与临床病理参数之间的相关性.
OPN鼠抗人单克隆抗体系Santa Cruz公司产品, Syndecan-1鼠抗人单克隆抗体购自Ebioscience公司, SP染色试剂盒和DAB显色试剂盒购自福州迈新生物技术开发公司, 一抗工作浓度均为1:100. 以PBS代替一抗作为阴性对照.
高通量肝癌TMA(产品批号: OD-CT-DgLiv01-001)是芯超公司郜恒骏教授与上海市肿瘤研究所顾健人院士合作推出的最新产品. 高通量-478个样本; 高质量-最新鲜的标本材料和最敏感的生物学活性; 高价值-203例肝细胞癌组织、18例肝硬化组织、10例正常肝组织和14例其他组织对照. 每个点都经过病理诊断.
使用前将TMA从冰箱中取出放于玻片架上复温, 然后60℃左右烘烤3 h将表面封蜡融掉. 然后置于二甲苯10 min, 无水乙醇5 min, 95%乙醇5 min, 70%乙醇5 min, 进行脱蜡水化. 采用高压热修复法进行抗原热修复. S-P免疫组织化学染色参考试剂盒说明.
观察阳性反应采用双盲法, 并由两位上海第二医科大学附属仁济医院的病理学专家独立观察TMA每个点阵的信息, 进行详细记录. 免疫组化染色结果按0-3+进行记录, 记数胞质、胞膜和/或胞核阳性染色细胞所占比例. 阴性为≤10%的肿瘤细胞染色, 10%-25%阳性记为1+, 26%-50%记为2+, 51%-75%记为3+, 76%-100%记为4+.
统计学处理 采用SPSS11.0软件包进行统计学处理, 相关蛋白与HCC临床病理指标之间的关系用χ2检验; 蛋白之间在肿瘤组织中表达的相关性用Spearman进行相关性检验分析. 检验水准以P<0.05为有显著性差异.
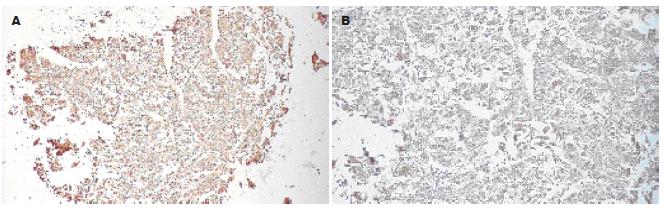
如图2所示, A表示TMA点阵全貌(×100), B表示局部放大结果(×200), 以下相同. OPN表达一般定位于HCC细胞的胞质, 少数肿瘤细胞胞膜和胞质同时阳性. 而肝硬化组织中阳性着色细胞明显减少, 而正常肝组织几乎呈阴性.
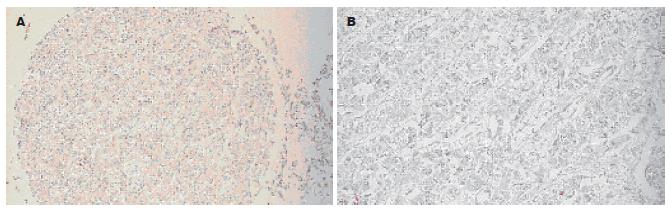
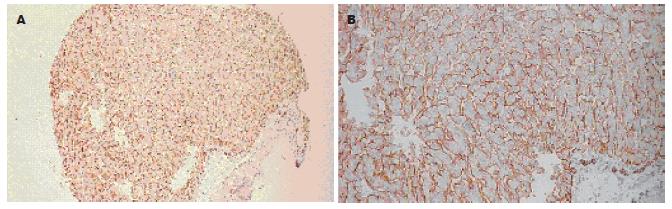
如图3, 4所示, Syndecan-1蛋白在HCC组织中基本不表达, 而在正常肝组织中呈明显阳性表达, 主要定位于细胞膜以及细胞与细胞之间的紧密连接.
OPN染色过程中, 在203例HCC样本中出现了8例脱片, 20例肝硬化组织和10例正常肝组织分别有1例脱片; Syndecan-1染色过程中, 在203例HCC样本中出现了4例脱片, 20例肝硬化组织和10例正常肝组织没有脱片发生.
如表1所示, OPN在HCC组织中的阳性率为73.3%, 与正常肝组织相比, 明显升高(P = 0.030). 而肝硬化组织的染色阳性率为47.4%, 与HCC组织比较, 差异亦有显著性(P = 0.041). 深入考察OPN与HCC临床病理特征之间的相关性, 如表2所示, OPN的表达与肿瘤包膜的完整性、门静脉有无癌栓以及肿瘤的转移与否有一定的相关性, 与其他临床病理特征没有相关性. Syndecan-1在HCC组织中的阳性率为19.6%, 正常肝组织的阳性率为90%, 而肝硬化组织的染色阳性率为35.0%, 与HCC组织比较, 均具有显著性差异. 深入考察Syndecan-1与HCC临床病理特征之间的相关性, Syndecan-1的表达与肿瘤转移与否、病理分级以及肿瘤有无包膜有相关性, 与其他临床病理特征没有相关性. 相关性检验分析发现OPN与Syndecan-1之间存在负相关(r = -0.439, P = 0.003, 表3).
| 组织类型 | OPN | Syndecan-1 | ||||
| n | 阳性率(%) | P | n | 阳性率(%) | P | |
| HCC | 195 | 143(73.3) | 199 | 39(19.6) | ||
| 肝硬化 | 19 | 9(47.4) | 0.041 | 20 | 7(35.0) | 0.032 |
| 正常肝 | 9 | 2(22.2) | 0.030 | 10 | 9(90.0) | 0.001 |
| 临床病理特征 | OPN | Syndecan-1 | |||||||
| n | 阳性率(%) | χ2 | P | n | 阳性率(%) | χ2 | P | ||
| 年龄(岁) | |||||||||
| < 50 | 83 | 61(73.5) | 0.336 | 0.910 | 86 | 17(19.8) | 0.621 | 0.701 | |
| ≥50 | 112 | 82(73.2) | 113 | 22(19.5) | |||||
| 性别 | |||||||||
| 男 | 101 | 72(71.3) | 0.410 | 0.877 | 103 | 21(20.4) | 0.710 | 0.696 | |
| 女 | 94 | 71(75.5) | 96 | 18(18.8) | |||||
| 肿瘤直径 | |||||||||
| < 5 cm | 75 | 59(78.7) | 0.424 | 0.760 | 76 | 16(21.1) | 0.770 | 0.650 | |
| ≥5 cm | 120 | 84(70.0) | 123 | 23(18.7) | |||||
| 肿瘤数目 | |||||||||
| 单发 | 72 | 53(73.6) | 0.330 | 0.915 | 74 | 13(17.6) | 0.800 | 0.373 | |
| 多发 | 123 | 90(73.2) | 125 | 26(20.8) | |||||
| AFP(μg/L) | |||||||||
| <400 | 96 | 74(77.1) | 0.615 | 0.690 | 97 | 18(18.6) | 0.744 | 0.670 | |
| ≥400 | 99 | 69(69.7) | 102 | 21(20.6) | |||||
| 肿瘤包膜 | |||||||||
| 有 | 109 | 71(65.1) | 4.520 | 0.037 | 109 | 11(10.1) | 5.582 | 0.003 | |
| 无 | 86 | 72(83.7) | 90 | 28(31.1) | |||||
| 门静脉癌栓 | |||||||||
| 有 | 133 | 111(83.5) | 4.281 | 0.044 | 132 | 26(19.7) | 0.620 | 0.723 | |
| 无 | 62 | 32(51.6) | 67 | 13(19.4) | |||||
| 肿瘤转移 | |||||||||
| 有 | 87 | 80(92.0) | 7.211 | 0.013 | 90 | 9(10.0) | 3.373 | 0.015 | |
| 无 | 108 | 63(58.3) | 109 | 30(27.5) | |||||
| Child-Pugh | |||||||||
| A | 67 | 47(70.1) | 0.370 | 0.865 | 65 | 12(18.5) | 1.010 | 0.086 | |
| B | 61 | 45(73.8) | 64 | 11(17.2) | |||||
| C | 67 | 51(76.1) | 70 | 16(22.9) | |||||
| 病理分级 | |||||||||
| Ⅰ | 40 | 31(77.5) | 0.436 | 0.751 | 44 | 18(40.9) | 4.346 | 0.008 | |
| Ⅱ | 92 | 65(70.7) | 91 | 15(16.5) | |||||
| Ⅲ | 63 | 47(74.6) | 64 | 6(9.4) | |||||
| 临床分期 | |||||||||
| Ⅰ | 59 | 41(69.5) | 0.550 | 0.713 | 60 | 10(16.7) | 0.757 | 0.654 | |
| Ⅱ | 61 | 48(78.7) | 67 | 14(20.9) | |||||
| Ⅲ | 75 | 54(72.0) | 72 | 15(20.8) | |||||
| OPN | Syndecan-1 | ||||
| - | + | ++ | +++ | ++++ | |
| - | 52 | 14 | 7 | 3 | 0 |
| + | 20 | 12 | 2 | 1 | 0 |
| ++ | 28 | 10 | 7 | 0 | 0 |
| +++ | 49 | 5 | 2 | 0 | 0 |
| ++++ | 34 | 0 | 0 | 0 | 0 |
TMA技术随基因芯片技术与功能基因组的发展应运而生, 与细胞芯片、蛋白芯片、抗体芯片一样, 属于一种特殊生物芯片技术. TMA技术可以将数十个甚至上千个不同个体的临床组织标本按预先设计的顺序排列在一张玻片上进行分析研究, 是一种高通量、多样本的基因功能分析工具. 他使科研人员第1次有可能同时对几百甚至上千种正常或疾病以及疾病发展不同阶段的自然病理生理状态下的组织样本, 进行某一个或多个特定的基因, 或与其相关的表达产物的研究. 这对人类基因组学的研究与发展, 尤其对基因和蛋白质与疾病关系的研究, 疾病相关基因的验证、新药物的开发与筛选、疾病的分子诊断, 治疗过程的追踪和预后等方面具有实际意义和广阔的市场前景[1]. 1998年Kononen et al[2]首次应用TMA技术对6种基因在1000乳腺癌中的表达情况进行了研究, 揭开了TMA的研究序幕.
OPN是一种黏附蛋白, 又是一种细胞因子, 是一个有多种功能的分泌型钙结合磷酸化糖蛋白, 相对分子质量为41.5 kDa. 编码他的单基因序列在脊椎动物中是高度保守的, 与许多细胞外基质(ECM)蛋白一样具有RGD(精氨酸-甘氨酸-天冬氨酸)细胞黏附序列[3]. OPN的受体家族包括整合素受体和CD44受体[4]. 通过受体结合, 促进细胞的趋化、黏附和迁移, 参与骨的吸收, 也能与羟磷灰石结合参与骨的形成.
OPN在肺癌[5]、乳腺癌[6-8]、胃癌[9]、前列腺癌[10-11]以及卵巢癌[12-13]等肿瘤中均有表达, 而应用TMA技术研究OPN与HCC相关性的报道不多. 本研究在前期的基因芯片结果中, 发现OPN在HCC中的表达水平较癌旁组织上调了3.6293倍, 较正常肝组织上调了4.6367倍(结果未显示). 在蛋白水平的深入研究发现, 在HCC、肝硬化和正常肝组织中的阳性表达率分别是73.3%、47.4%和22.2%, 差异具有显著性. 与临床病理参数之间的相关性分析显示, OPN过表达与肿瘤包膜、门静脉癌栓和转移呈正相关. 蛋白之间的相关性分析发现, OPN与Syndecan-1之间呈负相关(r = -0.439, P = 0.003), 提示OPN可能通过下调Syndecan-1的表达, 降低肿瘤细胞之间的黏附性, 从而促进肿瘤的转移. 目前OPN的受体CD44已经被用来作为各种肿瘤的治疗靶点, 整合素受体αvβ3不仅对肿瘤细胞的弥散有作用, 而且对血管生成和骨转移的骨质溶解起作用. 因此, OPN和他的主要受体将成为治疗肿瘤新的药物靶点.
Syndecan-1(CD138)来自于希腊文syndein, 是指将细胞微环境成分与细胞骨架结合起来. 他属于黏附分子整合素跨膜黏连蛋白聚糖家族成员, 通过其分子表面的硫酸肝素侧链可结合一系列配基如细胞黏附分子、基质成分、生长因子、酶和酶抑制物等, 以共受体方式调节细胞与微环境之间的相互作用, 参与组织器官分化发育、血管形成、组织再生等一系列生理过程的调节[14]. 随着研究的深入, 人们发现Syndecan-1分子的表达在控制恶性肿瘤细胞生长和转移等过程中具有重要作用, 而且可作为判断肿瘤预后的指标, 指导临床诊断与治疗.
Syndecan-1分子属于Ⅰ型跨膜蛋白, 含有N末端信号肽. 小鼠分子定位于12号染色体, 人则定位在第2号染色体(2p23), 基因全长含有5个外显子, 分别编码分子量为3.5 kD单链结构的核心蛋白. 在人类恶性肿瘤形成过程中, 肿瘤细胞表面Syndecan-1分子的表达可以缺失. 如头颈部及肺部鳞状上皮癌细胞Syndecan-1分子的表达水平降低, 并与肿瘤恶性程度、瘤体积、淋巴结肿大、临床分期及预后呈负相关. 乳腺浸润性导管癌细胞较之正常乳房导管上皮细胞, Syndecan-1表达明显减少, 而周围结缔组织和基质细胞表面Syndecan-1分子表达增加. 皮肤鳞状细胞癌Syndecan-1表达缺失, 伴随鳞状细胞失黏附增加, 从而促进肿瘤细胞侵入皮肤[15].
目前有关Syndecan-1与HCC之间的相关性研究报道很少, 可能的机制还不清楚. 我们应用TMA技术分析Syndecan-1在HCC组织中的表达情况, 结果发现Syndecan-1主要定位于细胞膜上, 在HCC中的阳性率为19.6%, 正常肝组织的阳性率为90%, 而肝硬化组织的染色阳性率为35.0%, 与HCC组织比较, 均具有显著性差异. 深入考察Syndecan-1与HCC临床病理特征之间的相关性, 发现Syndecan-1的表达与肿瘤转移与否、病理分级以及肿瘤有无包膜有相关性, 与其他临床病理特征没有相关性. 提示肝癌细胞Syndecan-1分子表达下降或缺失是肝癌细胞具有高度转移性的一个特征, 是肝癌细胞的转移抑制因子. 由于Syndecan-1分子能与碱性成纤维细胞生长因子(bFGF)结合[16], 故肿瘤基质Syndecan-1分子的积聚有助于血管形成和基质增生. 因此, HCC细胞表面Syndecan-1分子表达的缺失和基质细胞高表达Syndecan-1, 是促进HCC转移的关键.
TMA是一个令人兴奋、功能强大的研究工具, 具有高通量、大样本、省时快速、简便经济、用途广泛、结果可靠、便于设计实验对照、可进行自动化研究等优点. 利用这一技术可以使疾病的分子诊断、预后和治疗等相关领域的大规模研究和开发成为可能. 但TMA仍以手工制作和人工判断和读片为主, 所以自动化制备技术的发展无疑十分重要, 这些技术目前仍在研发之中[1]. TMA的应用领域十分广阔并正在进一步拓展, 相信这一技术在后基因组学、蛋白质组学、药物基因组学、生物信息学等相关领域将发挥越来越重要的作用.
原发性肝细胞肝癌(HCC)目前是世界上死亡率第3位的恶性肿瘤, 在亚洲和非洲发病率很高, 近年在欧美国家也呈上升趋势. 尽管临床研究取得了较大进步, 但其复发率仍然较高.OPN是一个有多种功能的分泌型钙结合磷酸化糖蛋白, 在多种实体瘤中均有表达, 目前该基因在HCC中的研究是热点课题;Syndecan-1属于黏附分子家族成员, 研究发现其分子的表达在控制恶性肿瘤细胞生长和转移等过程中具有重要作用. 本研究应用生物芯片上海国家工程中心的高通量肝癌特异性组织芯片(478点阵), 考察两者在HCC中的表达及与临床病理参数之间的相关性.
OPN在肺癌、乳腺癌、胃癌、卵巢癌以及前列腺癌等肿瘤中均有表达, 而与HCC预后的临床病理参数之间相关性的报道不多. 有关Syndecan-1与HCC之间的相关性研究报道甚少, 可能的机制还不清楚.
小样本研究显示, OPN与HCC有无浸润、肿瘤的大小、分期以及AFP的水平相关, OPN可能作为一个新的Tcf信号通路的下调因子直接促进肿瘤转移, 还可能通过诱导uPA和MMPs的水解作用或与VEGF共同刺激内皮细胞的迁移, 促进肿瘤新生血管的形成. 另有研究报道, 在人类恶性肿瘤形成过程中, 肿瘤细胞表面Syndecan-1分子的表达可以缺失, 但与HCC的相关性鲜见报道.
本研究应用生物芯片上海国家工程中心的高通量肝癌特异性组织芯片(478点阵), 考察OPN和Syndecan-1在HCC中的表达及与临床病理参数之间的相关性, 目前国内外尚无如此大样本的研究.
研究发现, HCC的发生发展与癌细胞OPN的过表达和Syndecan-1表达下调可能有关, OPN可能通过下调Syndecan-1的表达, 降低肿瘤细胞之间的黏附性, 从而促进肿瘤的转移.OPN和Syndecan-1可能成为治疗HCC的药物靶点.
1组织芯片(tissuemicroarray, TMA):与细胞芯片、蛋白芯片、抗体芯片一样, 属于一种特殊生物芯片.TMA可以将数十个甚至上千个不同个体的临床组织标本按预先设计的顺序排列在一张玻片上进行分析研究, 是一种高通量、多样本的分析工具.骨桥蛋白(OPN):是一种黏附蛋白, 又是一种细胞因子, 是一个有多种功能的分泌型钙结合磷酸化糖蛋白, 相对分子质量为41.5kD.Syndecan-1:他属于黏附分子整合素跨膜黏连蛋白聚糖家族成员, 通过其分子表面的硫酸肝素侧链可结合一系列配基如细胞黏附分子、基质成分、生长因子、酶和酶抑制物等, 以共受体方式调节细胞与微环境之间的相互作用, 参与组织器官分化发育、血管形成、组织再生等一系列生理过程的调节.
本文选题新颖, 研究方案设计合理, 文笔流畅, 是一篇较好的基础研究文章.
编辑: 张焕兰 电编:郭海丽
| 1. | Shergill IS, Shergill NK, Arya M, Patel HR. Tissue microarrays: a current medical research tool. Curr Med Res Opin. 2004;20:707-712. [PubMed] |
| 2. | Kononen J, Bubendorf L, Kallioniemi A, Barlund M, Schraml P, Leighton S, Torhorst J, Mihatsch MJ, Sauter G, Kallioniemi OP. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nat Med. 1998;4:844-847. [PubMed] |
| 3. | Denhardt DT, Giachelli CM, Rittling SR. Role of osteopontin in cellular signaling and toxicant injury. AnnuRev Pharmacol To. xicol. 2001;41:723-749. [PubMed] |
| 4. | Sodek J, Zhu B, Huynh MH, Brown TJ, Ringuette M. Novel functions of the matricellular proteins osteopontin and osteonectin/SPARC. Connect Tissue Res. 2002;43:308-319. [PubMed] |
| 5. | Zhang J, Takahashi K, Takahashi F, Shimizu K, Ohshita F, Kameda Y, Maeda K, Nishio K, Fukuchi Y. Differential osteopontin expression in lung cancer. Cancer Lett. 2001;171:215-222. [PubMed] |
| 6. | Urquidi V, Sloan D, Kawai K, Agarwal D, Woodman AC, Tarin D, Goodison S. Contrasting expression of thrombospondin-1 and osteopontin correlates with absence or presence of metastatic phenotype in an isogenic model of spontaneous human breast cancer metastasis. Clin Cancer Res. 2002;8:61-74. [PubMed] |
| 7. | Reinholz MM, Iturria SJ, Ingle JN, Roche PC. Differential gene expression of TGF-beta family members and osteopontin in breast tumor tissue: analysis by real-time quantitative PCR. Breast Cancer Res Treat. 2002;74:255-269. [PubMed] |
| 8. | Tuck AB, Chambers AF. The role of osteopontin in breast cancer: clinical and experimental studies. J MammaryGland Biol Ne. oplasia. 2001;6:419-429. [PubMed] |
| 10. | Tozawa K, Yamada Y, Kawai N, Okamura T, Ueda K, Kohri K. Osteopontin expression in prostate cancer and benign prostatic hyperplasia. Urol Int. 1999;62:155-158. [PubMed] |
| 11. | Angelucci A, Festuccia C, D'Andrea G, Teti A, Bologna M. Osteopontin modulates prostate carcinoma invasive capacity through RGD-dependent upregulation of plasminogen activators. Biol Chem. 2002;383:229-234. [PubMed] |
| 12. | Kim JH, Skates SJ, Uede T, Wong KK, Schorge JO, Feltmate CM, Berkowitz RS, Cramer DW, Mok SC. Osteopontin as a potential diagnostic biomarker for ovarian cancer. JAMA. 2002;287:1671-1679. [PubMed] |
| 13. | Tiniakos DG, Yu H, Liapis H. Osteopontin expression in ovarian carcinomas and tumors of low malignant potential (LMP). Hum Pathol. 1998;29:1250-1254. [PubMed] |
| 14. | Lopes CC, Dietrich CP, Nader HB. Specific structural features of syndecans and heparan sulfate chains are needed for cell signaling. Braz J Med Biol Res. 2006;39:157-167. [PubMed] |
| 15. | 李 新燕, 张 学光. Syndecan-1分子研究进展. 国外医学分子生物学分册. 2001;23:30-33. |
| 16. | Li HG, Xie DR, Shen XM, Li HH, Zeng H, Zeng YJ. Clinicopathological significance of expression of paxillin, syndecan-1 and EMMPRIN in hepatocellular carcinoma. World J Gastroenterol. 2005;11:1445-1451. [PubMed] |