肝癌是最常见的恶性肿瘤之一, 其发生是一个复杂的生物学过程, 具体机制尚未完全阐明. 研究表明, 乙、丙型肝炎病毒感染, 黄曲霉毒素污染, 饮酒, 电离辐射以及具有有遗传毒性的人体代谢产物等能够诱导肝癌的发生, 他们大都直接作用于肝细胞的遗传物质, 引起DNA的损伤, 这是发生肝癌的重要分子基础. DNA损伤后引起细胞一系列的反应, 包括损伤信号的传导, 损伤修复, 诱导细胞死亡. 这些诱因也能作用于损伤修复系统中的某个环节, 使DNA损伤不能修复或不能正确修复, 细胞发生恶性转化. 因此, 损伤DNA的累积就成为肝癌发生的重要分子机制, 对其深入研究将会为肝癌的治疗奠定基础.
关键词: DNA损伤; DNA修复; 肝癌发生
引文著录: 朱德强, 黄志勇. DNA损伤与肝癌发生. 世界华人消化杂志 2007; 15(16): 1775-1780
DNA damage and liver cancer
De-Qiang Zhu, Zhi-Yong Huang
De-Qiang Zhu, Zhi-Yong Huang, Hepatic Surgery Center, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China
Supported by The New Centaury Excellent Talent Foundation from Ministry of Education, No. NCET-04-0701.
Correspondence to: Dr. Zhi-Yong Huang, Center of Hepatic Surgery, Tongji Hospital of Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China. zyhuang@medmail.com.cn
Received: May 18, 2007
Revised: May 25, 2007
Accepted: May 30, 2007
Published online: June 8, 2007
0 引言
人体细胞经常受到多种体内外因子的损伤, 如电离辐射(IR), 紫外线(UV)等物理因素, 烷化剂, 亚硝胺类等各种化学因素, 病毒感染等生物因素. 这些因素中具有遗传毒性的物质会造成各种各样的DNA损伤, 如单、双链缺口(SSB, DSB), 碱基突变, 碱基氧化损伤等. 如果损伤被正确修复, 细胞存活, 如果修复过程中出现缺失、插入等不正确的修复, 这些异常碱基的累积就可能导致癌症的发生. 如果损伤严重不能修复, 细胞就会启动凋亡程序, 诱导细胞死亡, 这条通路也被认为是阻止细胞恶性转化的最后一道屏障. 由此, 信号传导、损伤修复和诱导凋亡就形成了一个密切联系, 相互影响的复杂网络, 使细胞作为一个整体对DNA损伤作出反应, 因此, 任何一个系统功能的障碍都会降低DNA的稳定性, 为癌症发生奠定基础. 目前肝癌的发生机制尚未完全阐明, 但其发生与DNA的损伤密切相关. 诱发肝癌的主要危险因素包括乙、丙型肝炎病毒(HBV, HCV), 黄曲霉毒素B1(AFB1), 亚硝胺等. 这些诱因不仅能够引起肝细胞DNA的损伤, 而且能直接或间接影响损伤修复系统, 使DNA修复障碍, 从而导致肝癌的发生.
1 DNA损伤与修复机制
DNA损伤后首先是具有信号传导作用的酶或蛋白质识别并结合到损伤位点, 起信号传导作用的分子有: 运动失调性毛细血管扩张症基因突变体(ataxia telangiectasia mutated, ATM)/运动失调性毛细血管扩张症基因突变体和Rad3相关基因(ATM- and Rad3-related gene, ATR), 依赖DNA的蛋白激酶(DNA-PK), 聚腺苷酸二磷酸核糖转移酶-1(PARP-1)等. DNA损伤激活ATM/ATR后引起细胞周期停滞在G1, S, 或G2期, 以便细胞对损伤进行修复. DNA-PK作为最初的DNA损伤感受器, 介导细胞对损伤进行修复, 而不是损伤信号诱导的下游效应器[1]. PARP-1已被证明在许多修复通路包括碱基切除修复(BER)、同源重组(HR)中起重要作用[2], 因此, PARP-1迅速识别并结合DNA损伤位点一是为了防止缺口处的核苷酸受核酶分解和同源基因在局部发生错误重组; 二是募集各种修复蛋白对损伤进行修复[2]. 各信号传导系统构成复杂的信号传导网, 将DNA损伤信号传导给下游的修复蛋白和酶, 对损伤迅速修复. 哺乳动物细胞内主要有四种修复方式: 同源重组修复(homologous recombination, HR), 非同源末端连接(nonhomologous end-joining, NHEJ), 核苷酸切除修复(nucleotide-excision repair, NER), 碱基切除修复(base-excision repair, BER)[3], 但是没有哪种修复通路能够修复所有的损伤, 机体通过这四种主要的修复方式完成了大部分(但不是全部)的DNA损伤. DSB是严重的DNA损伤, 主要由HR和NHEJ修复完成, 但多数致癌因子不会直接引起DSB, 而是SSB, DNA氧化损伤, 各种DNA赘合物(DNA adducts)等相对较轻的损伤, 由NER和BER完成修复. 在NER和BER功能障碍时, 这些损伤变为DSB, 因此NER和BER是抵抗致癌因子的损伤、维持DNA稳定性的关键. NER主要修复外源性损伤物质介导的DNA损伤, 如UV, AFB1以及内源性的氧化损伤, 并且修复过程依赖ATP供能; BER主要修复内源性损伤物质如HBV感染引起的免疫反应导致的DNA微小损伤, 以及各种DNA-致癌因子赘合物等, 这些损伤可能不会阻滞细胞转录或复制的进行, 也不会引起细胞周期停滞[4], 这可能就是损伤DNA累积的机制. 已证明, PARP-1在BER中起重要作用, 而NER需要的应急能量也主要由PARP-1产生[5], 因此, PARP-1对维持肝细胞DNA稳定性有重要作用. 实验证明, PARP-1 -/-, Ku80 -/-的小鼠在胚胎期8.5 d前即发生生长停滞, 并于9.5 d死亡, 提示PARP-1和Ku80双缺失对小鼠是致命的. PARP-1 -/-, Ku80 -/+的小鼠肝腺瘤和肝癌的发生率明显增高[6], 并且Nomura et al[7]发现, 人肝癌组织中PARP-1比邻近非瘤组织表达增高且活性增强.
如果损伤不能修复或细胞周期停滞过长, 细胞就会启动P53介导的凋亡通路, 诱导细胞凋亡, 因此, P53介导的细胞凋亡被认为是防止细胞恶性转化的重要机制. 正常情况下, 鼠双微蛋白2(MDM2)紧密结合在P53的N-末端, 使P53失活并诱导其降解, MDM2受多种激酶磷酸化的调控, 如ATM/ATR, DNA-PK等, 磷酸化后的MDM2从P53脱落, P53恢复活性[8]. 如果细胞周期停滞过长, 也会激活ATM/ATR磷酸化MDM2使P53活性恢复并介导细胞凋亡[9]. Oren[10]认为, 在DNA损伤后, 细胞是进行修复还是诱导凋亡, 这取决于细胞内生存信号和凋亡信号的强弱对比, 而这又主要取决于DNA的损伤程度. 据研究, PARP-1在这一过程中起到重要作用, 轻度的DNA损伤, PARP-1被激活, 传导损伤信号并参与修复, 细胞存活; 中重度的DNA损伤, DNA修复失败, 导致不能正常的转录或复制, 引起细胞周期停滞时间过长, 诱发P53介导的细胞凋亡, 同时, P53介导PARP-1的降解, 以保证凋亡的能量需求; 严重的DNA损伤, PARP-1被大量激活, 引起能量耗竭, 导致细胞坏死[11].
2 乙肝病毒(HBV)与肝癌的发生
HBV引起肝癌发生的机制可能是通过病毒DNA整合到宿主DNA中, 引起基因重排和/或部分基因缺失[12]. 研究发现, 几乎所有HBV诱导的肝癌中, 都能发现整合的病毒DNA[13]. Hytiroglou et al[14]发现, 病毒DNA整合到宿主肝细胞DNA中时, 引起整合位点处的碱基缺失, 整合还可能发生在编码信号传导蛋白的基因、细胞增生调控基因序列中, 从而影响这些基因的表达. 通常情况下, 病毒DNA整合效率很低(每个细胞中约有10-50个可以整合的基因组), 但有DSB时, 整合效率明显提高[15]. 另据研究, DNA氧化损伤能增加病毒基因的整合效率[16], 而Choudhury et al[17]发现, 在LEV鼠系细胞中, HBV急性感染期, 宿主细胞修复碱基氧化损伤的BER功能降低, 在慢性炎症期, 修复功能恢复到正常水平. 修复能力的降低导致DNA氧化损伤的增加, 这样, HBV感染和细胞DNA的氧化损伤就形成恶性循环, 其机制可能是损伤的DNA不能阻滞细胞周期和转录复制的进行, 当细胞转录或复制到损伤位点时, 复制叉激发损伤位点处SSB变为DSB, 在DSB存在下, 病毒DNA整合效率明显提高. 整合的病毒基因能在宿主细胞中稳定表达, 引发机体持续的免疫反应导致DNA氧化损伤, 这时机体BER功能的恢复可使已感染的细胞免遭氧化损伤诱导的细胞凋亡, 为细胞的恶性转化提供条件. 此外, 病毒DNA还能编码乙肝病毒X蛋白(HBX), HBX能够干涉信号转导系统某些分子(如AP-1, PKC等), 涉及细胞周期、增生及凋亡基因的表达[18]. 但也有实验表明, HBX并不影响细胞的凋亡及增生, 但能降低UV诱导的DNA损伤修复能力, 增加宿主DNA对UV的敏感性[19], 表达HBX的HepG2细胞在没有经过UV处理时, 能表现和正常细胞相同的细胞周期和细胞凋亡过程, 也能修复DNA损伤, 这说明在HBV感染早期, 病毒数不足以引发病毒繁殖时, HBX能帮助病毒在细胞中存活. 经过UV处理后, 正常细胞会转导生存信号对损伤进行修复, 而表达HBX的HepG2细胞则倾向于转导凋亡信号, 表现出很强的G2/M期停滞反应和很高的细胞凋亡率, 这种作用可能是通过HBX和P53的相互作用增加P21的表达实现的. 此外, HBX能与P53直接作用, 改变但不阻滞P53的功能[20], 使P53在细胞中累积并稳定存在, 这主要通过HBX与P53的结合阻碍MDM2导致的P53降解, P53在细胞中累积导致肝细胞较高的凋亡率, 使感染后期大量增殖的病毒从宿主细胞中释放, 引起HBV的扩散. HBX损坏DNA修复系统和诱导细胞凋亡导致宿主细胞损伤DNA的累积和抗凋亡突变, 最终引起细胞恶性转化. 另据研究, 同时接受HBV和AFB1处理的树鼩与只用HBV处理或只用AFB1处理的树鼩相比, 前者肝癌的发生率(58.9%)明显高于HBV处理组(3.6%)和AFB1处理组(20.7%), 并且癌症发生的平均时间和恶性程度都要高于后两组, 说明HBV和AFB1在肝癌的发生中存在协同作用[21]. 这种作用可能是由于AFB1导致DNA氧化损伤和DSB的形成, 增加 HBV整合效率. 而HBV感染使细胞对AFB1的敏感性增高, 这种作用可能通过HBX实现: HBX能够调节代谢AFB1的酶活性, 在HBV转染的肝细胞中, 谷光甘肽(GST)的活性明显降低, 而GST是催化灭活AFB1的主要物质[22]; HBX还可以通过与蛋白质或蛋白质复合体的相互作用阻止损伤DNA的修复, 如前面提到的HBX能抑制NER修复通路, 导致化学致癌物如AFB1引起的DNA损伤累积; HBX还能诱导细胞增生和下调细胞周期停滞反应, 使诱变剂改变的肝细胞增生并发生恶性转化.
3 丙肝病毒(HCV)与肝癌的发生
HCV是RNA病毒, 不像HBV一样能整合到宿主DNA中直接引起DNA损伤, 但HCV能编码多种病毒蛋白, 如非结构蛋白5A, 2(NS5A, NS2), 核心蛋白等. 这些病毒蛋白能直接或间接影响宿主DNA的稳定性. 研究表明[23], NS5A能作用于中心粒和纺锤体, 引起延迟分裂和错误分裂, 导致染色体畸变. 核心蛋白和HBX一样, 能使宿主细胞抵抗氧化损伤, 使HCV感染的细胞逃脱免疫损伤, 也使癌变细胞得以存活[24]. 此外, HCV能直接引起细胞的氧化应激[25], 并能引发细胞持续的炎症反应和免疫反应, 直接或间接产生活性氧簇(ROS), 导致细胞DNA的氧化损伤, 包括嘌呤和嘧啶碱基化学性质的改变, 产生2-脱氧核糖, 碱基缺失和SSB, 形成8-羟基脱氧鸟苷(8-OHdG)赘合物等, 其中8-OHdG赘合物是最常见的致DNA氧化损伤物(每个细胞每天大约能产生200个此类赘合物)[26]. 体外研究证明, 8-OHdG能导致DNA聚合酶读码错误, 诱导基因突变, 并在DNA复制时诱导G: C→T: A突变, 这种突变在癌基因和抑癌基因中发生率较高[27], 这可能是HCV诱发肝癌的一种机制. 另外, 病毒蛋白导致的DNA氧化损伤主要由PARP-1介导的BER完成修复[28], 可以推测, HCV导致肝癌的机制可能是病毒蛋白引起BER修复功能障碍, 使DNA损伤累积, 引起细胞癌变, 其作用的主要分子可能就是PARP-1.
4 AFB1与肝癌发生
AFB1是另一种诱导肝癌发生的危险因素, AFB1在体内转化为活性AFB1-8, 9-环氧化物, 此化合物能高亲合力结合DNA鸟嘌呤的N7位点, 形成AFB1-N7-Gua复合物, AFB1-N7-Gua能自发变为更稳定的AFB1-FAPY, 这两种物质都能引起结合位点的G→T突变和5'端突变[29], AFB1在体内主要与谷胱甘肽(GST)结合成共价化合物而灭活. 实验证明, 经过AFB1处理的小鼠肺细胞, UV诱导的DNA损伤修复被抑制, 说明AFB1能下调或抑制在NER中起限速作用的酶或蛋白质的活性[30]. 由于AFB1引起的DNA不能被NER修复, 导致损伤DNA累积, 引起细胞恶性转化. 因此, 不同生物对AFB1的灭活能力以及对损伤的修复能力是决定生物对AFB1敏感性的重要机制. 另外, 新生小鼠和P53缺乏的成年鼠的肝细胞对AFB1的敏感性要高于正常成年鼠[31], 这两种小鼠都有肝细胞的增生, 因此, 增生的不成熟肝细胞也是导致小鼠对化学致癌物敏感的重要机制. 还有实验证明, AFB1能诱导P53基因第249位密码子的点突变(AGG→AGT), 导致P53蛋白中丝氨酸替代原来的精氨酸, 突变的P53蛋白可能阻止细胞从G1期进入S期[32]. 也有实验表明, P53第 249位密码子的点突变与P53+/-在诱导肝癌发生的效果上是相同的[31].
5 其他因素与肝癌的发生
研究表明, 过量饮酒以及各种化学物质如亚硝胺等也能导致肝癌的发生. 过量饮酒能导致脂肪肝的形成, 引起肝细胞脂质过氧化反应(LPO)和脂肪变性. LPO的代谢产物如反式4-羟基-2壬烯醇(HNE), 丙二醛(MDA)等能与DNA形成赘合物引起细胞DNA的损伤[33]. HNE-脱氧鸟苷(HNE-dG)赘合物能结合P53基因第249位密码子的第3个碱基, 引起碱基突变[34]. Feng et al[35]发现, 接受HNE处理的人体细胞不能修复UV介导的DNA损伤, 说明HNE能抑制NER的修复通路, 而NER也是修复HNE导致的DNA损伤的主要通路. 这样, 损伤DNA的累积就成为HNE等LPO产物诱导肝癌发生的重要机制. 实验证明[36], 单纯患有脂肪肝的FLS鼠系可自发肝癌, 这与肝细胞脂肪变性有关, 这可能是非酒精性脂肪肝引发肝癌的重要机制. 此外, 过量饮酒还能导致机体的氧化应激, 引起细胞DNA的氧化损伤[26]. 化学致癌物如亚硝胺能形成DNA-致癌因子赘合物, 还能诱导DNA双链改变, 如碱基氧化损伤, SSB, DSB, 染色体畸变, DAN-蛋白质交连等, 这是致癌物如二乙基亚硝胺(DEN)导致DNA损伤的最初形式[37]. DEN在体内氧化代谢并分解为高活性的烷化剂, 这些亲电子体能攻击DNA链的亲质子中心如鸟嘌呤的N7和O6位点, 形成烷化DNA赘合物, 复制这种烷化DNA能引起位点处的G: C突变, 激活原癌基因[38]. Iwai et al[39]研究表明, 经过DEN处理的FLS鼠系肝癌发生率要明显高于C3H和C57鼠系, 说明FLS鼠系对DEN的致癌敏感性要高于C3H和C57鼠系, 其机制可能是脂肪肝引起的LPO消耗了大量的GSH, 产生的代谢物如HNE又抑制NER修复系统, 脂肪变性引起许多细胞器如内质网、线粒体的功能障碍, 这些都加重了DEN引起的DNA损伤, 使损伤累积导致细胞恶性转化.
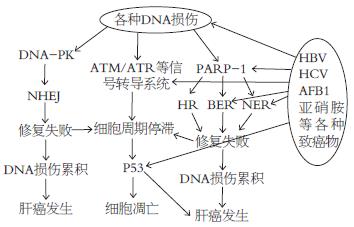
总之, 各种诱因如HBV, HCV, AFB1等都可能引起肝细胞DNA损伤, DNA损伤后引发机体一系列的反应, 包括损伤信号转导, 损伤修复和P53介导的细胞凋亡. 这些诱因诱导肝癌发生的机制就是作用于此系统中的某些环节, 或影响信号转导, 或影响损伤修复, 或影响P53介导的细胞凋亡通路(图1). 如HBV, HBV整合到宿主细胞时, 会引起整合处的基因重排和/或碱基缺失, 以及HBV感染引发机体持续的免疫反应都会导致DNA损伤; 而HBV编码的HBX蛋白则会影响信号转导系统, 降低DNA损伤修复功能, 同时HBX还可以与P53相互作用, 影响P53的一系列功能, 最终会导致DNA损伤的累积和细胞的恶性转化. 但是, 仍有许多问题未得到完全阐明, 如已证明HBX在HBV诱导的肝癌中起重要作用, 而HBV引起的DNA损伤主要由PARP-1介导的BER修复通路完成. 因此, 可以推测作为致癌因素的HBX和抗癌因素的PARP-1之间是否存在相互作用, 以及这种作用在HBV诱导肝癌发生的重要性. 随着各种先进技术的应用以及更多动物模型的建立, 肝癌发生的确切机制将会被完全阐明. 针对肝癌发生机制重要分子的靶向治疗, 也会使治疗更有效, 更安全, 细胞特异性也会更强, 如PAPR-1抑制剂作为抗肿瘤药物的研究取得显著效果, 目前已投入临床试用, 相信随着肝癌的研究进展, 以后还会应用更多的靶向治疗达到完全治愈肝癌的效果.
图1 HBV, HCV, ABF1等各种损伤物质诱导肝癌发生机制.
评论
背景资料
肝癌是人类常见的恶性肿瘤之一, 各种致癌因素如乙、丙肝病毒(HBV, HCV), 黄曲霉毒素, 电离辐射, 烷化剂等引起肝癌的具体机制尚未完全阐明, 但都与DNA的损伤有关. 近年来, 通过深入和广泛的研究, 这些因素引起DNA损伤从而导致肝癌发生的机制已得到一定程度的阐明. 这大大促进了临床靶向治疗肝癌的研究.
研发前沿
乙肝病毒X蛋白(HBX)在HBV诱导肝癌发生的过程中起了关键作用, 通过研发灭活HBX的特异性抑制剂, 有望成为预防HBV导致肝癌的新手段. 另外, HBV诱发肝癌是否也涉及到防止细胞恶性转化的重要分子PARP-1, 都需要进一步的研究.
相关报道
国外研究表明HBV、HCV, 饮酒等可以引起机体的氧化应激, 而氧化应激可以诱发DNA损伤, 从而引起肝癌的发生. 还有文献从分子水平研究阐明了修复DNA损伤的四条主要通路的机制, 以及这四条修复通路与癌症发生的关系.
创新盘点
本文综述了国内外对乙、丙肝病毒(HBV, HCV), 黄曲霉毒素, 电离辐射, 烷化剂等各种致癌因素引起肝癌的最新进展, 围绕DNA损伤, 在分子水平上阐述这些因子通过不同的机制引起损伤累积, 最终导致肝细胞恶性转化的主要机制.
应用要点
本文能使广大读者能及时了解国内外肝癌发生机制的研究现状, 也为进一步的实验研究和临床研发新的靶向治疗药物提供理论依据.
名词解释
1聚腺苷酸二磷酸核糠转移酶-1(PARP-1):PARP-1是一种分子量为116ku的核酶, 他包括三个主要的结构域:N-末端的DNA结合域, 中间的自身修饰域, C-末端的催化域.2依赖DNA的蛋白激酶(DNA-PK):DNA-PK是非同源末端连接(NHEJ)修复系统中的重要组成部分, 由一个催化亚基(DNA-PKcs)和一个DNA结合亚基Ku70/Ku80组成, 催化亚基具有蛋白激酶活性, 能够磷酸化多种蛋白.3ATM/ATR:运失调性毛细血管扩张症基因突变体(ataxiatelangiectasia, mutated, ATM)/运失调性毛细血管扩张症基因突变体和Rad相关基因(ATM-andRad3-related, ATR), 他们和DNA-PK都属于PI-3激酶超家族, 具有丝/苏氨酸蛋白激酶活性, 但没有脂酶活性.
同行评价
本综述有一定的可读性, 能较好地反映我国甚至国际胃肠病学临床和基础研究的水平, 是一篇较好的文章.