修回日期: 2007-01-01
接受日期: 2007-01-10
在线出版日期: 2007-05-28
目的: 探讨氧化苦参碱(oxymatrine, OM)对人胃癌细胞株MKN45的杀伤作用及其抗肿瘤作用的机制.
方法: 培养人胃癌MKN45细胞, 以0.5, 1, 2, 4, 6 g/L OM处理. 采用四唑蓝(MTT)比色法、流式细胞仪、聚合酶链反应(PCR), 酶联免疫吸附测定(ELISA)和RT-PCR法检测OM对MKN45细胞的杀伤作用、细胞周期分布、端粒酶活性和端粒酶逆转录酶(hTERT)及其上游调控基因(c-myc, p53, mad1)表达的影响.
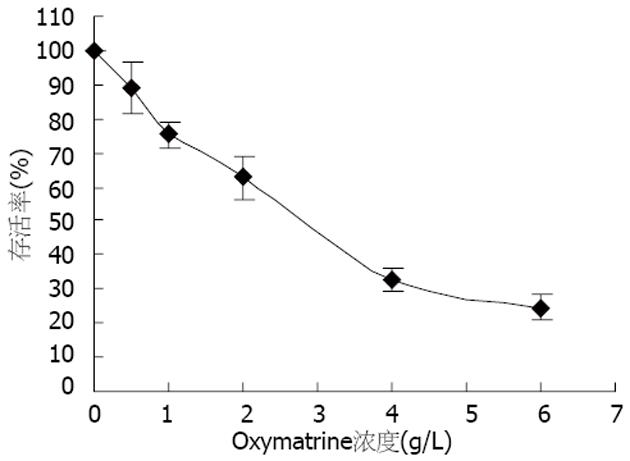
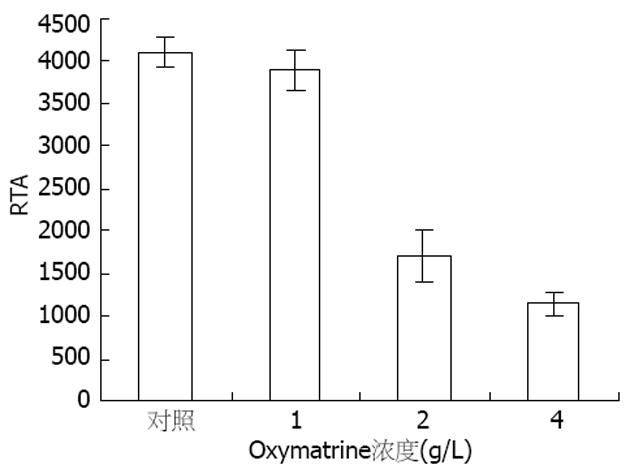
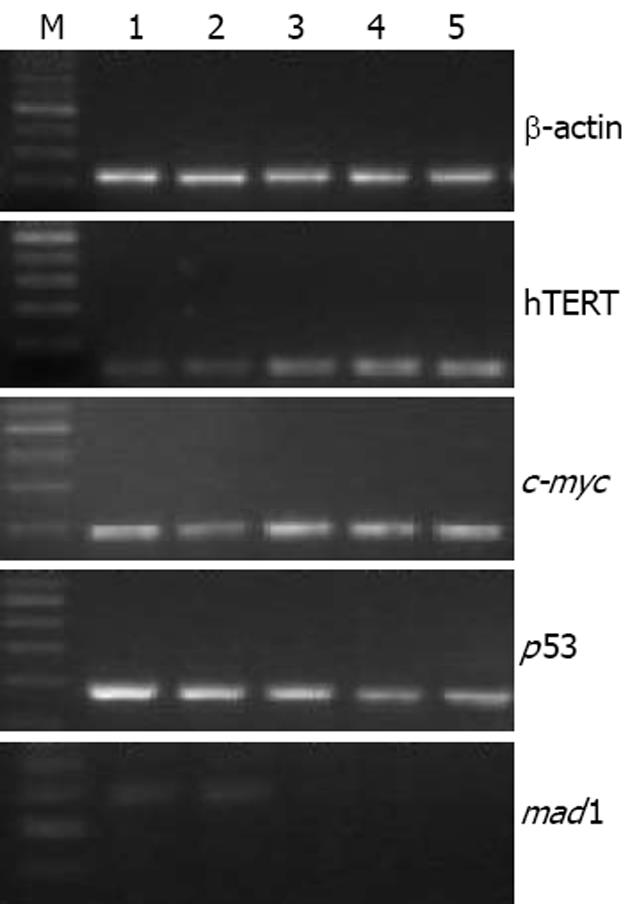
结果: OM对MKN45细胞具有剂量依赖性杀伤作用, 半数抑制浓度(IC50)78 g/L. OM作用48 h后, 与对照组相比, 在2 g/L剂量组, MKN45 G0/G1期细胞增加(62.2%±1.3% vs 56.7%±4.0%, P<0.05)、G2/M期细胞减少(5.4%±1.1% vs 10.0%±2.8%, P<0.05); 在4 g/L剂量组, S期细胞减少(30.5%±1.3% vs 33.4%±1.2%, P<0.05). OM可抑制MKN45细胞的端粒酶活性, 其作用呈剂量依赖性. OM可引起MKN45细胞hTERT基因表达下调, p53和mad1基因的表达升高, 对c-myc基因的表达无影响.
结论: OM对人胃癌细胞株MKN45具有杀伤作用, 可能通过影响hTERT及其上游调控基因的表达来抑制肿瘤细胞端粒酶活性, 发挥其抗肿瘤作用.
引文著录: 于晓峰, 邹健, 冉志华. 氧化苦参碱对人胃癌细胞杀伤作用的机制. 世界华人消化杂志 2007; 15(15): 1719-1724
Revised: January 1, 2007
Accepted: January 10, 2007
Published online: May 28, 2007
AIM: To explore the killing effects of oxymatrine (OM) on human gastric cancer cell line MKN45 and its anti-neoplastic mechanism.
METHODS: Human gastric cancer cell line MKN45 was cultured and then treated with 0.5, 1, 2, 4 and 6 g/L OM. Methylthiazolyl tetrazolium analysis (MTT) was used to observe the killing effect of OM on MKN45 cells. Cell cycle distribution was measured by flow cytometry. The activity of telomerase was detected by polymerase chain reaction (PCR)-enzyme linked immunosorbent assay (ELISA). Reverse transcription (RT)-PCR was employed to examine the expression of hTERT, c-myc, p53 and mad1 genes in MKN45 cells.
RESULTS: OM exhibited dose-dependent killing effects on MKN45 cells and its IC50 was 2.78 g/L. After administration for 48 hours, OM induced an increase of G1/G0-phase cells (62.2% ± 1.3% vs 56.7% ± 4.0%, P < 0.05) and decrease of G2/M-phase cells (5.4% ± 1.1% vs 10.0% ± 2.8%, P < 0.05) at a dose of 2 g/L, and a decrease of S-phase cells (30.5% ± 1.3% vs 33.4% ± 1.2%, P < 0.05) at a dose of 4 g/L. OM inhibited the activity of telomerase in MKN45 cells in a dose-dependent manner. The expression of hTERT gene in MKN45 cells was decreased, but the expression of p53 and mad1 genes were increased. However, and c-myc gene expression had no apparent changes.
CONCLUSION: OM has dose-dependent killing effects on MKN45 cells, and it can inhibit the telomerase activity through hTERT gene and the up-stream regulation genes.
- Citation: Yu XF, Zou J, Ran ZH. Killing effect of oxymatrine on human gastric cancer cell line MKN45 and its mechanism. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1719-1724
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1719.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1719
氧化苦参碱(oxymatrine, OM)是从我国传统中药苦豆子中提取的一种生物碱, 具有抗乙型和丙型肝炎病毒、改善肝细胞功能、抗肝纤维化、免疫调节、抗炎、抗肿瘤、抗过敏反应、抗心律失常、强心、降压、平喘等多种生物活性[1-4]. 目前临床上主要用于慢性乙型和丙型肝炎的治疗. 近年来, 有研究显示OM也具有杀伤肿瘤细胞的作用[5]. 本研究通过MTT比色法观察OM对体外培养胃癌细胞株MKN45的杀伤作用, 并检测其对肿瘤端粒酶活性和端粒酶上游调控基因的影响, 进一步探讨OM抗肿瘤作用的机制, 为其应用于临床肿瘤治疗奠定理论基础.
人胃癌细胞株MKN45细胞为仁济医院消化疾病研究所保存. 端粒酶检测试剂盒(TeloTAGGGTelomerase PCR ELISAPLUS)购自Roche Molecular Biochemicals. OM购自华美生物公司. 细胞培养基为含100 mL/L胎牛血清的RPMI-1640 (Gibco BRL)完全培养液, 细胞置于含50 mL/L CO2、950 mL/L空气的CO2孵箱中, 在37℃, 950 mL/L湿度条件下培养. OM由新鲜配制的培养液配成不同浓度.
1.2.1 四唑蓝(MTT)比色法检测OM对MKN45细胞的杀伤作用: 取对数生长期的MKN45细胞, 将5×107细胞/L的单细胞悬液按100 µL/孔分别接种铺96孔培养板, 24 h后加入新鲜配制的含0.5, 1, 2, 4, 6 g/L OM的培养液, 每孔100 µL, 每一浓度设3个复孔, 对照组加入等量的RPMI-1640培养液. 48 h后, 每孔加入5 g/L噻唑蓝(Sigma)溶液20 µL继续培养4 h, 吸去培养上清液, 按100 µL/孔加入二甲亚砜(DMSO), 避光室温下充分振荡20 min. 在酶联免疫检测仪(Microplate Reader, Model 550, Bio Rad)上测定各孔光吸收值, 计算细胞存活率(存活率 = 处理孔平均光吸收值/对照孔平均光吸收值×100%). 取3次实验数据的平均值.
1.2.2 流式细胞仪检测OM对MKN45细胞周期分布的影响: MKN45细胞按1×107细胞/L、每瓶5 mL接种于25 cm2培养瓶, 24 h后分别加入终浓度为1, 2和4 g/L的OM, 对照组加入等量的RPMI-1640培养液. 作用48 h后, 2.5 g/L胰蛋白酶消化收集各组细胞, PBS洗2次, 每次4℃ 800 g离心5 min. 去上清液后加入4℃ PBS 0.5 mL, 充分混匀悬浮细胞, 计数制成约1×109细胞/L×1 mL单细胞悬液. 在振荡器上缓慢加入预冷的950 mL/L 乙醇2 mL, 充分摇匀. 固定细胞用PBS洗2次, 加入RNA酶A(上海Sangon) 105 U/L, 37℃水浴摇床30 min, 10 mg/L含Triton X-100的碘化丙啶(PI Sigma)染色, 4℃避光30 min. 尼龙网过滤, 流式细胞仪(Epics XL, Coulter)上样检测. 本实验重
复3次.
1.2.3 PCR-ELISA检测OM对MKN45细胞端粒酶活性的影响: 按照试剂盒说明书所述步骤操作: 将2×105 MKN45细胞接种于25 cm2培养瓶, 24 h后分别加入终浓度为1, 2和4 g/L的OM, 对照组加入等量的RPMI-1640培养液, OM作用48 h后收获并记数细胞. 将2×105细胞/样品移入Eppendorf管, 4℃ 3000 g离心5 min, PBS洗涤1次. 加入200 µL裂解液, 重新悬浮细胞团并反复吹打5次, 置于冰上孵育30 min. 4℃ 16 000 g离心裂解液20 min, 将上清液移入另一Eppendorf管中, 进行端粒重复序列扩增协议(TRAP)反应. 在每管待测样品和控制模板中加入25 µL反应混合液和5 µL内参照(IS), 转移30 µL混合母液于每个PCR管中. 样品: 每管加入2 µL细胞提取物; 阴性对照: 每管加入2 µL热处理过的细胞提取物; 控制模板: 吸取1 µL控制模板和1 µL裂解液置于两个管中. 加入无核酸酶的水至总体积为50 µL. PCR反应条件: 引物延伸25℃ 10-30 min, 端粒酶灭活94℃ 5 min, 变性94℃ 30 s, 退火50℃ 30 s, 延伸72℃ 90 s, 30个循环, 最后72℃ 10 min. 再分别吸取10 µL变性液于2个反应管中, 每管加入2.5 µL扩增产物, 室温孵育10 min. 一管加入100 µL杂交样品缓冲液, 另一管加入100 µL杂交内参照缓冲液, 彻底混匀. 每孔加入100 µL混合物于预铺抗生蛋白链菌素的96孔板中. 盖上覆膜, 将板置于37℃摇床300 r/min摇匀2 h. 移去杂交液, 每孔250 µL清洗缓冲液洗涤3次, 每次至少30 s. 每孔加入100 µL结合辣根过氧化物酶的抗地高辛抗体工作液, 盖上覆膜, 室温孵育30 min, 同时300 r/min速度摇板. 移去溶液, 每孔250 µL清洗缓冲液洗涤5次, 每次至少30 s, 然后移去清洗缓冲液. 每孔加入100 µL四甲基联苯胺(TMB)底物溶液, 盖上覆膜, 室温孵育10-20 min, 同时300 r/min速度摇板. 保留反应液, 每孔加入100 µL终止液. 酶标仪读板, 测量样品在450 nm和690 nm的光吸收值. PCR-ELISA检测结果以相对端粒酶活性(relative telomerase activities, RTA)表示:(AS: 样品光吸收值; AS0: 样品阴性对照光吸收值; AS,IS: 样品内参照光吸收值; ATS8: 控制模板光吸收值; ATS8,0: 裂解液光吸收值; ATS8,IS: 控制模板内参照光吸收值)
1.2.4 RT-PCR检测OM对MKN45细胞端粒酶逆转录酶及其上游调控基因表达的影响: MKN45细胞按1×107细胞/L、每瓶5 mL接种于25 cm2培养瓶. 培养24 h后分别加入终浓度为1, 2, 4和6 g/L的OM, 对照组加入等量的RPMI-1640培养液, OM作用48 h后收取细胞, 吸去上清液, PBS洗3次. 细胞总RNA的抽提采用TRIzol试剂(Gibco BRL), 根据说明书操作. 每瓶细胞加入1 mL TRIzol, 吸取细胞裂解液转入Eppendorf管, 加入200 µL氯仿, 混匀后置室温5 min, 4℃, 12 000 g离心15 min. 吸取上层水相至新Eppendorf管, 加入0.5 mL异丙醇, 混匀, 4℃, 12 000 g离心10 min使RNA沉淀, 倾去上清液, 750 mL/L乙醇洗涤, 真空干燥15 min. 加入50 µL无RNA酶的去离子水, 重新溶解RNA, 紫外/可见分光光度计(Ultraspec 2000型, Pharmacia Biotech)测定RNA浓度. RNA产物置-70℃冰箱保存备用. 提取的RNA经分光光度计检测的A260/A280值为1.8-2.0, 从电泳结果来看, 其18S和28S条带都很清晰, 亮度比约为2∶1, 说明总RNA纯度基本达到实验要求且无明显降解.
根据Genbank中的基因序列, 采用Primer3.0引物设计软件, 由计算机辅助设计, 并由上海Sangon公司分别合成针对c-myc, p53, mad1, hTERT, β-actin的PCR扩增引物(表1).
| 基因 | 引物序列 | PCR扩增片段(bp) |
| β-actin | 5'-GGAGTCCTGTGGCATCCACG-3' | 322 |
| 5'-CTAGAAGCATTTGCGGTGGA-3' | ||
| c-myc | 5'-CCAACAGGAGCTATGACCTC-3' | 290 |
| 5'-CTCGGTCACCATCTCCAGCT-3' | ||
| p53 | 5'-CAGCCAAGTCTGTGACTTGCACGTAC-3' | 292 |
| 5'-CTATGTCGAAAAGTGTTTCTGTCATC-3' | ||
| mad1 | 5'-AAGACCTGGGGGAAAACACC-3' | 719 |
| 5'-ACAATCGCTGCATCCTGC-3' | ||
| hTERT | 5'-CGGAAGAGTGTCTGGAGCAA-3' | 154 |
| 5'-GGATGAAGCGGAGTCTGGA-3' |
按二步法进行RT-PCR反应, 先将mRNA反转录为cDNA, 然后再以cDNA为模板进行PCR扩增反应: 取1 µg总RNA样品+2 µL 10 mmol/L dNTPmix(上海Sangon)+2 μL Oligo(dT)18 (500 mg/L)(上海Sangon), 加入DEPC水至12 µL, 70℃水浴5 min, 迅速转移至冰浴2 min, 快速离心后加入首链cDNA合成缓冲液5 µL+DEPC水6 µL +1 µL RNA抑制剂(4×107 U/L)(华美公司)混合后置42℃水浴2 min, 再加入M-MLV逆转录酶1 µL(200 U), 混匀, 置42℃水浴50 min, 70℃水浴15 min终止反应. 产物置-20℃冰箱保存备用.
PCR扩增反应条件分别为: (1)β-actin: 94℃变性3 min, 经94℃ 30 s, 60℃ 1 min, 72℃ 1 min, 循环28次, 72℃延伸5 min; (2)c-myc: 94℃变性3 min, 经94℃ 30 s, 58℃ 1 min, 72℃ 1 min, 循环33次, 72℃延伸5 min; (3)p53: 94℃变性5 min, 经94℃ 30 s, 65℃ 1 min, 72℃ 1 min, 循环33次, 72℃延伸5 min; (4)mad1: 94℃变性5 min, 经94℃ 30 s, 64℃ 1 min, 72℃ 1 min, 循环35次, 72℃延伸5 min, (5)hTERT: 94℃变性5 min, 经94℃30 s, 54℃ 1 min, 72℃ 1 min, 循环35次, 72℃延伸5 min. 取5 µL PCR扩增产物加1 µL 6×上样缓冲液(300 mL/L甘油, 加溴酚蓝和二甲苯青染色)上样于含0.5 mg/L溴化乙锭的15 g/L琼脂糖凝胶中电泳, 在紫外线下生物电泳图像分析系统(FR-200型, 上海复日生物公司)上观察结果并照相. RT-PCR结果重复2-3次.
OM对MKN45细胞具有杀伤作用, 且呈现剂量依赖性. 5种浓度的OM作用48 h后, 随着OM浓度的升高, 细胞存活率显著降低. 在较低剂量组(<2 g/L), OM剂量依赖性杀伤作用不明显; 而在较高剂量组(>2 g/L), OM对MKN45细胞的杀伤作用显著增强, 细胞浮起、破碎、死亡等表现明显增多, 存活细胞增殖呈现停滞状态(图1). OM对MKN45细胞的半数抑制浓度(IC50)为2.78 g/L.
3种浓度的OM作用48 h后, 与对照组相比, 在2 g/L剂量组, MKN45 G0/G1期细胞增加、G2/M期细胞减少; 而在4 g/L剂量组, S期细胞减少, 与对照组相比差异有统计学意义(P<0.05, 表2).
1, 2和4 g/L 3种浓度的OM作用48 h后, MKN45细胞的端粒酶活性受到抑制, 其作用呈剂量依赖性. 端粒酶活性的抑制与作用剂量相关性较大: 1 g/L 剂量组与对照组相比, 端粒酶活性下降无差异; 而2 g/L和4 g/L剂量组与对照组相比, 下降幅度有统计学差异(P<0.01). 证明随着OM浓度的升高, MKN45细胞的端粒酶活性逐渐下降, 肿瘤生长受到抑制(图2).
1, 2, 4和6 g/L 4种浓度的OM作用48 h, 与对照组相比, MKN45细胞中hTERT基因在1 g/L组和2 g/L组表达无明显变化; 而在4 g/L组和6 g/L组表达下降. c-myc基因在4组中表达无变化. p53基因的表达随OM浓度的升高而逐渐增加. mad1基因在对照组、1 g/L组及2 g/L组中几乎无表达; 而在4 g/L组和6 g/L组有微弱的表达(图3).
我国是胃癌高发区, 其病死率男性为20.93/10万, 女性为10.16/10万, 死亡率占恶性肿瘤的第1位. 胃癌可发生于各年龄组, 以50-60岁居多, 男女发病率之比为3.2-3.6∶1. 在我国以山东、浙江、上海、福建等沿海地区为高发区. 胃癌已成为严重危害我国人民健康的一种疾病.
中草药是祖国医学理论中重要的组成部分, 几千年来为保障我国人民的健康做出了巨大的贡献. 由于中药与化学合成药物相比有着取材方便、价格低廉和毒副作用小等优点, 中药及其有效成分抗肿瘤的机制研究已成为当今医学研究的热点. 中药及其有效成分防治肿瘤是通过多靶点、多途径、多环节来实现的, 其抗肿瘤的作用机制主要包括调节机体免疫功能、抑制肿瘤血管生长、诱导肿瘤细胞凋亡、诱导肿瘤细胞分化、逆转肿瘤细胞多药耐药性、调节肿瘤细胞信号传导、抑制端粒酶活性和细胞毒作用等.
苦参碱型生物碱是一类具有苦参次碱-15-酮基本化学结构相似的化合物, 广泛存在于豆科植物苦参、苦豆子及广豆根中, 是这几种常用中草药的主要有效成分. 近年来已先后分离了不同的苦参碱型生物碱单体. 其中常用的有苦参碱、氧化苦参碱、槐定碱、苦豆碱、槐果碱、槐胺碱、槐醇碱、氧化槐果碱等. 而目前临床上应用最多及研究较深入的是苦参碱及氧化苦参碱. 人们在研究中发现他们有多方面的药理活性和临床功能, 因此近年来进一步开发和利用氧化苦参碱引起了人们广泛的兴趣.
苦参碱类具有多种生物活性, 其中他对于多种肿瘤细胞具有抑制作用. 有研究证实苦参碱可以抑制人红白血病细胞株K562细胞、人肝癌细胞株SMMC-7721细胞等的增殖[6-7]. 其机制可能是通过影响各种原癌基因的表达、激酶的活性、细胞因子的分泌、下调端粒酶活性等途径实现的[8-11]. 本研究发现OM对人胃癌细胞株MKN45具有剂量依赖性的杀伤作用, 这种杀伤作用是通过何种信号传导途径实现的还需要进一步研究证明.
近年来的研究表明: OM可以引起肿瘤细胞G1期细胞增多, S期细胞减少[6]. 但是也有相反的研究结果, 苦参碱对人肝癌细胞系SMMC-7721体外诱导分化研究发现, 苦参碱可使人肝癌细胞系SMMC-7721细胞增殖受到抑制, 细胞DNA含量降低, S期细胞数增加[7]. 本研究选择1, 2和4 g/L 3种浓度的OM观察其对人胃癌细胞株MKN45细胞周期的影响. 结果表明: OM作用48 h后, 在2 g/L剂量组, MKN45 G0/G1期细胞增加、G2/M期细胞减少; 而在4 g/L剂量组, S期细胞减少, 与对照组相比差异有统计学意义.
端粒酶是近年来发现的一种特殊的逆转录酶, 他的作用是在复制期(S期)的线性染色体末端添加TTAGGG重复片段, 以弥补染色体由于细胞分裂出现的末端进行性缩短, 而使细胞无限增殖, 导致肿瘤的发生和细胞的永生化. 人红白血病细胞株K562细胞经苦参碱作用后, 其端粒酶活性明显受抑, 且细胞周期明显改变, 提示苦参碱对K562细胞有诱导分化作用, 其机制可能与抑制端粒酶活性、阻止细胞周期的进程有关[11].
端粒酶由RNA成分即包括含合成端粒DNA模版的端粒酶RNA, 以及蛋白质水解成分, 即与病毒逆转录酶同源、介导RNA模板依赖的端粒DNA合成的端粒酶逆转录酶所组成. 端粒酶逆转录酶(hTERT)是合成端粒重复序列的主要成分, hTERT的活性决定了端粒酶的活性. 而hTERT活性的调节主要是通过转录水平的调节来实现[12-13]. 在hTERT基因的核心启动子中存在多个E-boxes和Sp1结合位点, c-myc与Max蛋白形成异二聚体和E-boxes结合, 激活hTERT的转录. Mad蛋白是c-myc的拮抗因子, 可以使已形成的Myc/Max二聚体转变为Mad/Max, 从而降低hTERT启动子的活性[14]. Sp1也是一种hTERT转录的关键因子, 可以和核心启动子中GC丰富位点结合. c-myc和Sp1是hTERT启动子完全激活所必需的[15]. 已有研究在多种肿瘤细胞株观察到: 过度表达的p53可通过降低hTERT的转录来有效抑制端粒酶活性. 而且这种效果独立于p53诱导的凋亡, 并与p53的靶基因P21蛋白的作用无关. p53可以和Sp1形成复合物阻止Sp1与hTERT核心启动子结合. 还有研究认为: Myc/Max和Mad/Max二聚体的比例决定hTERT启动子的活性[16]. 本实验证实OM能够下调人胃癌细胞株MKN45细胞端粒酶的活性, 这一作用是呈剂量依赖性的. OM干预后观察到MKN45细胞中p53基因的表达上调, 但是c-myc基因的表达没有发生改变. OM下调端粒酶逆转录酶的活性是其抗肿瘤作用的重要机制.
总之, 本实验表明OM对人胃癌细胞株MKN45具有杀伤作用, 可以使细胞阻止于G0/G1期, 降低S期细胞的比例. OM可能通过影响hTERT及其上游调控基因的表达(如增强p53及mad1的表达)来抑制肿瘤细胞端粒酶活性, 发挥其抗肿瘤作用. 本研究为OM应用于消化道肿瘤的化学预防及治疗作了有益的探讨.
中药是祖国医学理论中重要的组成部分, 几千年来为保障我国人民的机体健康做出了巨大的贡献. 近年来, 肿瘤的发病率不断增高, 逐渐成为人民健康的大敌. 由于中药与化学合成药物相比有着取材方便、价格低廉和毒副作用小等优点, 中药及其有效成分抗肿瘤的机制研究已成为当今医学研究的热点. 中药及其有效成分必将为人类和动物肿瘤的治疗开辟新的途径.
中药及其有效成分防治肿瘤是通过多靶点、多途径、多环节来实现的, 其抗肿瘤的作用机制及研究重点主要包括调节机体免疫功能、抑制肿瘤血管生长、诱导肿瘤细胞凋亡、诱导肿瘤细胞分化、逆转肿瘤细胞多重耐药性、调节肿瘤细胞信号传导、抑制端粒酶活性和细胞毒作用等. 但是, 当今对于肿瘤的防治还处于初级阶段, 肿瘤疾病不是任何一个单一方法、单一药物可以治愈的. 而且当前的抗癌中药的抗癌强度不够, 无论是复方还是单体, 都没有成为一线用药、首选用药, 只是在抗癌的辅助治疗上, 如缓解症状、减少毒性、调节免疫功能等方面具有较大的优势. 进一步研发具有较强抗肿瘤作用的中药是今后的主要方向.
本文探讨了不同浓度的氧化苦参碱对胃癌细胞株MKN45的杀伤作用及其机制. 结果显示OM对MKN45细胞具有剂量依赖性杀伤作用, 通过影响了细胞周期的改变, 抑制细胞的端粒酶活性, 引起细胞hTERT基因表达下调, p53和mad1基因的表达升高, 对c-myc基因的表达无影响. 提示可能通过影响hTERT及其上游调控基因的表达来抑制肿瘤细胞端粒酶活性, 发挥其抗肿瘤作用.
本实验表明OM对胃癌细胞具有杀伤作用, 可以使细胞阻止于G0/G1期, 降低S期细胞的比例. OM可能通过影响hTERT及其上游调控基因的表达(如增强p53及mad1的表达)来抑制肿瘤细胞端粒酶活性, 发挥其抗肿瘤作用. 将来可以将OM作为胃癌临床治疗的一种辅助用药, 加强抗肿瘤治疗的疗效.
1 苦参碱型生物碱: 是一类从豆科植物苦参、苦豆子及广豆根中提取的有效成分, 他具有苦参次碱-15-酮基本化学结构, 临床用于抗乙型和丙型肝炎病毒、改善肝细胞功能、抗肝纤维化、免疫调节、抗炎、抗肿瘤、抗过敏反应、抗心律失常、强心、降压、平´等.
2 端粒酶: 是一种逆转录酶, 主要作用是合成端粒末端重复序列TTAGGG, 而使细胞具有无限增殖的潜能.
大量文献已提示苦参生物碱类在许多细胞系,包括胃癌细胞系(SGC-7901), 能有效地抑制肿瘤细胞的增殖与转移; 同时促进肿瘤的凋亡并诱导分化, 且其作用机制是通过作用于一些凋亡相关基因,信号传导系统改变, 影响端粒酶活性等. 本文探讨了不同浓度的氧化苦参碱对胃癌细胞株MKN45的杀伤作用及其机制. 结果显示OM对MKN45细胞具有剂量依赖性杀伤作用, 通过影响了细胞周期的改变, 抑制细胞的端粒酶活性, 引起细胞hTERT基因表达下调, p53和mad1基因的表达升高, 对c-myc基因的表达无影响, 有一定创新.
电编:郭海丽 编辑:张焕兰
| 1. | Chen XS, Wang GJ, Cai X, Yu HY, Hu YP. Inhibition of hepatitis B virus by oxymatrine in vivo. World J Gastroenterol. 2001;7:49-52. [PubMed] [DOI] |
| 2. | Liu J, Manheimer E, Tsutani K, Gluud C. Medicinal herbs for hepatitis C virus infection: a Cochrane hepatobiliary systematic review of randomized trials. Am J Gastroenterol. 2003;98:538-544. [PubMed] [DOI] |
| 3. | Liu M, Liu XY, Cheng JF. Advance in the pharmacological research on matrine. Zhongguo Zhong Yao Za Zhi. 2003;28:801-804. [PubMed] |
| 4. | Zhang JP, Zhang M, Zhou JP, Liu FT, Zhou B, Xie WF, Guo C. Antifibrotic effects of matrine on in vitro and in vivo models of liver fibrosis in rats. Acta Pharmacol Sin. 2001;22:183-186. [PubMed] |
| 6. | Zhang LP, Jiang JK, Tam JW, Zhang Y, Liu XS, Xu XR, Liu BZ, He YJ. Effects of Matrine on proliferation and differentiation in K-562 cells. Leuk Res. 2001;25:793-800. [PubMed] [DOI] |
| 8. | He YJ, Jiang JK, Ou YH, Liu BZ, Liu XS, Zhang Y, Ma LD, Tu ZG. Matrine affects early expression of proto-oncogenes in K562 cells. Ai Zheng. 2002;21:369-372. [PubMed] |
| 9. | Liu BZ, Jiang JK, He YJ, Zhang Y, Liu XS. Effects of matrine on the activity of protein tyrosine kinase and phosphatase in K562 cells. Ai Zheng. 2002;21:1292-1295. [PubMed] |
| 10. | Lin W, Zhang JP, Hu ZL, Qian DH. Inhibitory effect of matrine on lipopolysacchride-induced tumor necrosis factor and interleukin-6 production from rat Kupffer cells. Yao Xue Xue Bao. 1997;32:93-96. [PubMed] |
| 11. | Zhang L, Jiang J, Tan R. Effects of matrine on telomerase activity and cell cycle in K562 cell. Zhonghua Zhong Liu Za Zhi. 1998;20:328-329. [PubMed] |
| 12. | Horikawa I, Cable PL, Afshari C, Barrett JC. Cloning and characterization of the promoter region of human telomerase reverse transcriptase gene. Cancer Res. 1999;59:826-830. [PubMed] |
| 13. | Takakura M, Kyo S, Kanaya T, Hirano H, Takeda J, Yutsudo M, Inoue M. Cloning of human telomerase catalytic subunit (hTERT) gene promoter and identification of proximal core promoter sequences essential for transcriptional activation in immortalized and cancer cells. Cancer Res. 1999;59:551-557. [PubMed] |
| 14. | Oh S, Song YH, Yim J, Kim TK. Identification of Mad as a repressor of the human telomerase (hTERT) gene. Oncogene. 2000;19:1485-1490. [PubMed] [DOI] |
| 15. | Kyo S, Takakura M, Taira T, Kanaya T, Itoh H, Yutsudo M, Ariga H, Inoue M. Sp1 cooperates with c-Myc to activate transcription of the human telomerase reverse transcriptase gene (hTERT). Nucleic Acids Res. 2000;28:669-677. [PubMed] [DOI] |