修回日期: 2007-03-15
接受日期: 2007-03-29
在线出版日期: 2007-05-28
目的: 在三硝基苯磺酸灌肠诱导大鼠实验性结肠炎模型中, 研究银杏天宝(EGB)的治疗作用及其抗氧化损伤作用的机制.
方法: 应用三硝基苯磺酸(TNBS)/乙醇灌肠制备大鼠实验性结肠炎模型. 实验设正常对照组, 三硝基苯磺酸模型组, 阳性药物对照组(5-ASA group, 100 mg/kg), EGB组(200 mg/kg) 4组. 观察大鼠肠组织大体形态和组织学评分. 生化法检测大鼠肠组织超氧化物歧化酶(SOD), 谷胱苷肽过氧化物酶(GSH-Px)活性及丙二醛(MDA), 一氧化氮(NO)含量. 免疫组化检测肠组织诱导型一氧化氮合酶(iNOS)蛋白的表达.
结果: 与模型组相比, EGB组结肠组织iNOS表达明显减少, NO、MDA明显降低(iNOS: 19.60%±3.17% vs 81.36%±1.71%; NO: 9.20±0.81 μmol/g vs 14.77±1.34 μmol/g; MDA: 3.96±0.35 μmol/g vs 6.06±0.39 μmol/g; P<0.01); SOD、GSH-Px活性明显升高(SOD: 32.52±1.82 kU/g vs 21.90±2.22 kU/g; GSH-Px: 49.91±2.59 kU/g vs 41.26±2.90 kU/g; P<0.01). EGB能明显减少大鼠实验性结肠炎模型组大体形态和组织学评分(2.10±0.57 vs 3.10±0.57; 3.50±0.85 vs 4.7±0.82; P<0.01).
结论: EGB可能通过抑制氧自由基反应, 抗氧化损伤, 抑制NO生成, 来减轻结肠炎炎症反应.
引文著录: 周燕红, 于皆平. 银杏天宝对大鼠实验性结肠炎抗氧化作用的影响. 世界华人消化杂志 2007; 15(15): 1701-1705
Revised: March 15, 2007
Accepted: March 29, 2007
Published online: May 28, 2007
AIM: To investigate the therapeutic effect and antioxidation mechanism of Ginkgo biloba extract (EGB) in rats with ulcerative colitis induced by 2, 4, 6-trinitrobenzene sulfonic acid (TNBS).
METHODS: Rat model of ulcerative colitis was induced by 2, 4, 6-trinitrobenzene sulfonic acid (150 mg/kg) with ethanol. The experimental animals were randomly divided into 4 groups: normal group, model group, 5-aminosalicylic acid (5-ASA, 100 mg/kg) group, EGB (200 mg/kg) group. The macroscopic and histological damages were evaluated. The contents of malondiadehyde (MDA), nitric oxide (NO), superoxide dismutase (SOD), and glutathion peroxide (GSH-Px) were measured by biochemical methods. The expression of inducible nitric oxide synthase (iNOS) in the colon tissues was detected by immunchistochemistry.
RESULTS: The expression of iNOS (19.60% ± 3.17% vs 81.36% ± 1.71%), the tissue contents of NO (9.20 ± 0.81 μmol/g vs 14.77 ± 1.34 μmol/g, P < 0.01) and MDA (3.96 ± 0.35 μmol/g vs 6.06 ± 0.39 μmol/g, P < 0.01) in EGB group were obviously lower than those in model group, but the activities of SOD and GSH-Px of colon tissues in EGB group were significantly higher (SOD: 32.52 ± 1.82 kU/g vs 21.90 ± 2.22 kU/g; GSH-Px: 49.91 ± 2.59 kU/g vs 41.26 ± 2.90 kU/g; P < 0.01). EGB also notably reduced the macroscopic and histological scores of colon tissues (2.10 ± 0.57 vs 3.10 ± 0.57; 3.50 ± 0.85 vs 4.7 ± 0.82; both P < 0.01).
CONCLUSION: EGB can alleviate the inflammatory reactions in colitis through inhibiting oxygen free radical reaction, exerting antioxidation effects and decreasing the production of NO.
- Citation: Zhou YH, Yu JP. Effects of Ginkgo biloba extract on the antioxidation in rats with TNBS-induced colitis. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1701-1705
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1701.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1701
溃疡性结肠炎(ulcerative colitis, UC)的发病机制是复杂的、多环节、多因素共同作用的结果. 大量实验证明炎症和自由基及其引起的脂质过氧化反应在UC发病中有重要作用, 抗炎及抗氧化能减轻UC的炎性损伤[1-3]. 银杏天宝(Ginkgo biloba extract, EGB)是从银杏叶中提取的化合物, 主要活性成分为240 g/L黄酮糖苷和60 g/L萜内酯, 有清除自由基和过氧化脂质、调节循环系统、改善血液循环、拮抗血小板活化因子、保护组织等作用[4-5]. 临床已广泛用于心脑血管疾病的治疗, 但是EGB对UC影响的报道甚少[6]. 我们在本课题组前期研究[7]的基础上, 进一步观察EGB对大鼠实验性结肠炎抗氧化作用的影响, 探讨EGB防治UC的可能性及作用机制.
♂Wistar大鼠40只, 体质量为180±20 g, 购自湖北省实验动物中心; 2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)购自Sigma公司; 银杏天宝为贵州信邦制药股份有限公司提供; 一氧化氮(NO), 超氧化物歧化酶(SOD), 丙二醛(MDA), 谷胱苷肽过氧化物酶(GSH-Px)试剂盒购于南京建成生物工程公司; 诱导型一氧化氮合酶(iNOS)多克隆抗体购自Santa Cruz公司; SP试剂盒为北京中山生物制品公司产品.
动物随机分为正常对照组(normal group), 三硝基苯磺酸模型组(model group), 阳性药物对照组(5-aminosalicylic acid, 5-ASA group), EGB组(EGB group)4组, 每组10只. 动物饲养温度为20-27℃, 湿度为40%-70%, 12 h暗12 h明, 自由饮水和取食. 造模前大鼠禁食不禁水24 h. 正常对照组以500 mL/L乙醇灌肠, 其他组均以TNBS灌肠诱导实验性结肠炎形成. 按Morris et al[8]方法造模, 乙醚麻醉后, 取仰卧位, 插入直径2 mm的聚乙烯纤维导管至直肠内, TNBS(150 mg/kg)溶解于500 mL/L乙醇溶液缓慢推入结肠, 保留15 s后再注入生理盐水3-5 mL冲洗2次. 造模24 h后4组分别予以生理盐水2 mL, 5-ASA 100 mg/kg, EGB 200 mg/kg灌胃治疗, 1次/d连续4 wk. 4 wk后处死大鼠, 分离结肠, 沿肠系膜纵轴剪开, 冷生理盐水冲洗干净, 立即参照Morris et al[8]标准进行肉眼大体形态损伤评分. 于炎症或溃疡处取肠组织一部分, 置40 g/L甲醛中固定, 常规石蜡包理、HE染色, 参照文献[8-9]镜下评价结肠组织学损伤评分.
1.2.1 肠组织NO, SOD, MDA, GSH-Px的测定: 处死大鼠后, 取炎症改变最明显处的结肠黏膜组织, 用4℃生理盐水洗净, 称质量, 匀浆. NO, SOD, MDA, GSH-Px检测按照试剂盒说明书进行.
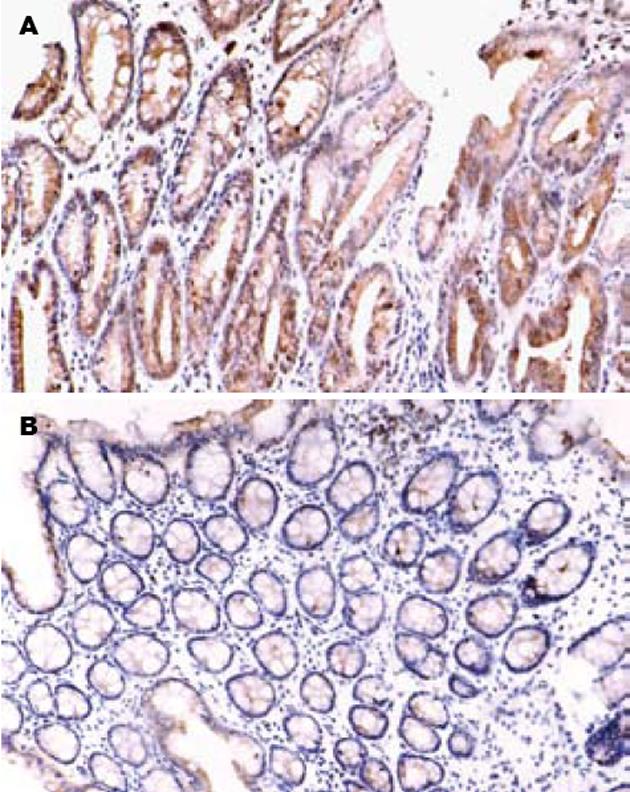
1.2.2 免疫组化检测肠组织iNOS表达: 操作按照SP免疫组化染色试剂盒说明书进行. 石蜡切片脱蜡至水, 室温孵育15 min, PBS洗15 min, 微波修复10 min, PBS洗15 min, 自然冷却, 封闭非特异性抗原, iNOS抗体稀释至1∶100, 37℃孵育1 h, PBS洗15 min, 生物素化二抗IgG抗体37℃孵育15 min, 辣根过氧化物酶标记的链霉素亲活素37℃孵育15 min, DAB显色, 自来水冲洗, 苏木素复染, 封片. PBS代替一抗作阴性对照. 结果判断: 细胞呈棕黄色为阳性, 表达于胞质. 每张切片计算任意10个高倍视野(200倍)中阳性细胞所占的百分比例.
统计学处理 实验数据以mean士SD表示, 采用SPSS11.5软件进行统计学分析, 两组间比较用单因素方差分析, 组间差异采用q检验. 以P<0.05为有统计学意义.
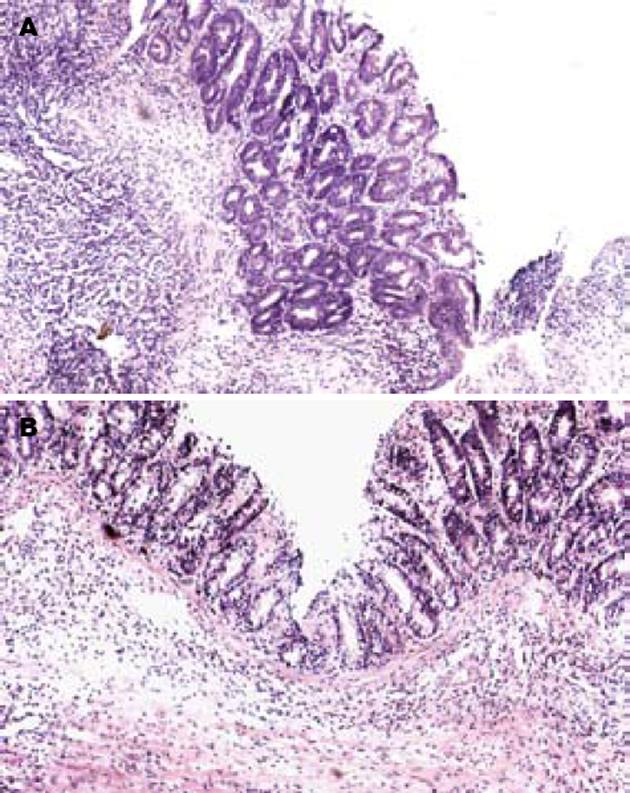
大体观察: 三硝基苯磺酸模型组肉眼观察到肠黏膜水肿、溃疡、点片状出血. EGB组及5-ASA组显著改善肠黏膜充血、水肿、糜烂(P<0.01, 表1). 组织学损伤评分: 光镜下见正常对照组黏膜上皮完整, 细胞形态正常, 杯状细胞可见, 腺体排列整齐. 三硝基苯磺酸模型组黏膜上皮坏死脱落, 炎症渗出, 肉芽组织增生, 典型溃疡形成, 黏膜下层及肌层水肿, 大量炎性细胞浸润, 杯状细胞减少、甚至消失. EGB组上皮细胞坏死轻, 溃疡小而浅, 大部分腺体结构保持完整, 排列稍紊乱, 炎性细胞浸润, 肠壁各层结构基本完整(P<0.01, 表1, 图1).
三硝基苯磺酸模型组NO, MDA较正常对照组明显增高, SOD, GSH-Px活性较正常对照组明显减少, 差异有显著性(P<0.01). EGB组和5-ASA组NO, MDA含量较模型组低, SOD, GSH-Px活性较模型组高, 差异有显著性(P<0.01), EGB组和5-ASA组差异有显著性(P<0.05, 表2), 表明EGB作用优于5-ASA.
| 分组 | NO(μmol/g) | SOD(kU/g) | MDA(μmol/g) | GSH-Px(kU/g) | iNOS(%) |
| 正常对照组 | 8.36±0.96b | 40.03±2.65b | 2.44±0.11b | 50.71±4.94b | 9.93±1.63b |
| 模型组 | 14.77±1.34 | 21.90±2.22 | 6.06±0.39 | 41.26±2.90 | 81.36±1.71 |
| 5-ASA组 | 10.51±1.54b | 30.44±1.06b | 4.31±0.37b | 48.78±1.60b | 35.23±5.38b |
| EGB组 | 9.20±0.81ab | 32.52±1.82ab | 3.96±0.35ab | 49.91±2.59ab | 19.60±3.17ab |
氧自由基(oxygen free radical, OFR)主要包括超氧阴离子自由基(O2-)和羟自由基(OH-)等. 生理情况下, 体内存在清除氧自由基的防御系统、包括抗氧化酶(SOD、GSH-Px)和抗氧化剂(维生素C, 维生素E, 类胡萝卜素). 当抗氧化系统削弱或OFR生成过度, 将导致组织和细胞的损伤. UC时, 肠黏膜中大量的吞噬细胞被激活, 耗氧量增加, 在黄嘌呤氧化酶、花生四烯酸作用下产生大量O2-. OFR与生物膜不饱和脂肪酸共价结合, 激发连锁反应, 在体内引起脂质过氧化反应, 对机体产生氧化损伤, 并分解出MDA, 使膜流动性降低、通透性增加、大量Ca2+内流, 通过花生四烯酸代谢, 形成具有高度生物活性的炎症介质(前列腺素、血栓素、白三烯等), 加重UC肠黏膜的损伤. SOD, GSH-Px是机体主要抗氧化酶, SOD歧化O2-形成的H2O2、ROOH分别与GSH在GSH-Px作用下形成H2O, RH和毒性较小的ROH起到清除自由基的作用, 其活力反映机体清除氧自由基的能力. MDA可间接反映细胞损伤程度. 本实验模型组肠组织中SOD, GSH-Px活力显著下降(P<0.01), 而MDA含量明显增高(P<0.01), 与文献[10-11]报道类似. 提示在UC发病过程中, 抗自由基酶活力下降, 脂质过氧化反应增强, 表明氧化应激及脂质过氧化、抗氧化能力下降与UC的发生有关.
以往研究表明UC患者病灶部肠黏膜组织NO合成增加, 一氧化氮合酶(NO synthase, NOS)活性增加, 且iNOS活性增加与炎症程度呈平行关系[12-13]. NO有两种类型, 即结构型(constitutive NO synthase, cNOS)和iNOS, cNOS生成NO量一般较少. 在UC结肠黏膜层以iNOS为主, iNOS催化精氨酸产生NO, NO在UC炎症过程中既有保护作用又有杀伤毒性和促炎的双重作用. 一方面作为一种抗氧化剂能穿入细胞膜阻止脂质过氧化和防止膜内维生素E的损耗, 保护机体对抗一些病理性损害; 另一方面在NO生成过程中, NO与O2-反应, 生成过氧亚硝酸阴离子, 使巯基蛋白和脂质氧化, 造成组织细胞损伤. 同时NO介导激活中性粒细胞和单核细胞, 使炎症反应进一步扩大. 这些自由基还可使SOD含量减少, 显著降低了SOD等抗氧化清除或降低自由基的能力, 加重UC的炎症反应和组织损伤. 本研究中, TNBS诱导大鼠实验性结肠炎中, iNOS蛋白阳性表达和NO含量明显增高, 可能系由iNOS诱导的NO释放增加所致.
UC治疗的传统药物为水杨酸类和激素, 尽管他们有多方面的抗炎功能, 但副作用大. 银杏天宝作为一种天然抗氧化剂, 其分子中含有还原性羟基功能基团, 可直接清除O2-, OH-, H2O2, 脂质自由基, 脂质过氧化自由基和烷自由基等, 终止自由基链锁反应, 从而阻止和抑制了氧自由基反应和脂质过氧化反应[4,14-15]. Pincemail et al[16]的研究表明EGB具有抗氧化离子的作用, 他不仅可以清除自由基, 而且具有超氧化物歧化酶的特征. EGB可参与调节和提高SOD, GSH-Px等抗氧化酶的活性, 从而加快了自由基的清除[17]. Liu et al[18]发现EGB因其抗氧化特性及抑制iNOS表达减少NO的产生对肠缺血再灌注损伤诱导的肺损伤大鼠起保护作用. 但EGB对UC中NO的作用尚无系统研究. 本研究免疫组化染色结果显示EGB治疗后iNOS表达较模型组明显下降, EGB组肠组织NO含量较模型组明显减低, 提示EGB可抑制结肠炎大鼠肠黏膜中iNOS表达而减少NO的产生.
总之, 本研究证实EGB能明显减少模型组大体形态和组织学评分, 有效地防止大鼠实验性结肠炎炎症发生及发展, 作用机制可能是通过降低大鼠实验性结肠炎MDA含量, 同时提高SOD、GSH-Px活性, 减轻氧自由基和脂质过氧化作用对肠组织的损伤, 减少iNOS的表达, 抑制NO的生成, 对大鼠实验性结肠炎起保护作用, 可为UC的防治提供理论依据, 但其临床应用尚有待进一步研究.
溃疡性结肠炎(ulcerative colitis, UC)病因和发病机制尚不清楚. 炎症和自由基及其引起的脂质过氧化反应在UC发病中有重要作用. 国内外UC发病率呈上升趋势, 但缺乏疗效好副作用少而行之有效的药物治疗. 近年来应用中药及天然植物有效成分治疗UC取得一定进展, 但其具体作用机制不明.
IBD的药物治疗包括水杨酸, 柳氮磺胺吡啶, 类固醇激素等, 但其副作用大, 停药后易复发. 随着免疫学和分子生物学的发展, 重组单克隆抗体, 反义寡核苷酸取得了较好的疗效, 但其价格昂贵, 安全性及远期疗效需进一步观察. 银杏天宝含有24%黄酮糖苷和6%萜内酯. 具有多种生物学效应和药理学作用, 能清除自由基、抗炎和调整免疫系统. 因其价廉无副作用临床上广泛用于治疗和炎症介质有关的多种疾病. 有望成为治疗溃疡性结肠炎的一种有效药物.
EGB对UC中NO的作用尚无系统研究. 本研究首次证实EGB可抑制结肠炎大鼠肠黏膜中iNOS表达而减少NO的产生. 减轻氧自由基和脂质过氧化作用对肠组织的损伤, 从而减轻大鼠实验性结肠炎炎症损伤.
本研究证实EGB能有效地防止大鼠实验性结肠炎炎症发生及发展, 对大鼠实验性结肠炎起保护作用, 可为UC的防治提供理论基础, 也为UC的临床治疗提供了新思路.
本文具有一定的临床意义, 为结肠炎的治疗提供了新思路.
电编: 张敏 编辑:张焕兰
| 1. | Nieto N, Torres MI, Fernandez MI, Giron MD, Rios A, Suarez MD, Gil A. Experimental ulcerative colitis impairs antioxidant defense system in rat intestine. Dig Dis Sci. 2000;45:1820-1827. [PubMed] [DOI] |
| 2. | Wendland BE, Aghdassi E, Tam C, Carrrier J, Steinhart AH, Wolman SL, Baron D, Allard JP. Lipid peroxidation and plasma antioxidant micronutrients in Crohn disease. Am J Clin Nutr. 2001;74:259-264. [PubMed] |
| 3. | Oz HS, Chen TS, McClain CJ, de Villiers WJ. Antioxidants as novel therapy in a murine model of colitis. J Nutr Biochem. 2005;16:297-304. [PubMed] [DOI] |
| 4. | Maitra I, Marcocci L, Droy-Lefaix MT, Packer L. Peroxyl radical scavenging activity of Ginkgo biloba extract EGb 761. Biochem Pharmacol. 1995;49:1649-1655. [PubMed] [DOI] |
| 5. | Kusmic C, Basta G, Lazzerini G, Vesentini N, Barsacchi R. The effect of Ginkgo biloba in isolated ischemic/reperfused rat heart: a link between vitamin E preservation and prostaglandin biosyn-thesis. J Cardiovasc Pharmacol. 2004;44:356-362. [PubMed] [DOI] |
| 6. | Mustafa A, El-Medany A, Hagar HH, El-Medany G. Ginkgo biloba attenuates mucosal damage in a rat model of ulcerative colitis. Pharmacol Res. 2006;53:324-330. [PubMed] [DOI] |
| 8. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] [DOI] |
| 9. | Mei Q, Yu JP, Xu JM, Wei W, Xiang L, Yue L. Melatonin reduces colon immunological injury in rats by regulating activity of macrophages. Acta Pharmacol Sin. 2002;23:882-886. [PubMed] |
| 10. | Girgin F, Karaoglu O, Erkus M, Tuzun S, Ozutemiz O, Dincer C, Batur Y, Tanyalcin T. Effects of trimetazidine on oxidant/antioxidant status in trinitrobenzenesulfonic acid-induced chronic colitis. J Toxicol Environ Health A. 2000;59:641-652. [PubMed] [DOI] |
| 11. | Verspaget HW, Pena AS, Weterman IT, Lamers CB. Diminished neutrophil function in Crohn's disease and ulcerative colitis identified by decreased oxidative metabolism and low superoxide dismutase content. Gut. 1988;29:223-228. [PubMed] [DOI] |
| 12. | Singer II, Kawka DW, Scott S, Weidner JR, Mumford RA, Riehl TE, Stenson WF. Expression of inducible nitric oxide synthase and nitrotyrosine in colonic epithelium in inflammatory bowel disease. Gastroenterology. 1996;111:871-885. [PubMed] [DOI] |
| 13. | Boughton-Smith NK, Evans SM, Hawkey CJ, Cole AT, Balsitis M, Whittle BJ, Moncada S. Nitric oxide synthase activity in ulcerative colitis and Crohn's disease. Lancet. 1993;342:338-340. [PubMed] [DOI] |
| 14. | Ozkur MK, Bozkurt MS, Balabanli B, Aricioglu A, Ilter N, Gurer MA, Inaloz HS. The effects of EGb 761 on lipid peroxide levels and superoxide dismutase activity in sunburn. Photodermatol Photoimmunol Photomed. 2002;18:117-120. [PubMed] [DOI] |
| 15. | Sakarcan A, Sehirli O, Velioglu-Ovunc A, Ercan F, Erkanl G, Gedik N, Sener G. Ginkgo biloba extract improves oxidative organ damage in a rat model of thermal trauma. J Burn Care Rehabil. 2005;26:515-524. [PubMed] [DOI] |
| 16. | Pincemail J, Dupuis M, Nasr C, Hans P, Haag-Berrurier M, Anton R, Deby C. Superoxide anion scavenging effect and superoxide dismutase activity of Ginkgo biloba extract. Experientia. 1989;45:708-712. [PubMed] [DOI] |
| 17. | Liu SQ, Yu JP, Chen HL, Luo HS, Chen SM, Yu HG. Therapeutic effects and molecular mechanisms of Ginkgo biloba extract on liver fibrosis in rats. Am J Chin Med. 2006;34:99-114. [PubMed] [DOI] |
| 18. | Liu KX, Wu WK, He W, Liu CL. Ginkgo biloba extract (EGb 761) attenuates lung injury induced by intestinal ischemia/reperfusion in rats: roles of oxidative stress and nitric oxide. World J Gastroenterol. 2007;13:299-305. [PubMed] [DOI] |