修回日期: 2007-04-01
接受日期: 2007-04-13
在线出版日期: 2007-05-28
目的: 通过HBV感染体外培养的人绒毛膜滋养层细胞, 探讨HBV宫内感染发生的机制.
方法: 对人早孕绒毛膜滋养层细胞进行原代培养和对人滋养层细胞系JEG-3进行传代培养, 将HBV感染血清与原代及传代培养细胞共同孵育8-48 h, 倒置显微镜观察细胞形态及细胞间连接, 细胞免疫荧光和免疫组织化学染色方法检测滋养层细胞中HBsAg和HBcAg的表达, 荧光定量PCR方法检测被感染的滋养层细胞中的HBV DNA, TUNEL方法检测滋养层细胞的凋亡.
结果: 与HBV阳性血清共同孵育对滋养层细胞的形态和细胞间连接无明显影响; 细胞免疫荧光和免疫组织化学染色结果显示, 滋养层细胞与HBV感染血清共同孵育(8, 24, 48 h)后, 滋养层细胞可以出现HBsAg和HBcAg的阳性表达, 24 h时HBsAg阳性细胞数量最多(8 h: 18.0%±3.67%; 24 h: 30.6%±2.88%; 48 h: 24.8%±4.21%); 荧光定量PCR方法检测到被感染的滋养层细胞中HBV DNA的存在; TUNEL结果显示, 与HBV感染血清共同孵育可导致滋养层凋亡细胞数量逐渐增加(24 h: 18.6 %±3.05%; 48 h: 26.8%±2.86%; P<0.01).
结论: 滋养层细胞的感染可能是HBV通过胎盘屏障的途径之一; HBV感染可以诱导滋养层细胞产生凋亡, 这可能是胎盘屏障阻止HBV宫内感染的一种保护性机制.
引文著录: 白菡, 张琳, 何丽霞, 冯国和, 石理兰, 窦晓光, 赵桂珍. 胎盘滋养层细胞的感染和凋亡与HBV的宫内传播机制. 世界华人消化杂志 2007; 15(15): 1695-1700
Revised: April 1, 2007
Accepted: April 13, 2007
Published online: May 28, 2007
AIM: To study the mechanism of hepatitis B virus (HBV) intrauterine transmission by infecting the cultured human trophoblastic cells in vitro.
METHODS: Primary cultured trophoblastic cells from human first-trimester placenta and serial subcultivation of JEG-3 cell line were investigated. The primary cultured and subcultured cells were cultured in the HBV-infected serum for 8 to 48 h. The appearance of the cells and intercellular conjunctions were observed under inverted microscope. The protein expression of HBsAg and HBcAg were detected by cell immunofluorescence and immunohistochemical staining. HBV DNA of the infected trophoblastic cells was detected by fluorescent quantitative polymerase chain reaction (FQ-PCR). Cell apoptosis was tested by TUNEL technique.
RESULTS: The appearance of the cells and intercellular conjunction were not obviously affected after co-culturing with HBV-positive serum. Cell immunofluorescence and immunohistochemistry showed that HBsAg and HBcAg can be detected in the trophoblastic cells after co-culturing with HBV-infected serum for 8, 24 and 48 h, and HBsAg-positive cells were at the most level after 24-h culturing (8 h: 18.0% ± 3.67%; 24 h: 30.6% ± 2.88%; 48 h: 24.8% ± 4.21%). FQ-PCR demonstrated the existence of HBV DNA in the infected cells. TUNEL exhibited that the co-culturing resulted in an increase of cell apoptosis (24 h: 18.6 % ± 3.05%; 48 h: 26.8% ± 2.86%; P < 0.01).
CONCLUSION: The infection of trophoblastic cells may be one of the routes for HBV passing through the placental membrane. HBV infection may induce the apoptosis of trophoblastic cells, which may be a protective mechanism for placental membrane to block up the vertical transmission of HBV.
- Citation: Bai H, Zhang L, He LX, Feng GH, Shi LL, Dou XG, Zhao GZ. Relationship between the infection and apoptosis of placental trophoblastic cells and the mechanism of hepatitis B virus intrauterine transmission. Shijie Huaren Xiaohua Zazhi 2007; 15(15): 1695-1700
- URL: https://www.wjgnet.com/1009-3079/full/v15/i15/1695.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i15.1695
母婴传播是我国乙型肝炎病毒感染的主要传播途径之一[1-3]. 母婴传播途径包括宫内传播、产时传播和产后传播. 其中宫内传播是导致新生儿发生乙肝疫苗免疫阻断失败, 成为慢性HBV感染者的主要原因[4-5]. 目前HBV宫内传播的机制仍不清楚, 胎盘组织在其中起重要作用. 在妊娠过程中, 滋养层细胞与母体血液直接接触, 是HBV通过胎盘屏障的第一步. 所以研究滋养层细胞的HBV感染, 对明确HBV的宫内传播机制很有意义[6-8]. 我们进行了HBV对体外培养的人绒毛膜滋养层细胞的感染试验, 探讨HBV宫内感染发生的机制.
人早孕胎盘绒毛膜滋养层细胞的体外培养[10]: 选择在我院妇产科门诊自愿要求人工流产的, 妊娠6-10 wk的健康妇女的胎盘绒毛组织, 胚胎发育正常. 经负压吸宫术获得绒毛组织. 胎盘绒毛标本的收集签订知情同意书. 标本于无菌生理盐水中保存, 迅速于超净工作台中分离细胞, 接种于6孔细胞培养板(Costar公司生产)中, 置于含50 mL/L CO2, 37℃细胞培养箱中进行培养. 预先于培养板中放置盖玻片. 人绒毛膜滋养层细胞系JEG-3由中国科学院动物研究所王雁玲教授惠赠. 取处于对数生长期的JEG-3细胞, 消化吹打成细胞悬液后接种于预先放置有盖玻片的6孔细胞培养板中, 置于含50 mL/L CO2, 37℃细胞培养箱中培养. 收集HBV DNA高水平(>1.0×1011 copies/mL)的HBV携带者(肝功能正常)血清和 HBV血清学标志物阴性的健康人血清, 0.22 μm滤器(Costar公司生产)过滤除菌, 56℃, 30 min灭活补体. -30℃无菌冰冻保存.
1.2.1 HBV对体外培养滋养层细胞的感染试验: 试验组在处于对数生长期的体外培养细胞中加入含20% HBV携带者灭活血清的DMEM/F12(1∶1)培养基(购自Hyclone公司. 含有HEPES、L-谷氨酰胺和丙酮酸钠). 对照组中加入健康人灭活血清. 培养细胞与血清共同孵育24, 48和72 h, 吸去培养液, 反复用无血清培养液冲洗, 直至收集的洗液HBsAg检测呈阴性.
1.2.2 观察HBV感染后滋养层细胞的形态和细胞间连接: 倒置显微镜(Nikon, Japan)下观察培养细胞的形态和细胞间连接.
1.2.3 滋养层细胞HBV感染情况的检测: 通过免疫荧光法检测滋养层细胞中HBsAg的表达. 收集不同时间点的细胞, 40 g/L多聚甲醛室温固定15 min, PBS冲洗3次, -20℃冰冻保存. 检测时取出冻存细胞, 室温解冻后, 100 g/L牛血清白蛋白(BSA)封闭, 加入10 g/L BSA稀释的HBsAg mAb (1∶50), 4℃过夜, 加入FITC标记的二抗, 在荧光显微镜(Nikon, Japan)下观察染色结果.
1.2.4 滋养层细胞凋亡的检测: 采用原位缺口末端标记技术(transferase-mediated dUTP nick end -labeling, TUNEL)检测HBV感染对滋养层细胞凋亡的影响: 取不同时间点的滋养层细胞和对照组细胞, 严格按照试剂盒(武汉博士德生物工程有限公司生产)使用说明书提供的方法检测细胞凋亡的情况. 凋亡细胞指数的计算方法[11]为计数每个胎盘中100个细胞中阳性核的数量(n = 5). 其中的阳性细胞核数目所占的比值为凋亡指数, 重复三次实验.
1.2.5 滋养层细胞内HBV DNA的检测: 按照Frederick et al[12]的方法提取细胞中的DNA, 并通过HBV荧光定量PCR检测试剂盒(深圳市匹基生物工程股份有限公司生产)进行HBV DNA的检测.
统计学处理 实验数据用mean±SD表示, 用SPSS for Windows 10.0软件对数据进行统计学分析. 组间两两比较采用LSD法. P<0.05为有显著性差异.
倒置相差显微镜下观察, 原代培养滋养层细胞和JEG-3细胞系在与HBV阳性血清共同孵育后均未出现明显的细胞病变, 加入感染血清后细胞继续生长, 与阴性对照组相比无明显差异. 细胞结构无明显改变, 细胞间连接未见破坏.
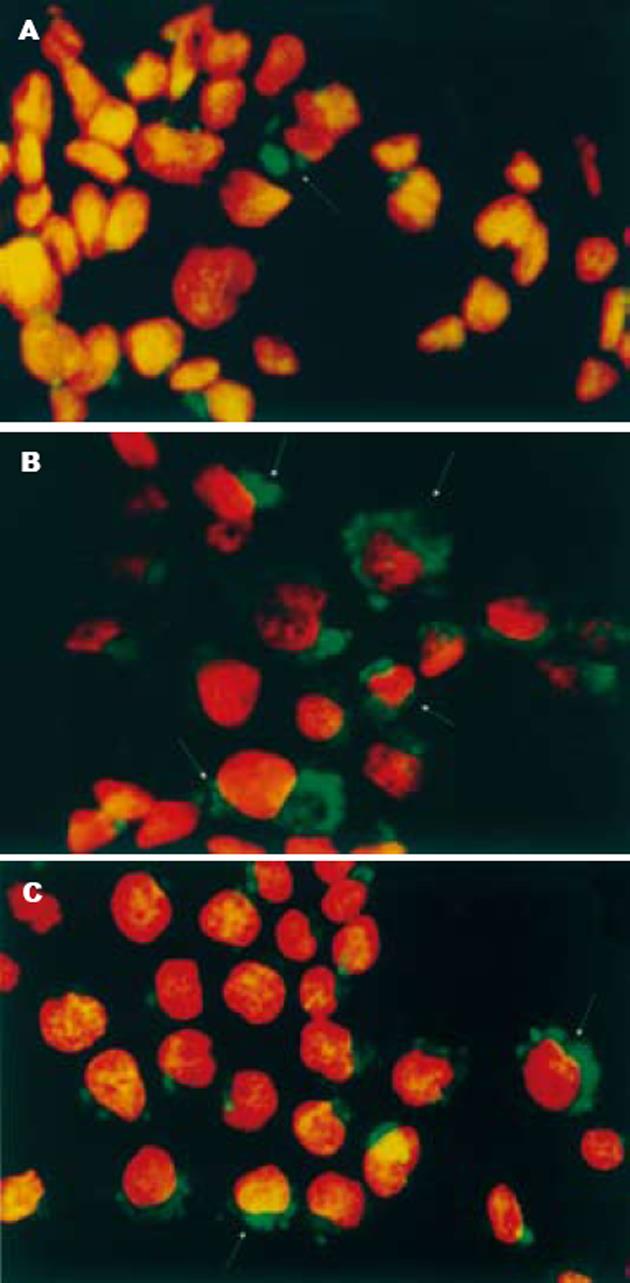
免疫荧光染色结果显示, 滋养层细胞与HBV感染血清共同孵育后, 滋养层细胞中可以出现HBsAg的阳性表达, 阴性对照组未见HBsAg阳性细胞. 在8 h时, 阳性信号较弱, 感染细胞数量也较少, 24 h时阳性信号增强, 感染细胞数量呈增加趋势, 之后滋养层细胞中HBsAg阳性细胞数量无明显增多(图1). 通过计数每个时间点每100个细胞中HBsAg阳性细胞的数量(每张玻片计数500个细胞), 比较不同时间点滋养层细胞被感染的数量(表1). 结果表明, 与HBV阳性血清共同孵育24 h时滋养层细胞中HBsAg阳性细胞的数量高于8 h组, 两组间比较有显著性差异(P<0.05), 与48 h组相比无明显统计学差异.
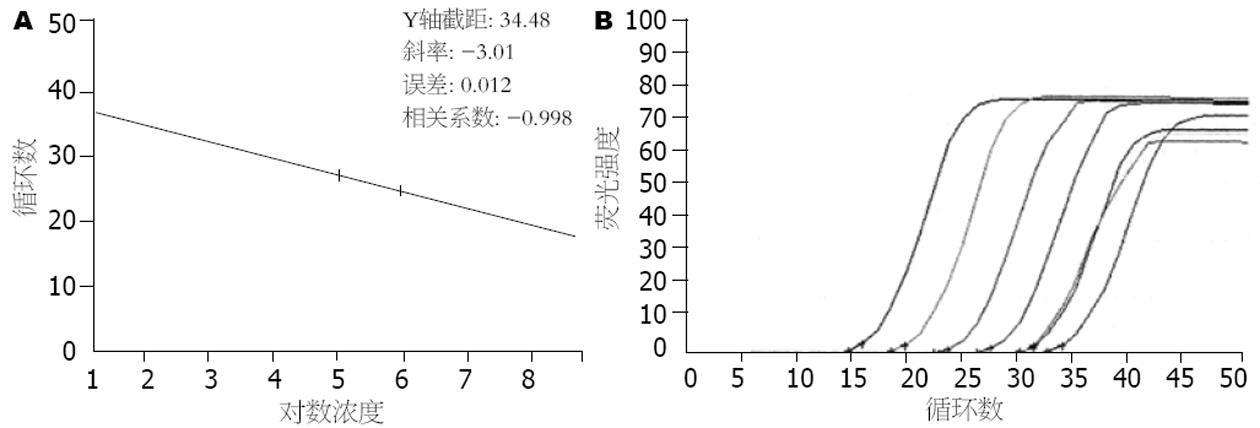
荧光定量PCR检测结果显示, 在与HBV感染血清共同孵育8, 24和48 h的原代培养滋养层细胞和滋养层细胞系JEG-3细胞中均检测到HBV DNA的存在(图2).
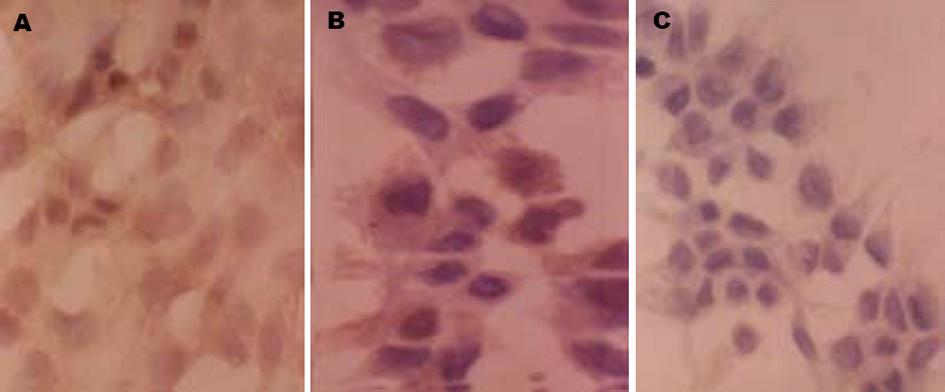
通过TUNEL染色法检测与HBV感染血清共同孵育的滋养层细胞的凋亡. 结果与感染血清共同孵育24 h和48 h的滋养层细胞均出现凋亡, 且随着孵育时间的延长, 凋亡细胞数量呈增加趋势. 与正常人血清共同孵育的滋养层细胞未见出现明显细胞凋亡(图3). 通过计算凋亡指数, 比较各组间滋养层细胞凋亡的数量(表2). 结果显示, 与HBV感染血清共同孵育48 h时滋养层细胞的凋亡数量比24 h时明显增加, 两组间比较有显著性差异(P<0.05).
胎盘屏障由绒毛毛细血管壁、绒毛间质和绒毛表面滋养层细胞构成, 是母婴间物质交换的场所. 胎盘屏障具有选择性通透作用, 并能阻挡病原体通过. 但是有些病原体, 主要是一些病毒可以通过某种方式穿过胎盘屏障到达胎儿血液循环, 导致胎儿发生宫内感染[13-16]. 滋养层细胞是胎盘屏障的第一层细胞, 其在HBV宫内感染中的作用受到关注[17].
我们对早孕胎盘滋养层细胞进行原代培养, 建立了滋养层细胞的体外培养模型[10]. 滋养层细胞在最初分离时为单个核的细胞, 加入含血清培养基24-48 h后细胞逐渐融合为多个核的合体滋养层细胞. 在此期间我们将乙肝病毒携带者的感染血清加入到细胞培养液中, 模拟了在体内滋养层细胞浸浴在母体血液中的情况, 并通过检测HBV对滋养层细胞的作用, 了解胎盘屏障在HBV宫内感染机制中所发挥的作用. 虽然原代培养细胞最接近机体内的情况, 但技术操作难度较大. 根据文献[18-20]和我们的研究结果, 人滋养层细胞系JEG-3和原代培养的人滋养层细胞的结构和功能很相似. 所以, 我们将滋养层细胞系JEG-3细胞引入实验中, 并作为胎盘屏障的研究模型, 对胎盘屏障的功能进行研究. 在临床上大多数乙型肝炎病毒感染者在妊娠过程中与正常孕妇相比妊娠并发症的出现率没有明显增加[21], 我们的研究结果也表明, 加入感染血清后滋养层细胞的生长速度与对照组无明显差别, 细胞结构完整, 细胞间连接紧密, 未出现明显的细胞病变, 也未见死亡细胞明显增多. 说明HBV可能没有明显的引起胎盘细胞病变的作用, 乙型肝炎病毒对体外培养的滋养层细胞也无明显的致细胞病变作用. 所以, HBV的宫内传播可能与破坏胎盘屏障的完整性或增加胎盘屏障的通透性无关.
细胞免疫荧光染色法检测乙型肝炎病毒对滋养层细胞感染的结果表明, 在与HBV感染血清共同培养8, 24和48 h的原代培养滋养层细胞和JEG-3细胞中均检测到了HBsAg的阳性表达. 但随着感染时间的延长, 感染细胞的数量未见明显增多. 我们对与HBV阳性血清共同孵育的滋养层细胞进行HBV DNA的检测, 结果在滋养层细胞内可以检测到HBV DNA. 说明HBV可以感染滋养层细胞. 由此我们推测, 滋养层细胞的感染可能是HBV通过胎盘屏障的途径之一.
临床工作中我们发现, 乙型肝炎病毒的宫内感染率不超过10%[22-23], 即使母亲为HBV DNA高水平携带者, 其子女出生后大多数可以通过乙肝疫苗和乙肝高效价免疫球蛋白(HBIG)联合免疫阻断HBV的母婴传播, 并不发生HBV的慢性携带[24-27]. 说明胎盘屏障在阻断HBV的宫内传播的过程中发挥了保护作用[28-30]. 细胞凋亡是机体清除病毒感染细胞, 防止感染传播的一种机制. 为了探讨细胞凋亡在HBV宫内传播中的作用, 我们对与HBV阳性血清共同孵育8, 24和48 h的滋养层细胞进行细胞凋亡检测. 结果, 加入HBV感染血清24 h后, 可以检测到凋亡细胞, HBV感染组凋亡细胞的数量明显多于阴性对照组, 而且随着共同孵育时间的延长, 凋亡细胞的数量呈增加趋势. 我们分析, 在HBV对滋养层细胞感染试验中发现的随感染时间的延长, HBV感染细胞的数量未见明显增多的现象, 可能与HBV诱导的滋养层细胞凋亡增加有关. 可能由于感染HBV后滋养层细胞很快发生凋亡, 细胞还没有来得及表达病毒抗原的成分. 为了排除感染血清中复杂的细胞因子对滋养层细胞凋亡的影响, 我们设立了阴性对照, 将正常人血清加入到培养基中, 与滋养层细胞共同培养, 结果未见有滋养层细胞凋亡明显增加的现象, 说明滋养层细胞凋亡的增加是由于HBV感染所诱导的.
总之, 我们的研究结果表明, HBV可以感染体外培养的滋养层细胞. HBV对滋养层细胞的感染可能是HBV发生宫内感染的机制之一. HBV感染可以诱导滋养层细胞产生凋亡, 滋养层细胞的凋亡可能是胎盘屏障阻止HBV宫内感染的一种保护性机制.
母婴传播是我国乙型肝炎病毒感染的主要传播途径之一, 包括宫内传播、产时传播和产后传播. 其中宫内传播是导致新生儿发生乙肝疫苗免疫阻断失败, 成为慢性HBV感染者的主要原因, HBV宫内传播的机制目前仍不清楚. 在妊娠过程中, 滋养层细胞是HBV通过胎盘屏障的第一步. 所以研究滋养层细胞的HBV感染, 对明确HBV的宫内传播机制很有意义.
在HBV的宫内传播机制中, 胎盘泄漏学说, 胎盘感染学说等均受到学者的重视, 特别是胎盘感染在HBV的宫内传播机制中的意义研究较多. 胎盘屏障对病毒感染宫内传播的保护作用也有学者进行研究. 明确乙型肝炎病毒的宫内传播机制对阻断乙肝病毒的母婴传播意义重大, 是目前国内外肝病学者研究的重点和热点之一.
关于病毒感染的母婴传播机制特别是HIV的母婴传播机制, 在国外是学者们研究的热点之一, 研究的内容很广泛, 有很多相关的报道. 关于HBV母婴传播机制的报道, 国内外学者的研究内容以HBV对胎盘屏障的感染为主.
本文通过研究HBV对体外培养的滋养层细胞的感染, 从HBV对滋养层细胞的感染和HBV对滋养层细胞凋亡的诱导两个方面, 探讨在HBV宫内传播机制中胎盘屏障所发挥的作用.
本研究进一步证实了HBV对胎盘屏障的感染在HBV宫内传播机制中的意义, 同时提出胎盘滋养层细胞的凋亡可能是胎盘屏障对HBV感染的保护性机制, 对明确HBV的宫内传播机制, 并进一步采取措施阻断HBV的宫内传播有重要意义.
本文通过HBV感染体外培养的人绒毛膜滋养层细胞, 探讨了HBV宫内感染发生的机制, 得出HBV可以诱导滋养层细胞的凋亡, 对临床有一定的指导价值.
电编: 何基才 编辑:王晓瑜
| 1. | 白 菡, 赵 桂珍. 乙型肝炎病毒母婴传播机制及预防的研究进展. 国外医学流行病学传染病学分册. 2005;32:99-102. |
| 2. | Michielsen PP, Van Damme P. Viral hepatitis and pregnancy. Acta Gastroenterol Belg. 1999;62:21-29. [PubMed] |
| 3. | Wang JS, Zhu QR. Infection of the fetus with hepatitis B e antigen via the placenta. Lancet. 2000;355:989. [PubMed] [DOI] |
| 4. | Wang JS, Chen H, Zhu QR. Transformation of hepatitis B serologic markers in babies born to hepatitis B surface antigen positive mothers. World J Gastroenterol. 2005;11:3582-3585. [PubMed] [DOI] |
| 5. | Wang Z, Zhang J, Yang H, Li X, Wen S, Guo Y, Sun J, Hou J. Quantitative analysis of HBV DNA level and HBeAg titer in hepatitis B surface antigen positive mothers and their babies: HBeAg passage through the placenta and the rate of decay in babies. J Med Virol. 2003;71:360-366. [PubMed] [DOI] |
| 6. | Haun L, Kwan N, Hollier LM. Viral infections in pregnancy. Minerva Ginecol. 2007;59:159-174. [PubMed] |
| 7. | Zhang SL, Yue YF, Bai GQ, Shi L, Jiang H. Mechanism of intrauterine infection of hepatitis B virus. World J Gastroenterol. 2004;10:437-438. [PubMed] |
| 8. | Wang XP, Li FJ, Xu DZ, Yan YP, Men K, Zhang JX. Uptake of hepatitis B virus into choriocarcinoma cells in the presence of proinflammatory cytokine tumor necrosis factor-alpha. Am J Obstet Gynecol. 2004;191:1971-1978. [PubMed] [DOI] |
| 9. | Xu DZ, Yan YP, Zou S, Choi BC, Wang S, Liu P, Bai G, Wang X, Shi M, Wang X. Role of placental tissues in the intrauterine transmission of hepatitis B virus. Am J Obstet Gynecol. 2001;185:981-987. [PubMed] [DOI] |
| 10. | 白 菡, 何 丽霞, 马 力, 李 颖, 赵 桂珍. 人早孕胎盘绒毛膜滋养层细胞体外培养模型的建立. 中国组织化学与细胞化学杂志. 2006;15:319-322. |
| 11. | Fujino T, Iwamoto I, Otsuka H, Ikeda T, Takesako S, Nagata Y. Apoptosis in placentas from human T-lymphotropic virus type I-seropositive pregnant women: a possible defense mechanism against transmission from mother to fetus. Obstet Gynecol. 1999;94:279-283. [PubMed] [DOI] |
| 12. | Frederick M. Ausubel, Roger Brent, Robert E. Kingston, David D. Moore, J. G. Seidman, John A. Smith, Kevin Struhl. Short Protocols in Molecular Biology. Fourth edition. John Wiley & Sons Inc. Publishers. 2000;2-3. |
| 13. | Paradowska E, Przepiorkiewicz M, Nowakowska D, Studzinska M, Wilczynski J, Emery VC, Lesnikowski ZJ. Detection of cytomegalovirus in human placental cells by polymerase chain reaction. APMIS. 2006;114:764-771. [PubMed] [DOI] |
| 14. | Srinivas SK, Ma Y, Sammel MD, Chou D, McGrath C, Parry S, Elovitz MA. Placental inflammation and viral infection are implicated in second trimester pregnancy loss. Am J Obstet Gynecol. 2006;195:797-802. [PubMed] [DOI] |
| 15. | Sahni AK, Gupta RM, Jena J, Nair MN. Early detection of HIV-1 in infants by PCR. Indian J Pathol Microbiol. 2005;48:49-52. [PubMed] |
| 16. | Parry S, Zhang J, Koi H, Arechavaleta-Velasco F, Elovitz MA. Transcytosis of Human immunodeficiency virus 1 across the placenta is enhanced by treatment with tumour necrosis factor alpha. J Gen Virol. 2006;87:2269-2278. [PubMed] [DOI] |
| 17. | Bhat P, Anderson DA. Hepatitis B Virus Translocates across a Trophoblastic Barrier. J Virol. 2007;81:7200-7207. [PubMed] [DOI] |
| 18. | Arias RA, Munoz LD, Munoz-Fernandez MA. Transmission of HIV-1 infection between trophoblast placental cells and T-cells take place via an LFA-1-mediated cell to cell contact. Virology. 2003;307:266-277. [PubMed] [DOI] |
| 19. | Vidricaire G, Tardif MR, Tremblay MJ. The low viral production in trophoblastic cells is due to a high endocytic internalization of the human immunodeficiency virus type 1 and can be overcome by the pro-inflammatory cytokines tumor necrosis factor-alpha and interleukin-1. J Biol Chem. 2003;278:15832-15841. [PubMed] [DOI] |
| 20. | Lagaye S, Derrien M, Menu E, Coito C, Tresoldi E, Mauclere P, Scarlatti G, Chaouat G, Barre-Sinoussi F, Bomsel M. Cell-to-cell contact results in a selective translocation of maternal human immunodeficiency virus type 1 quasispecies across a trophoblastic barrier by both transcytosis and infection. J Virol. 2001;75:4780-4791. [PubMed] [DOI] |
| 21. | Wong S, Chan LY, Yu V, Ho L. Hepatitis B carrier and perinatal outcome in singleton pregnancy. Am J Perinatol. 1999;16:485-488. [PubMed] [DOI] |
| 22. | Xu Q, Xiao L, Lu XB, Zhang YX, Cai X. A randomized controlled clinical trial: interruption of intrauterine transmission of hepatitis B virus infection with HBIG. World J Gastroenterol. 2006;12:3434-3437. [PubMed] [DOI] |
| 23. | Xu DZ, Yan YP, Choi BC, Xu JQ, Men K, Zhang JX, Liu ZH, Wang FS. Risk factors and mechanism of transplacental transmission of hepatitis B virus: a case-control study. J Med Virol. 2002;67:20-26. [PubMed] [DOI] |
| 24. | Xiao XM, Li AZ, Chen X, Zhu YK, Miao J. Prevention of vertical hepatitis B transmission by hepatitis B immunoglobulin in the third trimester of pregnancy. Int J Gynaecol Obstet. 2007;96:167-170. [PubMed] [DOI] |
| 25. | Kripke C. Hepatitis B vaccine for infants of HBsAg-positive mothers. Am Fam Physician. 2007;75:49-50. [PubMed] |
| 26. | Xu DZ, Huang KL, Zhao K, Xu LF, Shi N, Yuan ZH, Wen YM. Vaccination with recombinant HBsAg-HBIG complex in healthy adults. Vaccine. 2005;23:2658-2664. [PubMed] [DOI] |
| 27. | Holtby I, McCarron B. Immunisation of babies of women who screen positive for hepatitis B. Commun Dis Public Health. 2004;7:258-259. [PubMed] |
| 28. | Arias RA, Munoz LD, Munoz-Fernandez MA. Transmission of HIV-1 infection between trophoblast placental cells and T-cells take place via an LFA-1-mediated cell to cell contact. Virology. 2003;307:266-277. [PubMed] [DOI] |
| 29. | Casper C, Fenyo EM. Mother-to-child transmission of HIV-1: the role of HIV-1 variability and the placental barrier. Acta Microbiol Immunol Hung. 2001;48:545-573. [PubMed] [DOI] |