修回日期: 2007-04-18
接受日期: 2007-04-21
在线出版日期: 2007-05-18
目的: 观察胃癌相关基因GCRG213体内正、反向转染和RNA干扰对裸鼠胃癌种植瘤的影响.
方法: 将对数生长期的胃癌细胞株MKN45接种到裸鼠皮下, 成瘤后用制备好的分别含GCRG213正、反义克隆和RNAi片段的腺相关病毒分别在肿瘤局部注射, 以空病毒和生理盐水对照, 继续喂养2 wk后处死, 取肿瘤测量重量, 并用半定量RT-PCR检测肿瘤组织GCRG213mRNA表达水平.
结果: 裸鼠接种MKN45细胞3 wk左右皮下形成肿瘤结节. 肿瘤组织重量在正向转染组为5.12±1.02 g、反向组1.22±0.46 g、RNAi组0.81±0.37 g、空病毒组3.13±0.69 g、生理盐水组3.45±0.87 g; 各组GCRG213 mRNA表达水平依次分别为0.406±0.013, 0.211±0.021, 0.087±0.015, 0.312±0.050, 0.283±0.061.
结论: 三种腺相关病毒分别有效地介导了GCRG213正、反义克隆和RNAi片段的体内表达, 提高或降低了GCRG213 mRNA的表达水平, 促进或抑制了胃癌种植瘤的生长.
引文著录: 徐世平, 吴本俨, 王孟薇, 高利利, 伍银桥, 王卫华, 尤纬缔. 胃癌相关基因GCRG213正反向转染和RNA干扰对裸鼠胃癌种植瘤的影响. 世界华人消化杂志 2007; 15(14): 1639-1642
Revised: April 18, 2007
Accepted: April 21, 2007
Published online: May 18, 2007
AIM: To investigate the influence of sense or anti-sense GCRG213 fragment and GCRG213 RNA interference (RNAi) on transplanted gastric cancer in vivo.
METHODS: Gastric carcinoma cell line MKN45 at logarithmic growth phase was subcutaneously inoculated in 20 athymic mice. After tumor formation, the adeno-associated virus (AAV) containing sense or anti-sense GCRG213 fragment and GCRG213 RNA interference fragment was injected into tubercles. Meanwhile, empty and normal saline control groups were designed. All the mice were killed 2 weeks after injection. Tumors were weighted and the expression of GCRG213 mRNA was detected by semi-quantitative reverse transcription-polymerase chain reaction.
RESULTS: Three weeks after inoculation of MKN45 cells, small tumor tubercles came into formation. The weights of tumor tissues were 5.12 ± 1.02, 1.22 ± 0.46, 0.81 ± 0.37, 3.13 ± 0.69 and 3.45 ± 0.87 g in sense, anti-sense, RNAi, empty and normal saline group, and the mRNA expression of GCRG213 were 0.406 ± 0.013, 0.211 ± 0.021, 0.087 ± 0.015, 0.312 ± 0.050 and 0.283 ± 0.061 in the above groups, respectively.
CONCLUSION: Target genes including sense or anti-sense GCRG213 and RNAi fragment can be effectively expressed in vivo through AAV vector. Increased or decreased GCRG213 expression can promote or inhibit growth of gastric cancer.
- Citation: Xu SP, Wu BY, Wang MW, Gao LL, Wu YQ, Wang WH, You WD. Effect of sense or anti-sense GCRG213 fragment and GCRG213 RNA interference on transplanted gastric carcinoma in vivo. Shijie Huaren Xiaohua Zazhi 2007; 15(14): 1639-1642
- URL: https://www.wjgnet.com/1009-3079/full/v15/i14/1639.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i14.1639
胃癌的发生发展是多基因变异累积的过程. 本实验室应用荧光标记的DDRT-PCR筛选出1条在肠型胃癌组织、癌旁及正常组织间差异表达的新基因GCRG213[1]. 初步研究表明, 用其正义克隆转染人胃癌细胞系MKN45细胞后, 能增加细胞的生长速度和成瘤性, 用反义克隆转染或RNA干扰后则能抑制细胞的生长速度和成瘤性[2-3]. 为了进一步研究GCRG213的体内功能, 我们用包装好的分别含GCRG213正、反义克隆和特异性RNAi片段的3种腺相关病毒行裸鼠体内注射, 观察对胃癌种植瘤生长的影响.
5周龄雌性裸鼠均购自解放军总医院动物实验中心, 体质量18-20 g. 包含GCRG213正、反向克隆的腺相关病毒rAAV-GCRG213-s, rAAV-GCRG213-a(滴度均为4×1013 v.g./L)和包含GCRG213特异性RNAi片段的腺相关病毒rAAV-U6-shRNA(滴度为5×1015 v.g./L)均有本实验室制备并保存. rAAV-GFP腺相关病毒(滴度为5×1015 v.g./L)由北京本元正阳公司惠赠. MKN45细胞系本实验室保存. RT-PCR试剂盒购自TaKaRa公司.
1.2.1 建立胃癌种植瘤模型: 5周龄雌性裸鼠20只, 随机分成5组, 每组4只, 无菌环境下饲养3 d后准备接种. 取对数生长期MKN45细胞, 2.5 g/L胰酶消化后, 1×PBS洗涤, 制成浓度为1×1010/L的单细胞悬液, 在每只裸鼠左后肢皮下注射0.2 mL MKN45细胞.
1.2.2 病毒局部注射: 将病毒均稀释成滴度为2×1014 v.g./L, 待裸鼠皮下有小的瘤结节形成时, 每组裸鼠分别在肿瘤局部注射0.2 mL相应病毒或生理盐水. A组(空白组): 注射0.2 mL生理盐水; B组(空病毒对照组): 注射rAAV-GFP腺相关病毒; C组(正向转染组): 注射rAAV-GCRG213-s腺相关病毒; D组(反向转染组): 注射rAAV-GCRG213-a腺相关病毒; E组(shRNA干扰组): 注射rAAV-U6-shRNA腺相关病毒. 注射后裸鼠继续在无菌环境下饲养2 wk, 观察肿瘤大小变化及裸鼠存活状况.
1.2.3 取肿瘤组织: 2 wk后将裸鼠引颈处死, 剥离种植瘤块, 滤纸吸干后测量肿瘤大小并称重, 部分组织液氮保存, 拟行RT-PCR检测GCRG213 mRNA表达水平的变化.
1.2.4 组织总RNA提取及鉴定: 称取50-100 mg组织, 加入l mL TRIzol试剂, 组织体积不超过TRIzol试剂体积的10%. 匀浆后室温孵育5 min, 加0.2 mL氯仿, 剧烈震荡15 s, 室温孵育2-3 min. 4℃ 12 000 g离心15 min. 移出上清, 加0.5 mL异丙醇, 室温孵育10 min. 4℃ 12 000 g离心10 min. 移去上清, 用冷的750 mL/L乙醇洗一次. 4℃ 7500 g离心5 min, 回收RNA沉淀, 溶解于100 μL DEPC水中使用, 或置于乙醇中-70℃保存备用. 取5 μL RNA样品, 以10 g/L琼脂糖凝胶电泳分析, 紫外灯下观察rRNA, 28S, 18S, 5S的带型和强度. 总RNA用双蒸水1∶40稀释后测其A260/280比值以及有无残留蛋白.
1.2.5 半定量RT-PCR检测GCRG213 mRNA表达: 取RNA 5 μg进行逆转录反应, 然后各自取cDNA 1 μL用于PCR反应. GCRG213基因引物序列如下: P1: 5'-AACTGCAGATGCAACAAGAA-3', P2: 5'-CGGGATCCAAGTTTTGAGTGAG-3'. 以β2-microglobulin为内参照, 引物序列如下: P1 5'- GCTATCCAGCGTACTCCAAAGA-3', 5'- AGAGCTACCTGTGGAGCAACCT-3'. 引物由上海博亚生物工程公司合成, 反应条件: 94℃ 2 min. 94℃ 30 s, 51℃ 30 s, 72℃ 30 s, 32个循环. 72℃延伸7 min. 取5 μL扩增产物, 以10 g/L琼脂糖凝胶电泳分析. 产物电泳后经凝胶分析软件(Bandscan)分析其灰度值, 结果以产物与内参照的比值表示.
裸鼠皮下接种MKN45细胞后, 3 wk左右皮下形成肉眼可见的肿瘤结节, 局部注射病毒后, 裸鼠生长良好, 未出现1例死亡.继续喂养2 wk后处死裸鼠, 剥离瘤块, 滤纸吸干后称重. A, B, C, D, E五组肿瘤重量分别为(mean±SD, g) 3.45±0.87, 3.13±0.69, 5.12±1.02, 1.22±0.46, 0.81 ± 0.37, 同A组和B比较, C组的裸鼠肿瘤生长更快(P<0.05), 而D组和E组的裸鼠肿瘤生长较慢(P<0.05).
肿瘤组织提取的总RNA(图1), 分光光度计测量A260/280 = 1.7-1.85, 电泳清晰显示28S, 18S和5S条带.
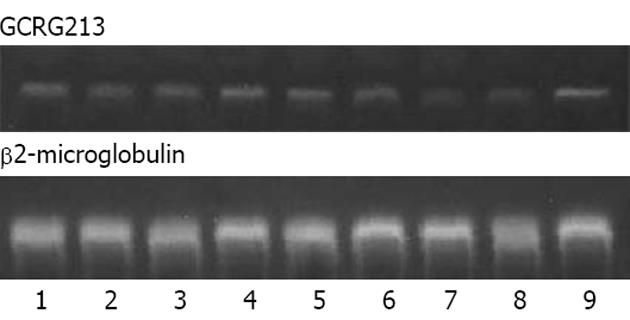
A, B, C, D, E5组肿瘤组织中GCRG213 mRNA表达水平(与内参照比值)分别为0.283±0.061, 0.312±0.050, 0.406±0.013, 0.211±0.021, 0.087±0.015, 同A组和B组比较C组的裸鼠GCRG213 mRNA表达水平相对较高, 而D组和E组的裸鼠肿瘤GCRG213 mRNA表达水平相对较低, 结果说明注射病毒后正、反向克隆得到了有效表达, shRNA片段也有效抑制了目的基因的表达(图2).
胃癌是严重威胁人类健康的恶性肿瘤之一, 我国是胃癌发病率较高的地区, 尽管目前我国胃癌的发病率有下降趋势, 但其发病率和死亡率仍位居前列[4-5]. 探索疾病发生的相关机制, 寻找更为有效的治疗手段仍是我们努力的方向.
GCRG213是我们实验室发现的1条胃癌相关新基因, 既往的研究表明[2-3]GCRG213可能是一种新发现的恶性肿瘤形成促进因子. 由于既往的实验主要是体外实验, 为了进一步研究GCRG213在体内表达水平的变化对肿瘤的影响, 我们选用腺相关病毒载体进行了GCRG213正、反义克隆和特异性RNAi片段的包装, 结果表明, 用病毒进行裸鼠种植瘤局部注射后, 成功实现了基因的局部表达, 同注射了空病毒组比较, 正向表达组促进了肿瘤的发展, GCRG213 mRNA表达水平升高; 反向表达组和RNAi组减缓了肿瘤的发展速度, GCRG213 mRNA表达水平降低. 结果再次证实了GCRG213是一个促癌因子, 当然本实验裸鼠数量有限, 对实验的进一步扩大将有助于对结果的更深入观察, GCRG213的促癌机制和对体内其他相关基因的影响也有待进一步研究. 本实验也为胃癌的基因治疗提供了有益的尝试. 随着生物技术的发展, AAV载体成为目前载体工具研究的热点. 在用于人类基因治疗常用病毒载体中, AAV载体是目前唯一没有引起人类宿主任何病理反应的载体[6]. 作为体内实验一种理想的基因治疗的病毒载体, AAV具有使用安全、不致病、可以定点整合到第19号染色体上、可以感染分裂和非分裂细胞、宿主范围广、携带的外源基因可长期稳定表达等优点[7-9]. rAAV携带的外源基因除了以整合的形式长期表达以外, 还可以染色体外附加体的形式短暂表达. 这取决于转导的细胞类型、细胞的代谢和增殖状态以及所采用的转导条件. rAAV向体内靶组织注射后, 逐渐由单链的载体基因组转变成高分子量的双链串联体, 伴随着外源基因的表达逐渐增强, 在数周内表达达到稳定状态. 外源基因的长期表达既可以来自整合于染色体的串联体, 也可以来自附加体形式的串联体, 这两种情况同时存在. 在小鼠肝脏中, rAAV的单链基因组在5 wk内逐渐消失, 代之以双链、高分子量串联体的逐渐增加. 这种串联体在约5%的细胞中是整合形式的, 其余则是以附加体形式存在的[8]. 因此, AAV有望成为人体基因治疗和基因功能研究最理想的载体工具. 本实验显示裸鼠局部注射病毒数达到1010-1011 v.g., 未出现任何不良反应, 生长状况良好, 反应了腺相关病毒良好的安全性, 同时用该病毒成功实现了基因的体内表达, 对肿瘤的生长产生了抑制或促进作用, 也说明用病毒进行体内目的基因的正、反向表达和RNA干扰都是可行的. Mahendra et al[10]已经用rAAV介导的sFlt21抑制肿瘤血管的生成, Veldwijk et al[11]也在肉瘤细胞系中用rAAV2介导自杀基因来进行基因治疗的研究, 都显示了rAAV应用于临床的广阔前景.
RNA干扰(RNA interference, RNAi)是由与靶序列同源的双链RNA所诱导的特异性的转录后基因沉默现象, 他具有高效性、特异性的特点, 已成为基因治疗和基因功能研究领域新的热点. 典型的转染外源合成的siRNA在转染7 d以后或者10次细胞分裂后会从mRNA抑制中恢复[12]. 然而用shRNA载体转染的细胞将经历长期稳定的mRNA抑制作用. 从而提供了比转染化学合成的siRNA更经济有效的方法. 如果能用病毒包装含目的基因特异性的shRNA进行体内感染并有效表达, 无疑是基因治疗的一种理想的方法. 由于RNAi的高效表达需要有特异性的U6启动子[13-14], 我们构建的包含U6启动子和特异性RNAi片段的rAAV-U6-shRNA腺相关病毒体内注射后成功实现了RNAi片段的有效表达, 也将为更多的基因干预和基因的功能研究提供有效的载体工具.
胃癌相关基因GCRG213是我们实验室筛选出的1条在肠型胃癌、癌旁和正常组织间差异表达的新基因, 初步研究表明: 用其正义克隆转染人胃癌细胞系MKN45细胞后, 能增加细胞的生长速度和成瘤性, 用反义克隆转染或RNA干扰后则能抑制细胞的生长速度和成瘤性, 是1种可能的胃癌促进因子. 腺相关病毒(AAV)载体是目前唯一没有引起人类宿主任何病理反应的载体, 有望成为人体基因治疗和基因功能研究最理想的载体工具. 为了进一步在体研究GCRG213功能, 我们包装了含其正、反义克隆和特异性RNAi片段的3种AAV, 并行裸鼠体内注射, 为以后的研究奠定了基础, 同时也为胃癌基因治疗提供了有益的尝试.
该文选题新颖, 研究方法先进, 数据客观, 结论对于探索胃癌的发病机制具有较高的学术价值, 而且对于胃癌的基因治疗也提供了有益的尝试.
电编: 何基才 编辑:王晓瑜
| 1. | Wang GS, Wang MW, Wu BY, Liu XB, You WD, Yang XY. A gene encoding an apurinic/apyrimidinic endonuclease-like protein is up-regulated in human gastric cancer. World J Gastroenterol. 2003;9:1196-1201. [PubMed] [DOI] |
| 2. | 高 利利, 吴 本俨, 王 孟薇, 黄 海力, 伍 银桥, 尤 纬缔, 王 卫华. 胃癌相关基因GCRG213正反义真核表达载体的构建及鉴定. 世界华人消化杂志. 2006;14:1453-1457. [DOI] |
| 3. | 高 利利, 吴 本俨, 王 孟薇, 王 珊, 黄 海力, 伍 银桥, 尤 纬缔, 王 卫华. 胃癌相关基因GCRG213真核表达载体的构建及其对胃癌细胞生长特性的影响. 解放军医学杂志. 2006;31:881-884. |
| 4. | 赵 金扣, 刘 爱民, 武 鸣, 圣 龙贵, 陈 娟, 顾 小平, 王 建军, 覃 玉, 陆 健. 江苏省大丰市1999-2004年主要恶性肿瘤发病死亡分析. 中国肿瘤. 2005;14:577-579. |
| 5. | 张 薇, 项 永兵, 刘 振伟, 方 茹蓉, 阮 志贤, 孙 璐, 高 立峰, 金 凡, 高 玉堂. 1973-1999年上海市区老年人恶性肿瘤发病趋势分析. 中华老年医学杂志. 2005;24:701-704. |
| 6. | Flotte TR. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 2004;11:805-810. [PubMed] [DOI] |
| 7. | Rabinowitz JE, Samulski RJ. Building a better vector: the manipulation of AAV virions. Virology. 2000;278:301-308. [PubMed] [DOI] |
| 8. | Xu R, Sun X, Tse LY, Li H, Chan PC, Xu S, Xiao W, Kung HF, Krissansen GW, Fan ST. Long-term expression of angiostatin suppresses metastatic liver cancer in mice. Hepatology. 2003;37:1451-1460. [PubMed] [DOI] |
| 9. | Wang H, Shayakhmetov DM, Leege T, Harkey M, Li Q, Papayannopoulou T, Stamatoyannopolous G, Lieber A. A capsid-modified helper-dependent adenovirus vector containing the beta-globin locus control region displays a nonrandom integration pattern and allows stable, erythroid-specific gene expression. J Virol. 2005;79:10999-11013. [PubMed] [DOI] |
| 10. | Mahendra G, Kumar S, Isayeva T, Mahasreshti PJ, Curiel DT, Stockardt CR, Grizzle WE, Alapati V, Singh R, Siegal GP. Antiangiogenic cancer gene therapy by adeno-associated virus 2-mediated stable expression of the soluble FMS-like tyrosine kinase-1 receptor. Cancer Gene Ther. 2005;12:26-34. [PubMed] [DOI] |
| 11. | Veldwijk MR, Berlinghoff S, Laufs S, Hengge UR, Zeller WJ, Wenz F, Fruehauf S. Suicide gene therapy of sarcoma cell lines using recombinant adeno-associated virus 2 vectors. Cancer Gene Ther. 2004;11:577-584. [PubMed] [DOI] |
| 12. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 13. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] [DOI] |
| 14. | Yu JY, DeRuiter SL, Turner DL. RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells. Proc Natl Acad Sci U S A. 2002;99:6047-6052. [PubMed] [DOI] |