修回日期: 2007-04-15
接受日期: 2007-04-22
在线出版日期: 2007-05-18
目的: 观察CHFR和P53蛋白的表达与胃癌临床病理学特征的关系, 探讨其在胃癌发生发展过程中的作用及相关的分子机制.
方法: 利用组织芯片制作仪(美国), 构建成5个包括151例胃癌及101例与其配对的正常胃黏膜、肠化生或不典型增生的组织芯片蜡块. 采用Envision免疫组化二步法检测151例胃癌及101例配对癌旁胃黏膜组织中CHFR蛋白和P53蛋白的表达.
结果: CHFR蛋白在非癌胃黏膜组织中阳性表达率为85.25%(52/61), 在胃癌组织中阳性表达率显著降低(49.67%, 75/151, P<0.05); CHFR表达下调或缺失与胃癌患者的性别显著相关, 女性患者胃癌组织中CHFR表达缺失率显著高于男性患者(64% vs 43.56%, P<0.05). BorrmanⅢ+Ⅳ型胃癌组织中CHFR表达缺失率显著高于Borrman Ⅰ+Ⅱ型胃癌(57.14% vs 34.78%, P<0.05). 虽然不同组织学类型胃癌之间CHFR的表达无统计学差异, 但本研究发现胃印戒细胞癌组CHFR表达缺失率最高(71.43%). 胃癌组织中CHFR蛋白的表达缺失与肿瘤浸润深度、淋巴结转移以及mP53蛋白表达未见显著相关性(P>0.05).
结论: 有丝分裂前期检查点CHFR基因表达下调或缺失在胃癌中是频发事件. 可能参与胃癌的发生, 其与女性、弥漫浸润型胃癌发生发展的关系可能更为密切.
引文著录: 高余佳, 辛彦, 张赛楠, 张家华, 吴东瑛. CHFR和mp53基因编码蛋白在胃癌组织中的表达及临床病理学意义. 世界华人消化杂志 2007; 15(14): 1622-1627
Revised: April 15, 2007
Accepted: April 22, 2007
Published online: May 18, 2007
AIM: To investigate the relationship between the expression of checkpoint with fork head associated and ring finger (CHFR) and P53 protein in gastric cancer (GC) and the clinicopathologic characteristics, and to explore the correlated molecular mechanism of CHFR and p53 genes in gastric carcinogenesis.
METHODS: Five paraffin blocks of tissue microarray were constructed using a Tissue Array Machine (Steve Leighton Beecher Instruments, USA), including 151 cases of primary GC (101 cases with matched normal mucosa, intestinal metaplasia or dysplasia). Envision immunohistochemical method was employed to detect the protein expression of CHFR and mutant p53 in GC and precancerous tissues mentioned above.
RESULTS: The positive rate of CHFR protein expression in GC (49.67%, 75/151) was significantly lower than that in normal gastric mucosa (85.25%, 52/61)(P < 0.05). The down-regulation or absence of mitotic checkpoint CHFR protein expression was correlated with the sex of GC patients. The absent rate of CHFR protein expression in the female GC patients was significantly higher than that in the male GC ones (64% vs 43.56%, P < 0.05). The absent rates was also significantly different between GC patients of Borrmann Ⅲ + Ⅳ and Ⅰ + Ⅱ types (57.14% vs 34.78%, P < 0.05). In the present study, though CHFR protein expression showed no significant difference among various histological types of GC, the absent rate of CHFR protein expression was the highest (71.43%) in signet ring cell carcinoma. The absent expression of CHFR protein was not related to the depth of invasion and lymph node metastasis of GC. In addition, no correlation was found between the expression of CHFR and P53 protein expression in GC (P > 0.05).
CONCLUSION: Down-regulation or absence of mitotic checkpoint CHFR protein expression is frequent events in GC and may take a part in gastric carcinogenesis. Abnormal expression of CHFR may be of more importance in the development of female patients and diffuse-type GC.
- Citation: Gao YJ, Xin Y, Zhang SN, Zhang JH, Wu DY. Protein expression of checkpoint with fork head associated and ring finger and mutant p53 and their clinicopathological significances in gastric cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(14): 1622-1627
- URL: https://www.wjgnet.com/1009-3079/full/v15/i14/1622.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i14.1622
CHFR(checkpoint with fork head associated and ring finger)是Scolnick et al[1]于2000年发现的一个新的有丝分裂前期检查点基因, 定位于12q24.33, 其编码产物为664个氨基酸的蛋白质. 细胞存在有丝分裂应激时, CHFR通路激活引起plk1的泛素化并降解, 控制Cdc2激酶的活性, 延迟染色体凝集和中心体分离, 阻止细胞于有丝分裂前期. 其表达增强细胞对应激的生存能力. 已有研究发现, CHFR基因在一些肿瘤中存在失活或低表达, 提示CHFR基因异常可能参与最初的癌变过程[2-4], 与肿瘤的发生关系密切[5-6]. 胃癌的发生发展过程中既有抑癌基因的突变, 又涉及有癌基因的激活[7-8], 其中p53突变频率最高[8-9]. 但迄今CHFR蛋白表达与胃癌的关系国内外少有报道. 本研究通过检测胃癌组织中有丝分裂前期检查点CHFR基因和肿瘤抑制基因p53编码蛋白的表达状态, 探讨二者表达与胃癌发生的关系及意义.
收集2003-12/2004-05中国医科大学附属第一医院肿瘤科及辽宁省肿瘤外科手术切除胃癌标本151例, 平均年龄60岁. 术前未放化疗. 男性101例, 女性50例(其中≤50岁者18例). 临床病理分期:早期1例, 中期7例, 晚期143例. 大体Borrmann分型: Ⅰ+Ⅱ型46例, Ⅱ+Ⅳ型105例. 组织学类型(按胃癌组织学分型标准):乳头状腺癌1例; 管状腺癌124例, 其中高分化腺癌11例, 中分化腺癌38例, 低分化腺癌75例; 未分化癌2例; 印戒细胞癌7例(女性3例); 黏液腺癌17例. 151例胃癌标本中, 有相应癌旁黏膜者101例, 其中36例可观察到癌旁黏膜肠上皮化生, 4例可观察到癌旁黏膜不典型增生. 伴有淋巴结转移者118例,不伴有淋巴结转移者33例. 每例分别取癌组织、肠上皮化生、不典型增生、正常胃黏膜组织, 40 g/L甲醛固定, 石蜡包埋, 制作常规病理切片行HE染色以确定其病理诊断及目标病变定位.
利用组织芯片制作仪(美国), 根据上述定位的目标病变从组织蜡块中穿取目标组织(组织样品直径为1 mm), 构建成5个胃癌及其癌前病变的组织芯片蜡块, 行4 μm连续切片, 其中1张行常规HE染色, 其他保存备CHFR和P53蛋白免疫组化染色用. 采用GBI公司推出的免疫组化检测二步法, Immuno-Bridge+试剂盒, 鼠抗人CHFR单克隆抗体(工作浓度1∶75)和鼠抗人P53单克隆抗体分别购自Abnova公司和北京中杉金桥生物技术有限公司. 用PBS代替一抗作阴性对照. CHFR和mP53蛋白免疫染色阳性信号均定位于细胞核, 呈棕黄色颗粒, 每个标本随机观察2个有代表性的高倍视野, 每个视野计数100个细胞确定其染色强度并取平均值, 阳性细胞数≤20%为阴性(-), 阳性细胞数>20%为阳性(+).
统计学处理 利用计算机软件SPSS10.0进行数据处理, 统计方法采用χ2检验和Spearman等级相关检查. P<0.05视为有显著性统计学差异.
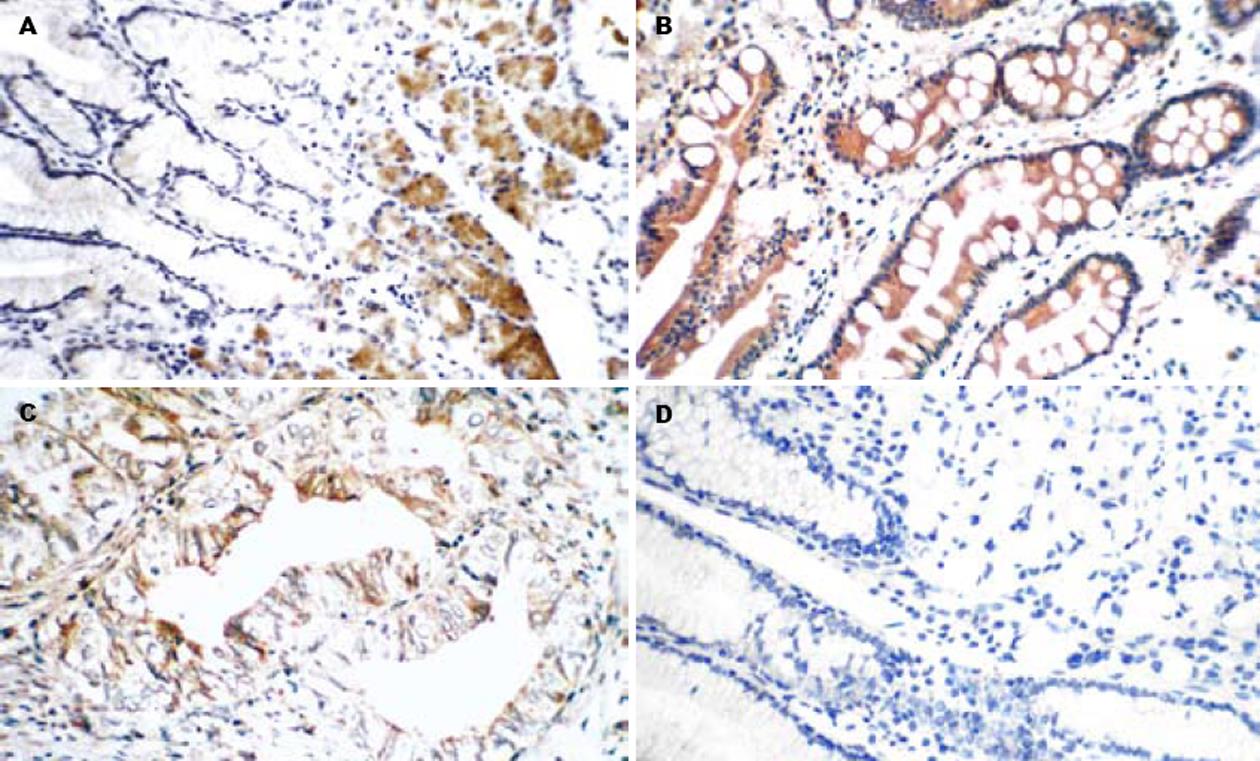
正常胃黏膜及肠上皮化生黏膜CHFR蛋白阳性表达率分别为85.25%(52/61)和100%(36/36)(图1A-B), 胃癌组织中CHFR蛋白阳性表达率(49.67%, 75/151)显著低于正常胃黏膜和肠上皮化生(图1C-D), P<0.05.不典型增生组因例数少未做统计学处理. CHFR蛋白表达与胃癌的组织学类型未见相关(P>0.05). CHFR蛋白表达阳性率在浸润局限于黏膜层及肌层组(50%, 4/8)与穿出肌层组(49.65%, 71/143)之间未见显著差异(P>0.05). Borrmann Ⅲ+Ⅳ型胃癌中CHFR蛋白阳性表达率(42.86%)显著低于Ⅰ+Ⅱ型胃癌(65.22%), P<0.05; 女性胃癌蛋白CHFR阳性表达率(36%, 18/50)显著低于男性胃癌(56.44%, 57/101) P<0.05(表1).
| 分组 | n | CHFR蛋白表达 | χ2 | P | ||
| 阴性(n) | 阳性(n) | 阳性率(%) | ||||
| 年龄 | 0.055 | >0.05 | ||||
| ≤50岁 | 39 | 19 | 20 | 51.28 | ||
| >50岁 | 112 | 57 | 55 | 49.11 | ||
| 性别 | 5.587 | <0.05 | ||||
| 女 | 50 | 32 | 18 | 36 | ||
| 男 | 101 | 44 | 57 | 56.44 | ||
| 组织性质 | 52.240 | <0.005 | ||||
| 正常胃黏膜 | 61 | 9 | 52 | 85.25 | ||
| 肠化生 | 36 | 0 | 36 | 100 | ||
| 不典型性增生 | 4 | 1 | 3 | 75 | ||
| 胃癌 | 151 | 76 | 75 | 49.67 | ||
| 胃癌 | ||||||
| 大体分型 | 6.397 | <0.05 | ||||
| I+II | 46 | 16 | 30 | 65.22 | ||
| Ⅲ+IV | 105 | 60 | 45 | 42.86 | ||
| 组织学分型 | 5.270 | >0.05 | ||||
| 乳头状腺癌 | 1 | 0 | 1 | 100 | ||
| 高分化腺癌 | 11 | 4 | 7 | 63.64 | ||
| 中分化腺癌 | 38 | 19 | 19 | 50 | ||
| 低分化腺癌 | 75 | 39 | 36 | 48 | ||
| 未分化癌 | 2 | 0 | 2 | 100 | ||
| 黏液腺癌 | 17 | 9 | 8 | 47.06 | ||
| 印戒细胞癌 | 7 | 5 | 2 | 28.57 | ||
| 侵袭深度 | 0.0003 | >0.05 | ||||
| 黏膜层、肌层 | 8 | 4 | 4 | 50 | ||
| 穿出肌层 | 143 | 72 | 71 | 49.65 | ||
| 伴淋巴结转移 | 3.296 | >0.05 | ||||
| 阳性 | 118 | 64 | 54 | 45.76 | ||
| 阴性 | 33 | 12 | 21 | 63.64 | ||
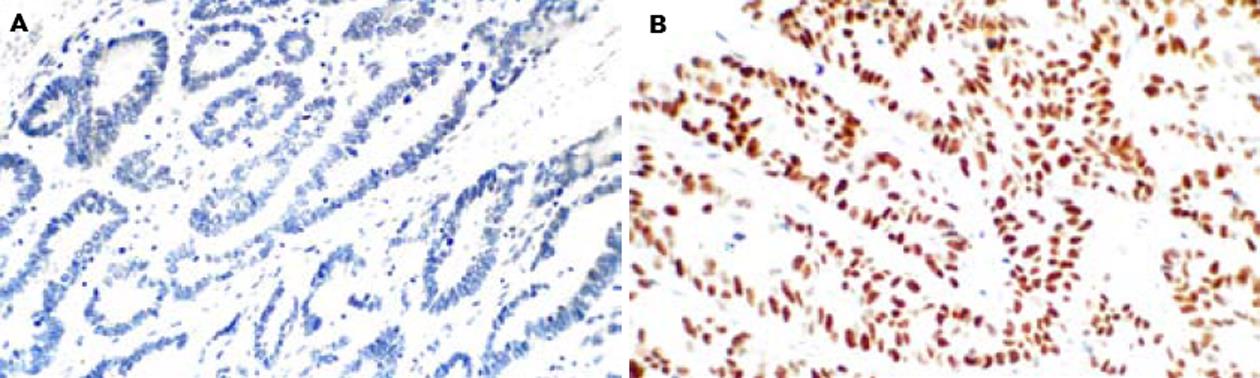
本组资料胃癌组织中mP53蛋白阳性表达率为67.42%(60/89). 44例mP53阳性胃癌中CHFR阳性率(47.73%, 21/44)高于mP53阴性组(33.33%, 10/30), 但二者之间的差异无统计学意义(χ2 = 1.518, P>0.05)(表2, 图2).
| mP53蛋白表达 | n | CHFR蛋白表达 | 阳性率(%) | χ2 | P | |
| - | + | |||||
| - | 30 | 20 | 10 | 33.33 | 1.518 | >0.05 |
| + | 44 | 23 | 21 | 47.73 | ||
| 合计 | 74 | 43 | 31 | 41.89 |
CHFR是一种新的在人类癌症中灭活的检查点基因, 在用微管毒素治疗的癌细胞中可延迟染色体浓集. 研究表明, CHFR是Plk1的泛素连接酶并且在哺乳动物细胞中, 主要通过抑制cyclin B1进入细胞核、保持Aurora A、Aurora B、plk1和cyclin B1/cdc2灭活及与p38应激激酶相互作用阻止细胞进入有丝分裂前期[10-12]. 最近, Oh et al[13]鉴定了USP7(也被称为HAUSP), 一种分解多聚泛素链和/或泛素前体并能与CHFR相互作用的蛋白. 他在体内外能去除自动泛素的CHFR的泛素部分. 导致CHFR在细胞内的积累. 这一研究结果表明USP7介导的CHFR去泛素化致其累积可能对于CHFR激活是一个关键的调节步骤, 并且在CHFR介导的细胞周期进程和肿瘤抑制的调解方面可能发挥着重要作用. CHFR在正常人组织中普遍表达, 而在人类肿瘤中发现CHFR表达缺失. 在消化道肿瘤中, CHFR表达由于CPG岛高甲基化所沉默[14-19]. Milne et al[20]研究结果显示, 在174例胃癌中CHFR蛋白表达缺失率为33%, 且其表达缺失与弥漫型胃癌显著相关(P = 0.001). 许多研究已证实, 在胃癌中CHFR基因异常甲基化是频发事件并且发现DNA甲基化与CHFR表达下调有关[21-24], 提示CHFR的DNA甲基化在胃癌中CHFR的转录沉默方面发挥着主要作用. 在胃癌中由DNA甲基化所致的CHFR灭活可能导致染色体的不稳定性. 另外, 为了探讨是否CHFR的下调直接导致肿瘤发生, Yu et al[11]制作了敲除CHFR的鼠, CHFR缺乏的鼠是易患癌症的, 产生自发性肿瘤并在用二甲基苯并蒽处理后增加皮肤肿瘤的发病生率. CHFR+/-鼠肿瘤发生率是介于CHFR+/+和CHFR-/-之间的发生率. 在CHFR-/-鼠中较高的死亡率和肿瘤发生率表明CHFR是重要的肿瘤抑制基因. CHFR在体内与Aurora A相互作用并在体内外泛素化Aurora A. 总之, 这些结果表明CHFR是一种抑癌基因, CHFR通过调解Aurora A的表达水平和维持基因组的稳定而起作用并且推断CHFR-Aurora A通路的破坏促进肿瘤发生也支持染色体不稳定在人类能导致肿瘤发生的假说. 本组研究发现, 在151例胃癌中, CHFR蛋白表达缺失率为50.33%, 胃癌组CHFR蛋白的阳性表达率明显低于正常胃黏膜及肠上皮化生组(P<0.05), 提示胃癌发生过程中CHFR蛋白表达发生了下调, 推测可能与CHFR基因缺失或突变相关, 也可能在转录水平或转录后水平受到特异地调控, 而使蛋白表达受到抑制. 但CHFR蛋白表达与胃癌的分化程度、组织学类型、肿瘤浸润深度、及淋巴结转移未见显著性差异(P>0.05), 提示CHFR蛋白表达缺失与胃癌的发生关系密切, 可能是胃黏膜癌变过程中的早期分子事件.
胃癌发病率存在年龄、性别和种族差异, 随年龄增加, 发病率也随之增加. 在50-70岁左右达高峰, 随后快速下降, 小于30岁的病倒较少. 男女性别之间胃癌发病率存在差异, 男性发病率约为女性的2倍. 但在<40岁的低年龄组中, 女性胃癌发病率却超过男性[25]. 女性胃癌的组织学以黏液腺癌, 低分化腺癌及印戒细胞癌居多; 大体分型以BorrmannⅢ型和Ⅳ型多见. 胃印戒细胞癌多起源于黏膜固有层中腺体颈部未分化干细胞, 好发于中青年女性, 大体分型以BorrmannⅢ型和Ⅳ型多见, 侵袭力强, 易在胃壁浸润性生长; 恶性度高, 易发生卵巢、子宫颈转移[26-27]. 本研究50例女性胃癌中, 年龄≤50岁的占36%(18/50); 印戒细胞癌7例(其中3例为女性), 均为BorrmannⅢ型和Ⅳ型. 低分化癌24例,黏液腺癌5例, 印戒细胞癌3例. 以往文献报道[26-28], 女性弥漫浸润型胃癌的发生发展与雌激素受体异常表达有关. 本研究发现, 在各种组织学类型胃癌中, 印戒细胞癌CHFR蛋白阳性表达率(28.57%)是最低的; 女性CHFR蛋白阳性表达率(36%)显著低于男性(56.44%), P<0.05; BorrmannⅢ+Ⅳ型CHFR蛋白阳性表达率(42.86%)显著低于Ⅰ+Ⅱ型(65.22%), P<0.05. 上述结果提示, CHFR在胃癌组织中表达的异常下调与女性弥漫浸润型胃癌的发生发展之间可能存在某种内在的联系, 但CHFR与雌激素受体水平及雌激素代谢的关系及具体机制尚有待深入探讨.
p53基因是一种抑癌基因, 分野生型和突变型. 野生型p53基因通过打开他的效应器如14-3-3S、GADD45和P21Cip1基因能抑制cdc2-cyclin B活性, 延迟DNA损伤的细胞从G2期到M期; 具有抑制癌细胞的增殖和促进癌细胞调亡的作用. 而突变型p53则相反, 具有抑制癌细胞凋亡和促进癌细胞增殖的作用, 促进组织恶性转化的活性[29-30]. p53基因异常与胃黏膜细胞的癌变过程密切相关. 胃癌组织中存在p53基因突变, 导致其编码蛋白的功能异常从而参与胃癌的发生发展[31-32]. 本组实验显示, CHFR蛋白表达在胃癌中下调或缺失, mP53蛋白表达增加. 其作用机制与细胞周期调控有关, 推测CHFR蛋白表达下调或缺失与p53突变共同参与胃癌的发生发展. 但本组研究结果CHFR与mP53蛋白表达未见明显的相关性. 说明二者的异常可能主要受不同的上游调控机制的影响, 提示CHFR基因和mp53基因可能通过不同的途径和机制参与胃癌的发生.
CHFR是一个新的有丝分裂前期检查点基因, 在一些肿瘤中存在失活或低表达, 提示其异常可能参与癌的发生. 但迄今CHFR蛋白表达与胃癌的关系少有报道. 本研究检测胃癌组织中CHFR和mP53蛋白的表达, 探讨二者异常与胃癌发生的关系及意义.
胃癌组CHFR蛋白的阳性表达率显著低于正常胃黏膜及肠上皮化生P<0.05. BorrmannⅢ+Ⅳ型胃癌中CHFR蛋白阳性表达率显著低于Ⅰ+Ⅱ型胃癌P<0.05; 女性胃癌CHFR蛋白阳性表达率显著低于男性胃癌P<0.05. 提示, CHFR基因启动区CPG岛甲基化导致其蛋白表达下调可能是胃黏膜癌变过程中的早期分子事件且与女性、弥漫浸润型胃癌发生发展的关系可能更为密切.
本文为回顾性研究, 总体设计尚可, 文中所研究的CHFR和mp53基因编码蛋白为胃癌临床诊断提供了一定参考价值.
电编: 郭海丽 编辑:张海宁
| 1. | Scolnick DM, Halazonetis TD. Chfr defines a mitotic stress checkpoint that delays entry into metaphase. Nature. 2000;406:430-435. [PubMed] [DOI] |
| 2. | Mizuno K, Osada H, Konishi H, Tatematsu Y, Yatabe Y, Mitsudomi T, Fujii Y, Takahashi T. Aberrant hypermethylation of the CHFR prophase checkpoint gene in human lung cancers. Oncogene. 2002;21:2328-2333. [PubMed] [DOI] |
| 3. | Corn PG, Summers MK, Fogt F, Virmani AK, Gazdar AF, Halazonetis TD, El-Deiry WS. Frequent hypermethylation of the 5' CpG island of the mitotic stress checkpoint gene Chfr in colorectal and non-small cell lung cancer. Carcinogenesis. 2003;24:47-51. [PubMed] [DOI] |
| 4. | Shibata Y, Haruki N, Kuwabara Y, Ishiguro H, Shinoda N, Sato A, Kimura M, Koyama H, Toyama T, Nishiwaki T. Chfr expression is downregulated by CpG island hypermethylation in esophageal cancer. Carcinogenesis. 2002;23:1695-1699. [PubMed] [DOI] |
| 5. | Corn PG, Heath EI, Heitmiller R, Fogt F, Forastiere AA, Herman JG, Wu TT. Frequent hypermethylation of the 5' CpG island of E-cadherin in esophageal adenocarcinoma. Clin Cancer Res. 2001;7:2765-2769. [PubMed] |
| 6. | Toyota M, Sasaki Y, Satoh A, Ogi K, Kikuchi T, Suzuki H, Mita H, Tanaka N, Itoh F, Issa JP. Epigenetic inactivation of CHFR in human tumors. Proc Natl Acad Sci U S A. 2003;100:7818-7823. [PubMed] [DOI] |
| 7. | Tamura G. Alterations of tumor suppressor and tumor-related genes in the development and progression of gastric cancer. World J Gastroenterol. 2006;12:192-198. [PubMed] [DOI] |
| 8. | Hofler H, Becker KF. Molecular mechanisms of carcinogenesis in gastric cancer. Recent Results Cancer Res. 2003;162:65-72. [PubMed] [DOI] |
| 9. | Xi YG, Ding KY, Su XL, Chen DF, You WC, Shen Y, Ke Y. p53 polymorphism and p21WAF1/CIP1 haplotype in the intestinal gastric cancer and the precancerous lesions. Carcinogenesis. 2004;25:2201-2206. [PubMed] [DOI] |
| 10. | Summers MK, Bothos J, Halazonetis TD. The CHFR mitotic checkpoint protein delays cell cycle progression by excluding Cyclin B1 from the nucleus. Oncogene. 2005;24:2589-2598. [PubMed] [DOI] |
| 11. | Yu X, Minter-Dykhouse K, Malureanu L, Zhao WM, Zhang D, Merkle CJ, Ward IM, Saya H, Fang G, van Deursen J. Chfr is required for tumor suppression and Aurora A regulation. Nat Genet. 2005;37:401-406. [PubMed] [DOI] |
| 12. | Matsusaka T, Pines J. Chfr acts with the p38 stress kinases to block entry to mitosis in mammalian cells. J Cell Biol. 2004;166:507-516. [PubMed] [DOI] |
| 13. | Oh YM, Yoo SJ, Seol JH. Deubiquitination of Chfr, a checkpoint protein, by USP7/HAUSP regulates its stability and activity. Biochem Biophys Res Commun. 2007;357:615-619. [PubMed] [DOI] |
| 14. | Hamilton JP, Sato F, Greenwald BD, Suntharalingam M, Krasna MJ, Edelman MJ, Doyle A, Berki AT, Abraham JM, Mori Y. Promoter methylation and response to chemotherapy and radiation in esophageal cancer. Clin Gastroenterol Hepatol. 2006;4:701-708. [PubMed] [DOI] |
| 15. | Sakai M, Hibi K, Kanazumi N, Nomoto S, Inoue S, Takeda S, Nakao A. Aberrant methylation of the CHFR gene in advanced hepatocellular carcinoma. Hepatogastroenterology. 2005;52:1854-1857. [PubMed] |
| 16. | Morioka Y, Hibi K, Sakai M, Koike M, Fujiwara M, Kodera Y, Ito K, Nakao A. Aberrant methylation of the CHFR gene is frequently detected in non-invasive colorectal cancer. Anticancer Res. 2006;26:4267-4270. [PubMed] |
| 17. | Hibi K, Nakao A. Highly-methylated colorectal cancers show poorly-differentiated phenotype. Anticancer Res. 2006;26:4263-4266. [PubMed] |
| 18. | Morioka Y, Hibi K, Sakai M, Koike M, Fujiwara M, Kodera Y, Ito K, Nakao A. Aberrant methylation of the CHFR gene in digestive tract cancer. Anticancer Res. 2006;26:1791-1795. [PubMed] |
| 19. | Brandes JC, van Engeland M, Wouters KA, Weijenberg MP, Herman JG. CHFR promoter hypermethylation in colon cancer correlates with the microsatellite instability phenotype. Carcinogenesis. 2005;26:1152-1156. [PubMed] [DOI] |
| 20. | Milne AN, Sitarz R, Carvalho R, Polak MM, Ligtenberg M, Pauwels P, Offerhaus GJ, Weterman MA. Molecular analysis of primary gastric cancer, corresponding xenografts, and 2 novel gastric carcinoma cell lines reveals novel alterations in gastric carcinogenesis. Hum Pathol. 2007;38:903-913. [PubMed] [DOI] |
| 21. | Homma N, Tamura G, Honda T, Jin Z, Ohmura K, Kawata S, Motoyama T. Hypermethylation of Chfr and hMLH1 in gastric noninvasive and early invasive neoplasias. Virchows Arch. 2005;446:120-126. [PubMed] [DOI] |
| 22. | Koga Y, Kitajima Y, Miyoshi A, Sato K, Sato S, Miyazaki K. The significance of aberrant CHFR methylation for clinical response to microtubule inhibitors in gastric cancer. J Gastroenterol. 2006;41:133-139. [PubMed] [DOI] |
| 23. | Yoshida K, Hamai Y, Suzuki T, Sanada Y, Oue N, Yasui W. DNA methylation of CHFR is not a predictor of the response to docetaxel and paclitaxel in advanced and recurrent gastric cancer. Anticancer Res. 2006;26:49-54. [PubMed] |
| 24. | Kang HC, Kim IJ, Park JH, Shin Y, Park HW, Ku JL, Yang HK, Lee KU, Choe KJ, Park JG. Promoter hypermethylation and silencing of CHFR mitotic stress checkpoint gene in human gastric cancers. Oncol Rep. 2004;12:129-133. [PubMed] [DOI] |
| 25. | Kelley JR, Duggan JM. Gastric cancer epidemiology and risk factors. J Clin Epidemiol. 2003;56:1-9. [PubMed] [DOI] |
| 26. | Yang XF, Yang L, Mao XY, Wu DY, Zhang SM, Xin Y. Pathobiological behavior and molecular mechanism of signet ring cell carcinoma and mucinous adenocarcinoma of the stomach: a comparative study. World J Gastroenterol. 2004;10:750-754. [PubMed] [DOI] |
| 27. | Tokunaga A, Kojima N, Andoh T, Matsukura N, Yoshiyasu M, Tanaka N, Ohkawa K, Shirota A, Asano G, Hayashi K. Hormone receptors in gastric cancer. Eur J Cancer Clin Oncol. 1983;19:687-689. [PubMed] [DOI] |
| 28. | Zhao XH, Gu SZ, Liu SX, Pan BR. Expression of estrogen receptor and estrogen receptor messenger RNA in gastric carcinoma tissues. World J Gastroenterol. 2003;9:665-669. [PubMed] [DOI] |
| 29. | Semenza GL. VHL and p53: tumor suppressors team up to prevent cancer. Mol Cell. 2006;22:437-439. [PubMed] [DOI] |
| 30. | Watanabe T, Katayama Y, Yoshino A, Komine C, Yokoyama T. Deregulation of the TP53/p14ARF tumor suppressor pathway in low-grade diffuse astrocytomas and its influence on clinical course. Clin Cancer Res. 2003;9:4884-4890. [PubMed] |
| 31. | Nishikura K, Watanabe H, Iwafuchi M, Fujiwara T, Kojima K, Ajioka Y. Carcinogenesis of gastric endocrine cell carcinoma: analysis of histopathology and p53 gene alteration. Gastric Cancer. 2003;6:203-209. [PubMed] [DOI] |
| 32. | Gonda G, Bajtai A, Nagy P, Szanto I, Kiss J. Quantitative analysis of p53 expression and cell proliferation in gastric carcinomas. An immunohistochemical study. Hepatogastroenterology. 2004;51:273-276. [PubMed] |