修回日期: 2007-02-01
接受日期: 2007-02-13
在线出版日期: 2007-05-18
目的: 探讨真核表达载体pcDNA3-CTLA4Ig转染受体小鼠肌细胞后对胰岛移植后排斥反应的影响.
方法: 受体C57BL/6小鼠随机分为对照组、空白转染组和实验组(转染pcDNA3-CTLA4Ig). Western blot检测受体小鼠血清CTLA4-Ig表达, 观察移植物存活时间, 术后7 d取受体肾脏做HE染色及胰岛素免疫组化染色, 采用微量全血3H-胸腺嘧啶掺入法检测单个核细胞在刀豆蛋白A刺激下的增殖程度, 流式细胞仪检测外周血T细胞亚群表达情况.
结果: 受体小鼠转染5 d后, Western blot检测到血清内有CTLA4Ig表达, 转染效率为27.50%; 实验组小鼠血糖维持正常时间明显延长(P<0.05); 术后7 d, 转染组单个核细胞在刀豆蛋白刺激下的增殖程度明显降低(P<0.05), CD4+、CD8+ T淋巴细胞表达与对照组和空白转染组相比有显著差异差异(CD4+: 14.38%±0.84% vs 20.56%±0.68%, 21.04%±1.14%, P<0.05; CD8+: 14.77%±0.92% vs 24.63%±1.30%, 23.84%±1.21%, P<0.05), 小鼠肾被膜下胰岛素免疫组化染色强度明显增高.
结论: 利用脂质体法可将pcDNA3-CTLA4Ig转染到活体小鼠肌细胞内并在小鼠体内表达CTLA4Ig, 从而阻断B7/CD28共刺激信号途径, 抑制胰岛移植术后排斥反应.
引文著录: 赵国华, 孙宏治, 钟鑫平, 张金祥, 许国岩, 赵宁, 程颖, 张佳林, 刘永锋. 真核表达载体pcDNA3-CTLA4Ig转染小鼠对移植胰岛功能的影响. 世界华人消化杂志 2007; 15(14): 1596-1601
Revised: February 1, 2007
Accepted: February 13, 2007
Published online: May 18, 2007
AIM: To study the effect of pcDNA3-CTLA4Ig plasmid on islet allograft rejection in mice.
METHODS: C57BL/6 mice were randomly divided into control group, blank group and experiment group (transfected with pcDNA3-CTLA4Ig plasmid). The level of serum CTLA4Ig was detected by Western blot on day 5 after transfection. Blood glucose was examined after operation every other day. Immunohistochemical staining was used to determine the expression of insulin. 3H-thymidine incorporation was performed to detect the ability of T lymphocyte increment and the levels of CD4+ and CD8+ T lymphocytes were detected by flow cytometry on day 7 after transplantation.
RESULTS: Five days after transfection, Western blot demonstrated serum expression of CTLA4Ig, and the transfection efficacy was 27.50%. Blood glucose maintained at the normal level for a longer period of time in the experiment group, and on day 7, the proliferation of lymphocytes was markedly decreased (P < 0.05). The levels of CD4+ and CD8+ T lymphocytes were significantly lower in the experiment group than those in the control and blank group (CD4+: 14.38% ± 0.84% vs 20.56% ± 0.68%, 21.04% ± 1.14%, P < 0.05; CD8+: 14.77% ± 0.92% vs 24.63% ± 1.30%, 23.84% ± 1.21%, P < 0.05), and the intensity of immunohistochemical staining was also stronger.
CONCLUSION: CTLA4 gene can be transferred into mouse muscular cells by cation liposome and express its products in the serum, which leads to the inhibition of islet allograft rejection by the blockage of B7/CD28 signal pathway.
- Citation: Zhao GH, Sun HZ, Zhong XP, Zhang JX, Xu GY, Zhao N, Cheng Y, Zhang JL, Liu YF. Preventive effect of pcDNA3-CTLA4Ig plasmid transfection on islet allograft rejection in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(14): 1596-1601
- URL: https://www.wjgnet.com/1009-3079/full/v15/i14/1596.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i14.1596
胰岛移植是治疗糖尿病的有效手段之一, 但目前临床开展并不理想, 主要原因是免疫排斥反应[1-5]. 阻断CD28/B7共刺激通路是一个较为理想的无胰岛毒性的特异性免疫抑制方案[6-10]. 本实验观察真核表达载体pcDNA3-CTLA4Ig是否可以转染受体小鼠肌细胞, 并在小鼠血清中表达CTLA4Ig, 从而抑制受者胰岛移植后的排斥反应.
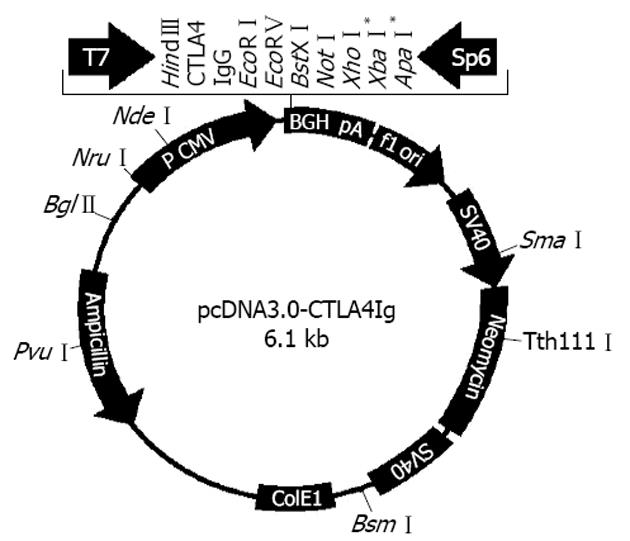
供体为BALB/C小鼠, 受体为C57BL/6小鼠, 体质量30±2 g, 年龄8-10周龄, 均为♀, 购自中国医科大学实验动物中心. 随机分为3组, 每组10只. 对照组: 仅进行胰岛移植, 不进行质粒转染; 空白转染组: 将胰岛移植入空质粒pcDNA3转染的小鼠肾被膜下; 实验组: 将胰岛移植入质粒pcDNA3-CTLA4Ig转染的小鼠肾被膜下. 质粒pcDNA3-CTLA4Ig由大连博瑞德生物工程公司构建(质粒结构见图1). 质粒快速大量提取试剂盒购自V-gene生物公司, 阳性脂质体Lipofectamine2000转染试剂盒购自Invitrogen公司. 胶原酶Ⅴ型(C-9263)、双硫腙(dithizone, DTZ)、链脲霉素(streptozotocin, STZ)、Ficoll-400均购自Sigma公司. 抗胰岛素抗体购自博士德公司, 即用型第二代免疫组化SP试剂盒、DAB显色剂购自迈新公司. 3H-TdR购自北京原子能研究所. fluorescein isothiocynate(FITC)标记的CD4和CD8 mAb、Phycoerythrin(PE)标记的CD3 mAb均购自San Diego公司.
1.2.1 pcDNA3-CTLA4Ig扩增、纯化和鉴定: 将质粒与感受态菌按2 μL∶1 ng的比例混合, 42℃水浴90 s. 而后迅速冰浴, 接种于含有100 mg/L氨苄青霉素的LB液体培养基中, 37℃振荡培养过夜, 收集菌液, 采用无内毒素质粒快速大量提取试剂盒大量抽提质粒. 具体操作步骤参见说明书. 经收集、裂解、层析和洗脱后, 回收质粒. 紫外分光光度仪检测DNA纯度和浓度, 调整浓度为0.5 g/L, 4℃储存备用.
1.2.2 pcDNA3-CTLA4Ig转染小鼠: 用阳性脂质体载体Lipofectamine将pcDNA3-CTLA4Ig包裹(超声法混匀)后, 按lipofectamine(10 μL)与 pcDNA3-CTLA4Ig(4 μg)的混匀液注入小鼠右侧大腿肌肉组织.
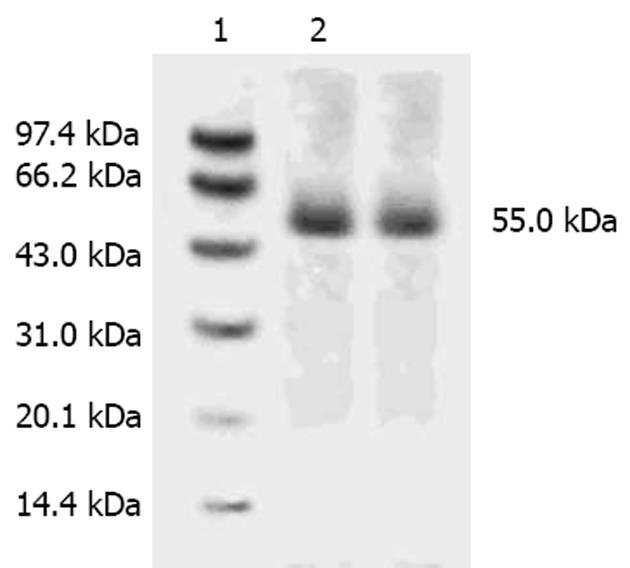
1.2.3 Western blot检测血清CTLA4Ig水平: 注射5 d后, 取受体小鼠静脉血0.2 mL, 抗凝后离心取上清, 做SDS-PAGE电泳. 取出凝胶置于硝酸纤维素膜上, 用BioRad公司的蛋白质转印系统在转移缓冲液(5 mmol/L Tris, 250 mmol/L甘氨酸, 1 g/L SDS)中, 电泳转印(50 V, 2 h左右). 转印完毕用TBS浸泡10 min, 将膜用TTBS(含50 g/L脱脂奶粉的TBS)室温下封闭1 h, 用TTBS洗膜2次, 每次5 min. 洗膜后, 一抗4℃过夜(1∶250), TTBS洗5 min 2次 . 二抗2 h(1∶2000), TTBS洗5 min 2次. 加入底物, 反应显色, 分析结果. 连续2次血清呈阳性表达者视为转染成功.
1.2.4 小鼠糖尿病模型的建立: 受体小鼠腹腔内注射20 g/L链脲霉素140 mg/kg(Sigma), 注射后2-3 d查空腹血糖, 如连续3 d血糖>16.8 mmol/L, 模型建立.
1.2.5 小鼠胰岛分离和纯化: 供体小鼠10 g/L戊巴比妥4 mL/kg腹腔内注射麻醉, 固定, 开腹, 胰管内灌注冷却胶原酶溶液3-5 mL(胶原酶V型, 1.5 g/L, Sigma), 使胰腺均匀膨胀后迅速取出, 置于盛有5 mL冷胶原酶溶液的容器中, 38±1℃水浴静止消化, 12-15 min后加入冷却Hanks液20 mL终止消化, 1000 r/min离心3 min, 弃上清, 同法洗涤2次后, 400 μm钢网滤过, 沉淀物行Ficoll不连续密度梯度离心. Ficoll梯度离心柱浓度自下而上依次为250, 230, 205, 110 g/L. 4℃ 2000 r/min离心10 min, 收集230, 110 g/L层间的胰岛悬液. 再用无菌RPMI1640培养液离心漂洗2次, 于倒置显微镜下作平板计数.
1.2.6 胰岛移植: 受体小鼠麻醉后, 俯卧位固定经右侧脊柱旁切口暴露右侧肾脏, 于被膜下注入胰岛悬液0.3 mL(约含150胰岛当量), 并作标记.
1.2.7 血糖监测: 术后非空腹血糖连续2 d高于11.2 mmol/L, 以第一时间作为移植物受排斥、功能丧失发生的时间, 观察移植胰岛的有功能存活时间.
1.2.8 外周血单个核细胞(PBMC)增殖反应试验: 术后第7天, 实验各组动物分别取静脉血0.2 mL, 10 mg/L刀豆蛋白A作为刺激剂, 微量全血3H-胸腺嘧啶(3H-TdR)掺入法检测单个核细胞增殖程度, 液体闪烁计数仪监测单个核细胞转化后的闪烁计数值.
1.2.9 CD4+, CD8+ T细胞表达情况: 应用流式细胞仪检测移植术后第7天CD4+和CD8+ T淋巴细胞的表达. 重复管加入PE-anti-CD3抗体、FITC-anti-CD4 mAb和PE-anti-CD8 mAb, 对照管加入PE-羊抗鼠-Ig, 进行免疫标记反应. 4℃ 30 min, 离心(1000 r/min, 5 min), 弃上清液, 沉淀中加入5 mL PBS液, 离心(1000 r/min, 5 min), 重复洗涤1次, 流式细胞仪进行检测.
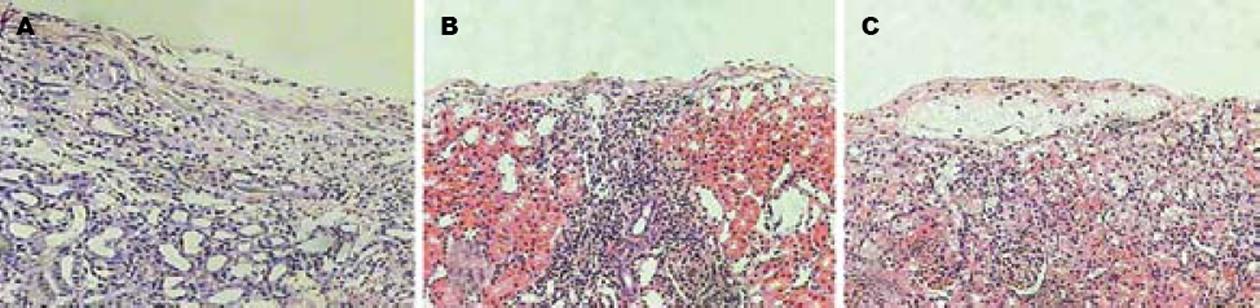
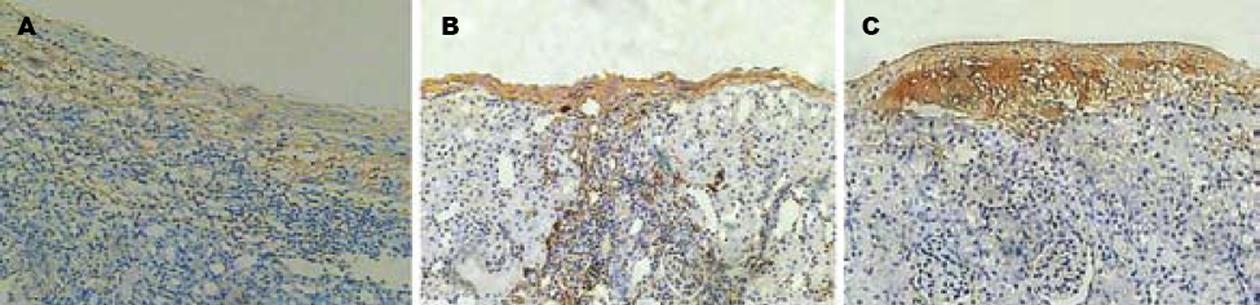
1.2.10 病理组织学检查: 术后第7天, 分别切取受者小鼠移植局部组织适量, 先做HE染色. 然后40 g/L甲醛固定, 常规石蜡包埋, 连续切片, 微波抗原修复(92-100℃, 3 min), 50 μL 130 mL/L过氧化氢孵育10 min, 50 μL抗Insulin-Ab(1∶100, 4℃孵育过夜. 50 μL聚合物增强剂(A液), 室温下孵育20 min. 50 μL酶标抗鼠聚合物(B液)室温下孵育30 min, 加入新鲜配置的DAB液, 显微镜下观察3-10 min, 冲洗后苏木素复染. 常规脱水透明及封片.
统计学处理 所得数据以mean±SD表示, 采用方差分析(其中血糖维持正常时间以mean±SE表示, 采用Kruskal-Wallis Test), 所得数据均经SPSS11.5处理, P<0.05为差异有统计学意义.
对含有pcDNA3-CTLA4Ig质粒的LB菌液进行鉴定测序, 目的基因片段大小为694 bp, 测序结果与GenBank上公布的序列完全吻合, 证明质粒构建正确.
受体小鼠转染5 d后, SDS-PAGE和Western blot结果显示, 在相对分子质量为55 kDa处出现单一的目的蛋白条带(图2). 转染40只小鼠, 有11只转染成功, 血清内稳定表达CTLA4Ig, 转染效率为27.50%.
对照组受体小鼠于胰岛移植后3 d血糖恢复正常, 但在4-8 d时发生排斥, 移植物平均存活时间为6.00±0.16 d. 空白转染组受体小鼠血糖变化与对照组相同, 移植物平均存活时间为5.00±0.45 d, 两组比较存活时间没有显著性差异(P>0.05). 转染组于移植后3 d血糖恢复正常, 之后血糖维持正常水平的时间较前两组明显延长, 移植物平均存活时间为19.00±1.10 d, 与对照组和空白转染组比较, 移植物存活时间有显著性差异(P<0.05).
移植术后7 d, 对照组、空白转染组和转染组T淋巴细胞增殖实验显示, 3H-TdR放射性闪烁计数值(cpm)均值分别为250.925±3.189, 249.664±5.937, 177.219±3.412次/min. 空白转染组和对照组比较, 转化率没有显著性差异(P>0.05), 而转染组与前两组比较, 转化率有显著性差异(P<0.05).
术后第7天, 实验各组CD4+, CD8+ T淋巴细胞平均荧光阳性百分率如表1. 空白转染组和对照组比较, 阳性百分率没有显著性差异(P>0.05), 而转染组与前两组比较, 阳性百分率有显著性差异(P<0.05).
转染组小鼠肾被膜下可见有成团的核深染细胞, 核深染、胞质较少, 排列成团但并不形成管腔, 也不具备肾小球的囊壁结构, 周边可见少量的淋巴细胞浸润. 对照组和空白转染组也可见类似结构, 但细胞团中心细胞很少, 周边有大量的淋巴细胞浸润. 转染组小鼠肾被膜下可见上述细胞团染成棕黄色, 呈颗粒状, 证实为有功能的胰岛. 而对照组和空白转染组上述细胞团仅有少量细胞染成棕黄色, 证明上述细胞是移植胰岛但功能丧失(图3-4).
胰岛移植与胰腺移植相比具有手术简单、并发症少、可重复性好、对全身干预小等优点, 但移植术后排斥反应制约了胰岛移植的进一步开展和应用. 现代免疫学研究进展表明[11-16], 共刺激信号系统在同种异体移植排斥反应中起了重要的作用, 而最重要的一组共同刺激分子是B7/CD28, 如果阻断B7与受体相结合, 抑制第二信号的产生, 将可能导致T细胞的克隆失活或克隆无反应, 诱导免疫耐受[17-20].
CTLA4Ig是B7/CD28共刺激信号的特异性阻断剂. 体内、外实验表明[21-25], CTLA4Ig有很强的免疫抑制作用, 应用CTLA4Ig封闭B7/CD28后, 对心脏、肾脏、肝脏、脾、骨髓、肺脏、角膜和皮肤等同种移植物有明显的保护作用. 因此, 应用CTLA4Ig阻断CD28/B7共刺激通路是一个较为理想的无胰岛毒性免疫抑制方案和潜在的诱导免疫耐受方案. 以往的实验基本都是应用CTLA4Ig在体内来直接封闭B7, 而CTLA4Ig的制备过程本身就比较复杂, 价格比较昂贵, 而且应用CTLA4Ig注射本身存在着单克隆抗体生物活性降低、血浆药物浓度不稳定等问题. 近年来, 随着分子生物学的发展, 基因合成和基因转染技术的成熟为细胞长期稳定表达某种特殊基因产物提供了可能, 可以人为地合成某种特定基因, 然后转染实验个体, 最终达到治疗目的[26-28]. Chahine et al[29]和O'Rourke et al[30]分别将含CTLA4Ig的cDNA转染至离体培养的肌细胞和树突状细胞中, 再与胰岛细胞共同移植于小鼠肾被囊下, 观察到肌细胞和树突状细胞作为基因库在移植原位不断表达CTLA4Ig, 且作用于移植物, 明显延长了移植物的存活时间.
在本实验中, 由于胰岛本身是一种不具有分化能力的细胞, 一般的转染效率很低, 而且直接转染胰岛本身还存在影响胰岛功能的潜在危险, 所以本实验不以胰岛细胞作为直接的靶细胞, 而采用直接转染受体小鼠肌细胞的方法, 取得了良好的转染效果, 转染40只小鼠, 11只稳定表达CTLA4Ig, 转染成功率为27.50%. 也有实验成功的利用腺病毒载体和改良HIV病毒的Lenti病毒载体转染胰岛, 但病毒载体存在一些潜在的危险, 如在宿主体内过度复制, 对机体基因组DNA产生不良影响等. 因此我们采用了质粒真核表达载体, 在不增加异种抗原的基础上获得了满意的转染效果, 又避免了腺病毒载体可能对宿主基因造成的不良影响. 本实验利用的脂质体转染、直接肌肉注射的方法, 具有操作简便、广谱和高效的特点, 应用Western blot方法检测血清中CTLA4Ig水平, 与以往的双抗体夹心酶联免疫吸附实验(ELISA)相比, 具有简便易行, 价格便宜的特点, 而且结果不受相关因素的影响.
本实验中, 转染组受体小鼠血糖维持正常时间及移植物存活时间均明显延长, T淋巴细胞转化率明显降低, CD4+和CD8+ T淋巴细胞平均荧光阳性百分率明显下降. 免疫组化染色结果显示, 转染组小鼠肾被膜下胰岛素颗粒染色强度明显增强, 说明排斥反应受到了明显的抑制.
本实验通过构建的真核表达载体pcDNA3-CTLA4Ig转染小鼠肌细胞, 在小鼠血清中成功的表达了CTLA4Ig, 抑制了同种异体胰岛移植排斥反应, 诱导小鼠自身的免疫耐受状态, 提高了胰岛移植的成功率, 为诱导移植免疫耐受提供了新的途径.
胰岛移植排斥反应是由MHCⅡ类分子介导的. 与胰腺移植相比具有手术简单、并发症少、可重复性好、对全身干预小等优点, 但移植术后排斥反应制约了胰岛移植的进一步开展和应用. 现代免疫学研究进展表明, 共刺激信号系统在同种异体移植排斥反应中起了重要的作用, 而最重要的一组共同刺激分子是B7/CD28, 如果阻断B7与受体相结合, 抑制第二信号的产生, 将可能导致T细胞的克隆失活或克隆无反应, 诱导免疫耐受.
相关文献在阻断CD28分子方面已经有较多的研究报道, 比如在心脏、肝脏、肾脏、角膜以及皮肤等方面, 均取得了一定的抑制排斥反应效果.
在本实验中, 由于胰岛本身是一种不具有分化能力的细胞, 一般的转染效率很低, 而且直接转染胰岛本身还存在影响胰岛功能的潜在危险, 所以本实验不以胰岛细胞作为直接的靶细胞, 而采用直接转染受体小鼠肌细胞的方法, 取得了良好的转染效果. 本实验利用的脂质体转染、直接肌肉注射的方法, 具有操作简便、广谱和高效的特点, 应用Western blot方法检测血清中CTLA4Ig水平, 与以往的双抗体夹心酶联免疫吸附实验(ELISA)相比, 具有简便易行, 价格便宜的特点, 而且结果不受相关因素的影响.
通过阻断CD28诱导胰岛移植后免疫耐受, 有可能达到真正的免疫耐受状态, 较以往任何一种抗排斥方法或阻断途径都有更大更广的应用前景.
共刺激信号: 是T淋巴细胞活化过程中的一组必需因子, 包括T细胞表面因子及其配体. CD28表达在T细胞表面, 其配体是B7, 表达在抗原递呈细胞表面.
本文通过构建真核表达载体pcDNA3-CTLA4-Ig转染小鼠肌细胞, 在小鼠血清中成功地表达了CTLA4Ig, 抑制了同种异体排斥反应, 提高了胰岛移植的成功率, 为临床诱导移植免疫耐受性提供了新的途径.
编辑: 张焕兰 电编:张敏
| 1. | Berney T, Ricordi C. Islet cell transplantation: the future? Langenbecks Arch Surg. 2000;385:373-378. [PubMed] [DOI] |
| 2. | Berney T, Buhler L, Caulfield A, Oberholzer J, Toso C, Alejandro R, Cooper DK, Ricordi C, Morel P. Transplantation of islets of Langerhans: new developments. Swiss Med Wkly. 2001;131:671-680. [PubMed] |
| 3. | Lenschow DJ, Zeng Y, Thistlethwaite JR, Montag A, Brady W, Gibson MG, Linsley PS, Bluestone JA. Long-term survival of xenogeneic pancreatic islet grafts induced by CTLA4lg. Science. 1992;257:789-792. [PubMed] [DOI] |
| 4. | Pearson TC, Alexander DZ, Winn KJ, Linsley PS, Lowry RP, Larsen CP. Transplantation tolerance induced by CTLA4-Ig. Transplantation. 1994;57:1701-1706. [PubMed] [DOI] |
| 5. | Odorico JS, Sollinger HW. Technical and immunosuppressive advances in transplantation for insulin-dependent diabetes mellitus. World J Surg. 2002;26:194-211. [PubMed] [DOI] |
| 6. | Miyamoto M. Current progress and perspectives in cell therapy for diabetes mellitus. Hum Cell. 2001;14:293-300. [PubMed] |
| 7. | Hoffmann F, Zhang EP, Pohl T, Kunzendorf U, Wachtlin J, Bulfone-Paus S. Inhibition of corneal allograft reaction by CTLA4-Ig. Graefes Arch Clin Exp Ophthalmol. 1997;235:535-540. [PubMed] [DOI] |
| 9. | Kirk AD, Harlan DM, Armstrong NN, Davis TA, Dong Y, Gray GS, Hong X, Thomas D, Fechner JH Jr, Knechtle SJ. CTLA4-Ig and anti-CD40 ligand prevent renal allograft rejection in primates. Proc Natl Acad Sci U S A. 1997;94:8789-8794. [PubMed] [DOI] |
| 10. | Gainer AL, Korbutt GS, Rajotte RV, Warnock GL, Elliott JF. Expression of CTLA4-Ig by biolistically transfected mouse islets promotes islet allograft survival. Transplantation. 1997;63:1017-1021. [PubMed] [DOI] |
| 11. | Schowalter DB, Meuse L, Wilson CB, Linsley PS, Kay MA. Constitutive expression of murine CTLA4Ig from a recombinant adenovirus vector results in prolonged transgene expression. Gene Ther. 1997;4:853-860. [PubMed] [DOI] |
| 12. | Ferretti G, Felici A, Pino MS, Cognetti F. Does CTLA4 influence the suppressive effect of CD25+CD4+ regulatory T cells? J Clin Oncol. 2006;24:5469-5470. [PubMed] [DOI] |
| 13. | Bugeon L, Wong KK, Rankin AM, Hargreaves RE, Dallman MJ. A negative regulatory role in mouse cardiac transplantation for a splice variant of CD80. Transplantation. 2006;82:1334-1341. [PubMed] [DOI] |
| 14. | Jen KY, Jain VV, Makani S, Finn PW. Immuno-modulation of allergic responses by targeting costimulatory molecules. Curr Opin Allergy Clin Immunol. 2006;6:489-494. [PubMed] [DOI] |
| 15. | Chen Z, Stockton J, Mathis D, Benoist C. Modeling CTLA4-linked autoimmunity with RNA interference in mice. Proc Natl Acad Sci U S A. 2006;103:16400-16405. [PubMed] [DOI] |
| 16. | Li S, Salgar SK, Thanikachalam M, Murdock AD, Gammie JS, Demetris AJ, Zeevi A, Pham SM. CTLA4-Ig-based conditioning regimen to induce tolerance to cardiac allografts. J Surg Res. 2006;136:238-246. [PubMed] [DOI] |
| 17. | Chandraker A, Huurman V, Hallett K, Yuan X, Tector AJ, Park CH, Lu E, Zavazava N, Oaks M. CTLA-4 is important in maintaining long-term survival of cardiac allografts. Transplantation. 2005;79:897-903. [PubMed] [DOI] |
| 18. | Li W, Zheng XX, Kuhr CS, Perkins JD. CTLA4 engagement is required for induction of murine liver transplant spontaneous tolerance. Am J Transplant. 2005;5:978-986. [PubMed] [DOI] |
| 19. | Thiel MA, Steiger JU, O'Connell PJ, Lehnert AM, Coster DJ, Williams KA. Local or short-term systemic costimulatory molecule blockade prolongs rat corneal allograft survival. Clin Experiment Ophthalmol. 2005;33:176-180. [PubMed] [DOI] |
| 20. | Wu G, Pfeiffer S, Schroder C, Zhang T, Nguyen BN, Lea W, Kelishadi S, Atkinson JB, Schuurman HJ, White DJ. Co-stimulation blockade targeting CD154 and CD28/B7 modulates the induced antibody response after a pig-to-baboon cardiac xenograft. Xenotransplantation. 2005;12:197-208. [PubMed] [DOI] |
| 21. | Watanabe T, Miyatake T, Kumamoto H, Mafune N, Kubota S, Okamoto H, Murashita T, Uede T, Yasuda K. Adenovirus-mediated CTLA4 immunoglobulin G gene therapy in cardiac xenotransplantation. Transplant Proc. 2004;36:2478-2479. [PubMed] [DOI] |
| 22. | Lee EN, Kim EY, Lee J, Lee HJ, Lee KW, Joh JW, Lee SK, Lee DS, Lee HH, Kim SJ. Changes n expression of T-cell activation-related molecules and cytokines during tolerance induction in an allogeneic skin transplantation murine model. Transplant Proc. 2004;36:2425-2428. [PubMed] [DOI] |
| 23. | Shirasugi N, Emmanouilidis N, Pearson TC, Larsen CP. Ability of donor splenocytes with costimulation blockade to induce mixed hematopoietic chimerism and transplantation tolerance. Transplant Proc. 2004;36:2423-2424. [PubMed] [DOI] |
| 24. | Fernandes JR, Duvivier-Kali VF, Keegan M, Hollister-Lock J, Omer A, Su S, Bonner-Weir S, Feng S, Lee JS, Mulligan RC. Transplantation of islets transduced with CTLA4-Ig and TGFbeta using adenovirus and lentivirus vectors. Transpl Immunol. 2004;13:191-200. [PubMed] |
| 25. | Chen Z, Lu L, Li J, Xiao X, Fung JJ, Qian S. Prolonged survival of heart allografts transduced with AAV-CTLA4Ig. Microsurgery. 2003;23:489-493. [PubMed] [DOI] |
| 26. | Guo L, Fujino M, Kimura H, Funeshima N, Kitazawa Y, Harihara Y, Tezuka K, Makuuchi M, Suzuki S, Li XK. Simultaneous blockade of co-stimulatory signals, CD28 and ICOS, induced a stable tolerance in rat heart transplantation. Transpl Immunol. 2003;12:41-48. [PubMed] [DOI] |
| 27. | Stell D, Marshall H, Bradley JA, Bolton EM. CTLA4-Ig abrogates the anti-globulin response and prolongs cardiac allograft survival after anti-CD2 treatment. Transpl Immunol. 2003;12:1-7. [PubMed] [DOI] |
| 28. | Ansari MJ, Abdi R. Emerging immunomodulatory therapies targeting the co-stimulatory pathways or the prevention of transplant rejection. IDrugs. 2003;6:964-969. [PubMed] |
| 29. | Chahine AA, Yu M, McKernan MM, Stoeckert C, Lau HT. Immunomodulation of pancreatic islet allografts in mice with CTLA4Ig secreting muscle cells. Transplantation. 1995;59:1313-1318. [PubMed] [DOI] |
| 30. | O'Rourke RW, Kang SM, Lower JA, Feng S, Ascher NL, Baekkeskov S, Stock PG. A dendritic cell line genetically modified to express CTLA4-IG as a means to prolong islet allograft survival. Transplantation. 2000;69:1440-1446. [PubMed] [DOI] |