修回日期: 2007-02-01
接受日期: 2007-03-31
在线出版日期: 2007-05-18
目的: 探讨人末梢血扩增的γδT细胞对常见的消化系统肿瘤细胞株的杀伤作用.
方法: 用含IPP和IL-2的RPMI 1640培养基扩增人外周血γδT细胞, 用流式细胞术检测培养10 d的γδT细胞的纯度. 用扩增后的γδT细胞与人胃癌细胞株、胰腺癌细胞株和肝癌细胞株按不同效靶比例孵育后进行细胞毒活性测定.
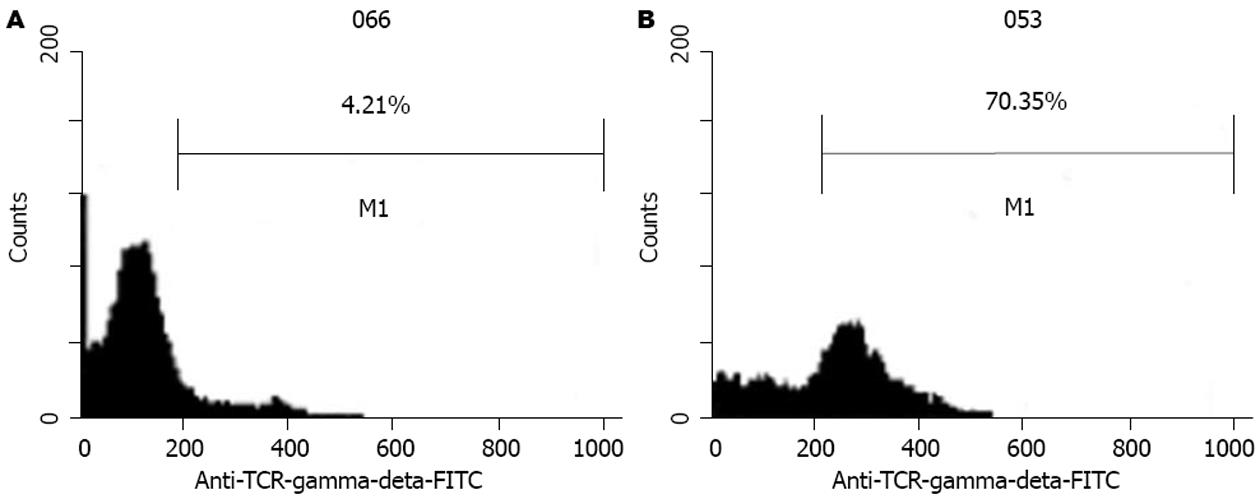
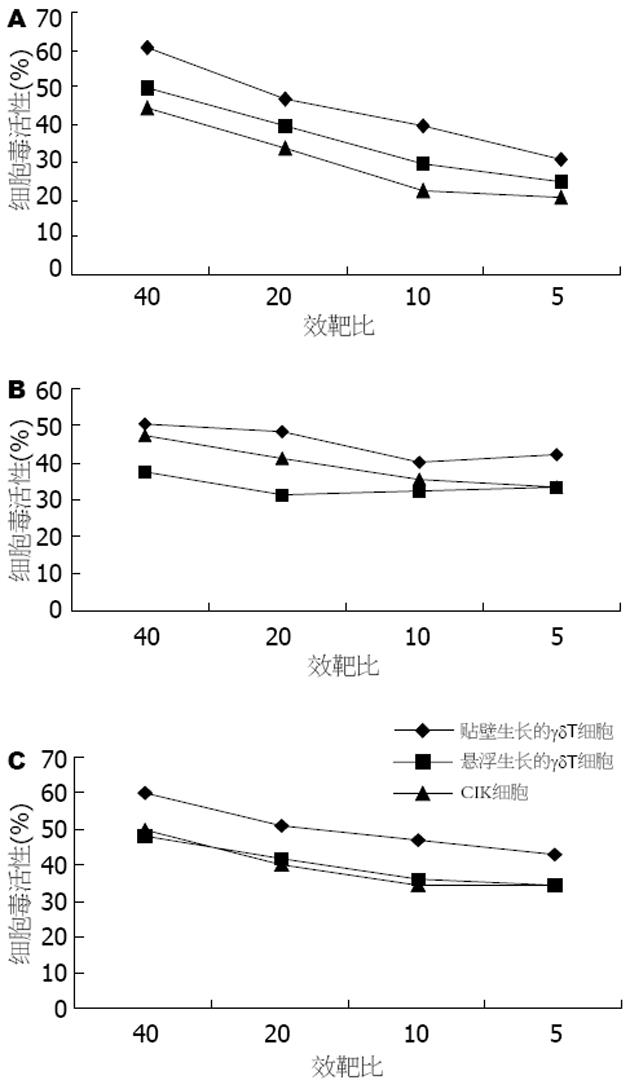
结果: 人末梢血单个核细胞经过培养扩增10 d时γδT细胞迅速从4.21%扩增到70.35%. 培养10 d时贴壁生长的γδT细胞对人胃癌细胞株、胰腺癌细胞株和肝癌细胞株均有较强的杀伤活性, 在效靶比例为40∶1时细胞毒活性分别为61%、50%和59%, 高于悬浮生长的γδT(分别为50%、37%和37%)和CIK(分别为45%、34%和40%)细胞毒活性.
结论: 人末梢血扩增的γδT细胞对消化系统常见的肿瘤细胞有较强的杀伤作用, 贴壁生长的γδT细胞对肿瘤细胞的杀伤作用强于悬浮生长的γδT细胞和CIK细胞. γδT细胞将是肿瘤细胞免疫治疗中又一类重要的免疫效应细胞.
引文著录: 陈复兴, 刘军权, 冯霞, 王涛, 张娟, 张颂, 陈桂林. 人末梢血γδT细胞对消化系统肿瘤细胞的杀伤作用. 世界华人消化杂志 2007; 15(14): 1591-1595
Revised: February 1, 2007
Accepted: March 31, 2007
Published online: May 18, 2007
AIM: To investigate the cytotoxic effects of human peripheral blood γδT cells on the tumor cell lines of digestive system.
METHODS: The γδT cells in peripheral blood of healthy volunteers were expanded using interleukin-2 (IL-2) and isopentenyl pyrophodphate (IPP) in PRMI 1640 medium. After 10 days, the purity of γδT cells was analyzed by flow cytometry. The cytotoxic activity of the purified γδT cells against human gastric cancer cells, pancreatic carcinoma cells and hepatocellular carcinoma cells were tested in different effector-to-target ratios.
RESULTS: After peripheral blood mononuclear cells were cultured for 10 days, the γδT cells were expanded rapidly from 4.21% to 70.35%. Cytotoxic activities of the purified γδT cells against human gastric cancer cells, pancreatic carcinoma cells and hepatocellular carcinoma cells were 61%, 50% and 59% respectively at the effecter-to-target cell ratio of 40∶1. The cytotoxic activities of the attached γδT cells on tumor cells were higher than those of the suspended γδT (50%, 37% and 37%, respectively) and CIK (45%, 34% and 40%, respectively) cells.
CONCLUSION: The purified human peripheral blood γδT cells show a highly-efficient cytotoxicity against the tumor cells of digestive system. The attached γδT cells are more efficient than the suspended γδT and CIK cells. γδT cells may be another important group of immune effector cells in the adoptive immunotherapy for cancer.
- Citation: Chen FX, Liu JQ, Feng X, Wang T, Zhang J, Zhang S, Chen GL. Cytotoxic effects of human peripheral blood γδT cells on the tumor cells of digestive system in vitro. Shijie Huaren Xiaohua Zazhi 2007; 15(14): 1591-1595
- URL: https://www.wjgnet.com/1009-3079/full/v15/i14/1591.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i14.1591
γδT细胞是体内固有免疫中的一个重要T细胞群, 他广泛分布于消化系统和呼吸系统上皮组织内, 末梢血中也有一定数量的γδT细胞. 随着对γδT细胞结构和功能研究不断深入, 人们发现γδT细胞除了有与αβT细胞类似的一些功能特征外, 还有其他的一些独特的功能, 如识别抗原不需要MHC分子提呈, 直接识别蛋白质和肽类抗原以及非肽类抗原, 具有抗原提呈细胞的一些特征, 并能通过细胞接触和分泌的细胞因子起免疫调节作用. 近几年来, 应用γδT细胞基因敲除的小鼠证明, γδT细胞在肿瘤免疫监视中具有重要的作用[1-2]. 为此, 我们应用新建立的体外快速扩增的末梢血γδT细胞, 对消化系统常见的肿瘤细胞进行体外抗肿瘤实验, 为γδT细胞用于消化系统肿瘤的治疗提供依据, 现将结果报告如下.
RPMI 1640干粉为Gibco公司产品, 人AB型血清购自徐州市血站, 胎牛血清和淋巴细胞分离液购自中国科学院血液学研究所, Hepes(Amersham公司产品)购于天来生物医学科技有限公司, 异戊烯焦磷酸(isopentenyl pyrophosphate IPP)购自Sigma公司, IL-2购于北京双鹭股份有限公司, 抗人TCR-γδ-FITC、抗人CD3-PE和抗人CD44-FITC均购自杭州联科生物(Immunotech, France), SGC-7901人胃腺癌细胞株, SW-1190人胰腺癌细胞株和SMMC-7721人肝癌细胞株均购于中国科学院上海细胞生物学研究所. 流式细胞分析仪(TACS Calibur)为美国Becton Dickinson公司产品.
取健康献血者抗凝血100 mL, 以1500 r/min离心15 min, 吸白细胞层, 再经淋巴细胞分离液分离出末梢血单个核细胞(PBMC). 将PBMC洗涤后加入1640培养液(培养液含100 mL/L小牛血清, 50 mL/L人AB型血清, IPP 2 μg/L, IL-2 105 IU/L)中, 调整细胞密度为1×108/L, 置75 ㎝2细胞培养瓶中, 于37℃, 50 mL/L CO2培养箱中培养, 并根据细胞生长情况及时添加培养液.
1.2.1 CIK细胞培养及鉴定: 按以往报告的方法进行[3].
1.2.2 γδT细胞和CIK细胞杀伤活性检测: 以乳酸脱氢酶释放法测定细胞杀伤活性[4], 以SGC-7901人胃腺癌细胞株、SW-1190人胰腺癌细胞株和SMMC-7721人肝癌细胞株作为靶细胞并分别配成2×108/L的细胞悬液, 按效靶细胞比5∶1, 10∶1, 20∶1, 40∶1的比例加入培养10 d时的效应细胞(γδT细胞和CIK细胞), 37℃, 50 mL/L CO2条件下孵育6 h, 收集上清液在全自动生化分析仪(AU1000 Olympus)340 nm波长下测定吸光度(A)值.
杀伤活性 = (A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释放组)×100%
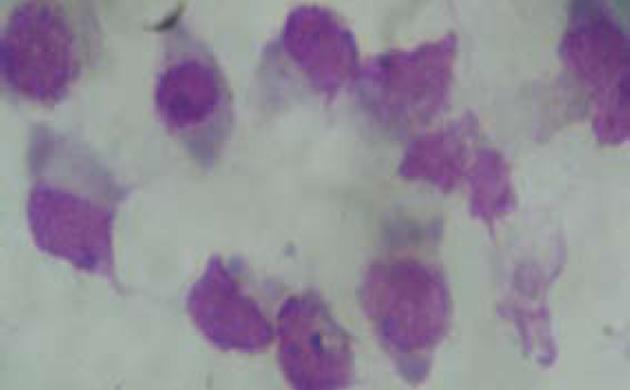
PBMC在γδT细胞培养液中培养24 h即可见贴壁生长, 每个集落约3-6个细胞, 48 h后集落开始变大, 培养10 d可见大的集落和极少量单个贴壁生长细胞, 单个细胞可见细胞呈条梭状, 整个集落形态与用TNF培养后的树突状细胞较为相似, 也有部分呈悬浮生长的细胞. 培养10 d的γδT细胞涂片行瑞姬氏染色发现大多数细胞体积大, 呈椭圆或不规则形, 细胞核大多为椭圆或圆形, 核染质疏松, 核膜不规则, 有凸起, 每个细胞可见1个小核仁, 呈深蓝色; 胞质丰富, 染成蓝灰色, 形态不规则, 有的像伪足, 近核处有淡染现象, 也有呈不规则形(图1).
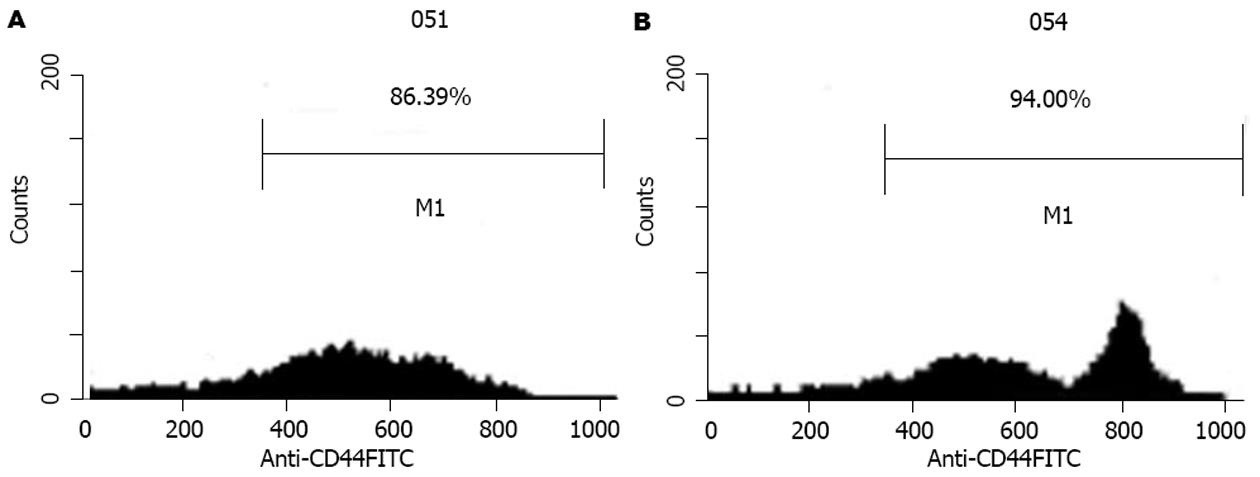
收集培养10 d时的细胞进行mAb荧光标记后经流式细胞术检测并分析结果. PBMC未培养前γδT细胞数为4.21%, 培养10 d时的γδT细胞数为70.35%(图2), 在培养10 d时, 我们分别将悬浮细胞吸出, 并再将黏附细胞吹打洗脱, 收集后分别行CD44 mAb荧光标记后进行检测, 结果悬浮生长细胞CD44表达为86.39%, 贴壁生长细胞CD44为94.00%, 从图3可以看出, 贴壁细胞中有一高表达CD44峰.
贴壁生长γδT细胞对3株消化系统肿瘤细胞的杀伤活性要高于悬浮生长的γδT细胞和CIK细胞. 在效靶比为40∶1时, 贴壁生长的γδT细胞对SGC-7901, SW-1190和SMMC-7721的杀伤活性分别为61%, 50%和59%, 明显高于悬浮生长的γδT细胞(分别为50%, 37%和37%)和CIK细胞(分别为45%, 34%和40%); 而悬浮生长的γδT细胞在对SGC-7901胃癌细胞的杀伤活性要高于CIK细胞, 对SW-1190胰腺癌细胞的杀伤活性低于CIK细胞, 对SMMC-7721肝癌细胞株的杀伤活性与CIK细胞相同(图4).
自1990年从肺癌肿瘤浸润淋巴细胞(TIL)中分离出γδT细胞, 并发现这些细胞对新鲜的自体肿瘤细胞和K562细胞有高效杀伤活性, 许多作者证实了在直肠癌、肾癌、肝癌和乳腺癌等实体瘤的TIL中存在有γδT细胞, 并具有抗肿瘤作用[5-8]. 随着研究的不断深入, 人们发现从人外周血中培养的γδT细胞同样具有强而广的抗肿瘤效应[9-17].
γδT细胞杀伤肿瘤细胞的机制与CTL细胞和NK细胞相似, 主要通过穿孔素、颗粒酶和Fas/FasL途径起作用, 然而γδT细胞对肿瘤细胞的识别还不完全清楚, 通常γδT细胞对肿瘤细胞的识别大多数是MHC非限制性的, 主要是通过NKG2D识别肿瘤细胞表达的MICA, MICB, ULBPs, MHCⅠb类蛋白和F1-ATP合酶以及参与肿瘤浸润和转移相关的单体型层黏连蛋白(MLR)等配体[18]. Corvaisier et al[10]研究还证实, 对肿瘤细胞的识别还与肿瘤细胞上γδTCR刺激物(如甲羟戊酸途径代谢物-IPP)的产生和ICAM-1表达密切相关. 我们结果也表明, 从人外周血分离培养出的γδT细胞对消化道系统常见肿瘤细胞均有较强的杀伤作用, 而且贴壁生长的γδT细胞杀伤活性均高于CIK细胞. 从图3中可以看出, 有部分贴壁细胞高表达CD44, 人CD44属于黏附分子家族的跨膜糖蛋白, 他能与许多蛋白相结合, 高表达CD44的贴壁γδT细胞对几种癌细胞的杀伤活性高于悬浮生长的γδT细胞, 这也可能与肿瘤细胞高表达黏附分子受体, 使其容易与γδT细胞黏附有关. 一些试验证实, γδT细胞在体内具有明显的抗癌作用, Kabelitz et al[19]用阿伦磷酸激活的γδT细胞与IL-2一起治疗已接种人肿瘤细胞的SCID小鼠, 发现能明显延长生存期. Zheng et al[8]给已建立鼻咽癌的裸鼠注射正常人γδT细胞2次, 每次5×107, 可见肿瘤明显缩小和生存期延长, 且与注射次数相关, 免疫组化证实肿瘤内有局部坏死, 注射的γδT细胞在瘤内聚积. 戴梦华 et al[20]胰腺癌外周血经抗人TCRγδT mAb包被扩增的γδT细胞注入已建立胰腺癌的裸鼠腹腔内, 发现γδT细胞具有显著的抑瘤作用. 朱忆斯 et al[21]用自身外周血培养的γδT细胞治疗4例胃癌术后患者, 随访10-25 mo未见复发. 最近Kobayashi et al[22]用2甲基-1丁烯基一焦磷酸激活7例晚期肾癌患者PBMC中γδT细胞, 然后进行回输治疗, 发现治疗后有6例患者外周血中γδT细胞绝对值增多, 治疗未见毒副作用. γδT细胞体内应用除直接杀伤肿瘤细胞外, 还可以通过与NKT细胞和成熟树突状细胞(DC)相互作用, 释放出抗肿瘤免疫中的关键分子IFN-γ和募集活化淋巴细胞、抗原提呈细胞的趋化性细胞因子来启动抗肿瘤免疫细胞网络, 从而实现持续的抗肿瘤免疫应答[23-26].
以往在体外扩增γδT细胞多采用γδT细胞单克隆抗体固相包被、结核杆菌低分子多肽抗原诱导和HSP70多肽诱导等方法[12,27-30], 这些方法所用的试剂不易购买且价格较贵, 难以满足临床治疗需求. 我们建立的这一新的培养方法可以在较短时间内培养出满足临床应用的γδT细胞. 在知情者同意原则下, 我们对部分晚期肿瘤患者进行自身CIK, DC和γδT细胞联合治疗, 治疗过的患者除个别患者有一过性发热外, 未见有其他毒副作用. 由于γδT细胞在病毒性疾性疾病的控制中起着重要的作用, 因此用此法在体外培养出大量高纯度的γδT细胞, 这也为病毒性急性疾病的综合性细胞免疫治疗提供可能[31-33]. 我们在知情同意下, 对2名HBV-DNA高负荷患者进行了自身CIK、树突状细胞和γδT细胞联合治疗, 患者无毒副反应, 近期疗效正在观察之中.
肿瘤免疫编辑理论认为, 机体固有免疫和适应性免疫均参于机体的抗肿瘤过程[34]. 在免疫逃逸期, 部分肿瘤细胞可发生MHCⅠ类分子低表达或缺失, 肿瘤抗原缺失或下调和抗原提呈异常等使机体免疫细胞不能对其进行特异性杀伤[35]. 因此, 在肿瘤免疫均衡期和免疫逃逸期, 必须联合固有免疫和适应性免疫中的抗肿瘤效应细胞一起应用, 才能达到清除肿瘤的目的. 在体外扩增大量的自身具有抗肿瘤活性的γδT细胞回输可以杀伤那些逃逸αβT细胞杀伤的肿瘤, 如能与肿瘤特异性CTL, NK细胞, NKT细胞, DC和巨噬细胞等进行综合性细胞免疫治疗, 将会明显提高肿瘤患者的细胞免疫治疗效果.
γδT细胞只占外周血单个核细胞0.5%-5%, 但却是皮肤、小肠、肺和生殖器官等黏膜皮下组织淋巴细胞的主要成分之一, 提示γδT细胞在粘膜免疫中起着重要作用. 近年来研究发现γδT细胞以MHC非限制方, 式杀伤肿瘤细胞在免疫监视中具有重要作用, 同时也是适应性免疫中的起始因子. 以往在外周血中培养扩增γδT细胞大多用γδT单克隆抗体法等方法, 这些方法较繁杂, 费用高, 现用小分子非肽抗Ô可在体外获得大量高纯度的有杀伤功能的γδT细胞, 这为γδT细胞用于临床治疗提供了支持. 消化系统的一些肿瘤是我国常见的肿瘤病种, 这些肿瘤细胞常表达γδT细胞杀伤的靶分子, 因此, 我们应用IPP扩增的人外周γδT细胞对胃癌、肝癌和胰腺癌细胞株进行杀伤活性测定, 发现对这些肿瘤细胞有较高的杀伤作用. 这为治疗这些肿瘤提供了实验证据.
目前在体外扩增γδT细胞越来越多地采用小分子抗Ô如磷酸抗Ô和烷基胺等. 这些小分子一是容易洗涤去除, 不影响细胞免疫治疗, 不产生毒副作用, 二是价格比较低. 用这些方法扩增的γδT细胞已在体外和体内对多种肿瘤细胞进行了杀伤活性和体内抗肿瘤研究. 现已报告用扩增的自身γδT细胞对人胃癌、淋巴瘤和晚期肾癌进行了治疗, 治疗初步结果是安全有效的. 今后亟待研究的问题是这些小分子抗Ô在体外扩增的γδT细胞亚群是否一致, 是否有选择性增殖某一亚群. 对γδT细胞杀伤不敏感的瘤细胞如何增加对γδT细胞杀伤的敏感性如何利用γδT细胞的抗Ô提呈作用研制肿瘤性疫苗. γδT细胞与其他免疫细胞如树突状细胞、NK细胞等的相互作用和γδT细胞在病毒性疾病中的治疗作用等也是今后研究的重点.
Corvaisier et al对γδT细胞对自身和异体肿瘤细胞的杀伤机制进行了较详细地研究, 发现对自身肿瘤细胞和异体肿瘤细胞均有杀伤活性, 而对自身正常细胞无杀伤作用. 这种杀伤是MHC非依赖性的, 并与肿瘤细胞的γδTCR刺激物的产生和ICAM-1表达密切相关. Kobayashi et al最近报告用体外激活的γδT细胞治疗7例晚期肾癌患者, 发现治疗后能明显增加外周血中γδT细胞数, 无毒副作用, 患者能够耐受治疗.
本文应用非肽抗Ô从PBMC培养γδT细胞, 纯度达70%以上, 并对我国消化系统常见肿瘤细胞进行杀伤活性测定, 发现γδT细胞对3种肿瘤细胞有较强杀伤活性, 并发现贴壁生长的γδT细胞高表达CD44分子, 对肿瘤细胞的杀伤活性也高于悬浮生长的γδT细胞. 这在国内外还未见报告.
肿瘤细胞免疫治疗关键是要联合使用固有免疫细胞和适应性免疫细胞进行治疗, 才能将一些肿瘤变异逃逸株进行杀伤清除. 固有免疫中的树突状细胞、NKT细胞的培养技术已较成熟, 并已应用于临床, 而γδT细胞培养技术尚不成熟, 本文报告的方法可弥补这方面的不足. 有了足够数量的γδT细胞, 再与DC, CIK和CD3AK细胞等免疫效应细胞联合应用于肿瘤患者的治疗, 必将提高肿瘤细胞免疫治疗的效果. 此外,由于γδT细胞高分泌IFN-γ, 以及在抗病毒中的重要作用, 因此, 他的过继性回输治疗病毒性疾病也将逐步得到应用.
γδT细胞是体内固有免疫中的一个重要T细胞群, 其结构和功能受到关注. 因为他有自己独特的功能. 本文通过细胞杀伤试验探讨了人末梢血γδT细胞对消化系统肿瘤细胞的杀伤作用, 文章新颖性较好, 有应用前景.
编辑: 张焕兰 电编:郭海丽
| 1. | Born WK, Reardon CL and O′Brien RL. The function of γδT cells in innate immunity. Curr Opin Immunol. 2006;18:31-38. [PubMed] [DOI] |
| 2. | Moser B, Brandes M. Gammadelta T cells: an alternative type of professional APC. Trends Immunol. 2006;27:112-118. [PubMed] [DOI] |
| 3. | 陈 复兴, 刘 军权, 张 南征, 巩 新建, 张 国龙, 徐 永茂, 周 忠海, 王 涛, 黄 健. 自身细胞因子诱导的杀伤细胞过继性免疫治疗恶性肿瘤的临床观察. 癌症. 2002;27:797-801. |
| 5. | Watanabe N, Hizuta A, Tanaka N, Orita K. Localization of T cell receptor (TCR)-gamma delta + T cells into human colorectal cancer: flow cytometric analysis of TCR-gamma delta expression in tumour-infiltrating lymphocytes. Clin Exp Immunol. 1995;102:167-173. [PubMed] [DOI] |
| 6. | Mitropoulos D, Kooi S, Rodriguez-Villanueva J, Platsoucas CD. Characterization of fresh (uncultured) tumour-infiltrating lymphocytes (TIL) and TIL-derived T cell lines from patients with renal cell carcinoma. Clin Exp Immunol. 1994;97:321-327. [PubMed] [DOI] |
| 7. | Chen J, Niu HT, He W, Ba D. Anti-tumor activity of expanded human tumor infiltrating γδT lymphocytes. Int Arch Allergy Appl Immunol. 2001;125:256-263. [PubMed] [DOI] |
| 8. | Zheng BJ, Chan KW, Im S, Chua D, Sham JS, Tin PC, He ZM, Ng MH. Anti-tumor effects of human peripheral gammadelta T cells in a mouse tumor model. Int J Cancer. 2001;92:421-425. [PubMed] [DOI] |
| 9. | Viey E, Fromont G, Escudier B, Morel Y, Da Rocha S, Chouaib S, Caignard A. Phosphostim-activated gamma delta T cells kill autologous metastatic renal cell carcinoma. J Immunol. 2005;174:1338-1347. [PubMed] [DOI] |
| 10. | Corvaisier M, Moreau-Aubry A, Diez E, Bennouna J, Mosnier JF, Scotet E, Bonneville M, Jotereau F. V gamma 9V delta 2 T cell response to colon carcinoma cells. J Immunol. 2005;175:5481-5488. [PubMed] [DOI] |
| 12. | 马 安伦, 葛 海良, 张 冬青, 王 树军, 周 光炎. 一种简单γδT细胞扩增培养方法及其抗肿瘤生物学功能研究. 中国肿瘤生物治疗杂志. 2000;7:181-183. |
| 14. | Schmidt J, Liienfeld-Toal M, Buchler MW, Marten A. Bisphosphonic acid acts as gamma/delta T cell activating antigen and has direct cytotoxic activity against pancreatic carcinoma cells. Cancer Cell Int. 2004;4 suppl 1:25. |
| 15. | Poupot M, Pont F, Fournie JJ. Profiling blood lymphocyte interactions with cancer cells uncovers the innate reactivity of human gamma delta T cells to anaplastic large cell lymphoma. J Immunol. 2005;174:1717-1722. [PubMed] [DOI] |
| 16. | Raspollini MR, Castiglione F, Rossi Degl'innocenti D, Amunni G, Villanucci A, Garbini F, Baroni G, Taddei GL. Tumour-infiltrating gamma/delta T-lymphocytes are correlated with a brief disease-free interval in advanced ovarian serous carcinoma. Ann Oncol. 2005;16:590-596. [PubMed] [DOI] |
| 17. | Meeh PF, King M, O'Brien RL, Muga S, Buckhalts P, Neuberg R, Lamb LS Jr. Characterization of the gammadelta T cell response to acute leukemia. Cancer Immunol Immunother. 2006;55:1072-1080. [PubMed] [DOI] |
| 18. | Steinle A, Groh V, Spies T. Diversification, expression, and gamma delta T cell recognition of evolutionarily distant members of the MIC family of major histocompatibility complex class I-related molecules. Proc Natl Acad Sci U S A. 1998;95:12510-12515. [PubMed] [DOI] |
| 19. | Kabelitz D, Wesch D, Pitters E, Zoller M. Characterization of tumor reactivity of human V gamma 9V delta 2 gamma delta T cells in vitro and in SCID mice in vivo. J Immunol. 2004;173:6767-6776. [PubMed] [DOI] |
| 22. | Kobayashi H, Tanaka Y, Yagi J, Osaka Y, Nakazawa H, Uchiyama T, Minato N, Toma H. Safety profile and anti-tumor effects of adoptive immunotherapy using gamma-delta T cells against advanced renal cell carcinoma: a pilot study. Cancer Immunol Immunother. 2007;56:469-476. [PubMed] [DOI] |
| 23. | Munz C, Steinman RM, Fujii S. Dendritic cell maturation by innate lymphocytes: coordinated stimulation of innate and adaptive immunity. J Exp Med. 2005;202:203-207. [PubMed] [DOI] |
| 24. | Gao Y, Yang W, Pan M, Scully E, Girardi M, Augenlicht LH, Craft J, Yin Z. Gamma delta T cells provide an early source of interferon gamma in tumor immunity. J Exp Med. 2003;198:433-442. [PubMed] [DOI] |
| 25. | 梁 辉, 侯 著法, 余 金姝, 王 昀, 王 华. DC细胞刺激γδT细胞的抗白血病作用. 上海第二医科大学学报. 2002;22:97-100. |
| 26. | Shrestha N, Ida JA, Lubinski AS, Pallin M, Kaplan G, Haslett PA. Regulation of acquired immunity by gamma delta T-cell/dendritic-cell interactions. Ann N Y Acad Sci. 2005;1062:79-94. |
| 29. | 李 新燕, 张 学光, 张 毅, 李 明, M . M. Hallet, B. Klein. 特异性体外扩增人γδT淋巴细胞及其生物学特性的研究. 中华医学杂志. 1997;77:111-114. |
| 30. | 吴 俊英, 李 柏青, 张 学光. APC在结核杆菌低分子多肽抗原体外激活人外周血γδ+T细胞中的作用. 细胞与分子免疫学杂志. 2001;17:492-494. |
| 31. | Agrati C, Alonzi T, De Santis R, Castilletti C, Abbate I, Capobianchi MR, D'Offizi G, Siepi F, Fimia GM, Tripodi M. Activation of Vgamma9Vdelta2 T cells by non-peptidic antigens induces the inhibition of subgenomic HCV replication. Int Immunol. 2006;18:11-18. [PubMed] [DOI] |
| 32. | Poccia F, Agrati C, Martini F, Capobianchi MR, Wallace M, Malkovsky M. Antiviral reactivities of gammadelta T cells. Microbes Infect. 2005;7:518-528. [PubMed] [DOI] |
| 33. | Lopez RD. Human gammadelta-T cells in adoptive immunotherapy of malignant and infectious diseases. Immunol Res. 2002;26:207-221. [PubMed] [DOI] |
| 34. | Schreiber RD. Cancer vaccines 2004 opening address: the molecular and cellular basis of cancer immunosurveillance and immunoediting. Cancer Immun. 2005;5 Suppl 1:1. |
| 35. | 陈 复兴, 曹 志章, 徐 开林. 癌症生物治疗--原理和实践. 第3版. 北京; 人民军医出版社. 2005;820-831. |