修回日期: 2007-02-04
接受日期: 2007-02-13
在线出版日期: 2007-05-08
目的: 建立人原发性直肠恶性淋巴瘤裸小鼠原位移植模型, 探讨其生物学特性.
方法: 采用人直肠原发性恶性淋巴瘤术中的新鲜瘤组织块植入裸鼠的直肠黏膜层内, 观察原位移植的成瘤率, 移植瘤的侵袭和转移率. 进行形态学(光镜、电镜、免疫组织化学), 染色体核型, 流式细胞分析.
结果: 依据WHO新的分类标准, 建成1株人直肠原发性(非霍奇金B细胞性)恶性淋巴瘤裸鼠原位移植模型HRBL-0305. 移植瘤组织病理学为(非霍奇金B细胞性)高度恶性淋巴瘤; 免疫组织化学示CD19, CD20, CD22, CD45阳性, CD3, CD7阴性. 染色体众数56-69条, 流式细胞DI值为1.57-1.61, 均为异倍体. HRBL-0305已传至31代; 共移植裸鼠187只. 其肿瘤移植生长率和液氮冻存复苏成活率均为100.0%, 肝转移率为45.4%, 淋巴结和腹腔种植转移率均为38.0%, 移植瘤在裸鼠的直肠内自主侵袭性生长, 发生血液、淋巴转移和腹腔内种植性转移. 移植瘤组织病理学, 超微结构的观察, 流式细胞DNA含量测定及染色体核型的分析, 表明与人源直肠恶性淋巴瘤细胞相一致.
结论: HRBL-0305是首次成功建立的人直肠原发性恶性淋巴瘤裸鼠原位移植模型, 完整地重现了人直肠原发性恶性淋巴瘤的自然临床病理过程, 且转移模式与临床患者相似, 为研究直肠恶性淋巴瘤的生物学特性和治疗提供了理想动物模型平台.
引文著录: 魏强, 刘秋珍, 脱朝伟, 张宁, 杨波, 朱希伟, 王明耀. 人原发性直肠恶性淋巴瘤裸小鼠原位移植模型的建立及其生物学特性. 世界华人消化杂志 2007; 15(13): 1500-1504
Revised: February 4, 2007
Accepted: February 13, 2007
Published online: May 8, 2007
AIM: To establish an orthotopic transplantation model of human primary rectal lymphoma in nude mice and investigate its biologic features.
METHODS: Histologically fresh lymphoma tissues from a case of primary rectal lymphoma during operation were transplanted into rectal mucosa of nude mice. Tumorgenecity, invasion, metastasis, morphology (light microscopy, electron microscopy and immunohistochemistry), karyotype analysis and DNA content of orthotopically transplanted tumors were studied.
RESULTS: According to the new WHO classification of malignant lymphoma, an orthotopic transplantation model of human primary rectal lymphoma (non-Hodgkin's, B cell, high malignancy) in nude mice (HRBL-0305) was successfully established. Immunohistochemistry showed that CD19, CD20, CD22 and CD45 were positive, but CD3 and CD7 were negative. The number of chromosome was between 56 and 69. DNA index (DI) was 1.57-1.61 (i.e. heteroploid). So far, HRBL-0305 has been passaged for 31 generations in nude mice. A total of 187 nude mice were used for transplantation. Both the growth rate of transplantation and resuscitation rate of liquid nitrogen cryopreservation were 100%. Liver metastasis rate was 45.4%; metastasis rates of both lymph node and celiac planting were 38.0%. Transplanted human primary rectal lymphoma could autonomously and invasively grow in the rectum of nude mice, and further developed hematogenous lymph node and celiac planting metastases. Orthotopically transplanted tumors were consistent with the original human tumor in histopathological and ultrastructural features, DNA content and chromosomal karyotype.
CONCLUSION: An orthotopic transplantation model of human primary rectal lymphoma is successfully established in nude mice for the first time, which can completely repeat the natural clinicopathologic course of human primary rectal lymphoma, and metastasis pattern of the model is similar to that of clinical patients. HRBL-0305 provides an ideal animal model platform for the researches on biologic characteristics and experimental therapy of human primary rectal lymphoma.
- Citation: Wei Q, Liu QZ, Tuo CW, Zang N, Yang B, Zhu XW, Wang MY. Establishment of orthotopic transplantation model of human primary rectal lymphoma in nude mice and investigation of its biologic characteristics. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1500-1504
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1500.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1500
原发性直肠恶性淋巴瘤发病率占全部胃肠道淋巴瘤的0.1%-2%, 直肠恶性肿瘤的0.4%-4%, 是消化道罕见的恶性肿瘤[1]. 病因学和发病机制迄今尚不清楚. 临床起病隐匿, 易与直肠癌混淆, 术前诊断困难, 误诊率高, 预后很差[2]. 与直肠其他肿瘤相比, 其基础和临床研究的深度和广度仍很有限, 缺少可供直接研究的肿瘤组织标本和实验研究用的动物模型. 为深入探讨直肠恶性淋巴瘤的这些生物学行为, 本研究采用直肠淋巴瘤新鲜组织块裸鼠直肠外科原位移植及体内筛选的技术方法, 成功地建立了能完全重现人直肠恶性淋巴瘤自然临床病理过程, 且转移模式与临床患者相似的人原发性直肠恶性淋巴瘤裸鼠原位移植模型, 命名为HRBL-0305, 旨在为直肠恶性淋巴瘤基础和临床研究提供理想的动物模型平台.
BALB/c-nu/nu裸小鼠由中国医学科学院肿瘤研究所肿瘤医院动物室提供. 鼠龄3-5 wk, 体质量17-20 g, 雌雄兼用, 在本院SPF (specific-pathogen free)条件下的裸鼠室内饲养.
1.2.1 标本来源与处理: 原发性直肠恶性淋巴瘤新鲜组织标本由辽宁省肿瘤医院提供. 取自1例49岁男性患者, 手术证实为直肠弥漫浸润型恶性淋巴瘤, 肠壁有10余处浸润病灶, 为圆形或不规则形, 直径约0.7-2.5 cm. 有的则呈环形, 均隆起于浆膜面, 灰白色, 瘤细胞浸润黏膜、黏膜下层、肌层多被侵袭破坏, 整个肠壁增厚, 灰白色, 肠系膜淋巴结肿大互相黏连, 肝脏见转移瘤结节. 病理诊断为原发性直肠高度恶性淋巴瘤(非霍奇金B细胞)肝转移. 无菌切取的原发灶和肝转移灶新鲜组织标本置入RPMI1640培养液中, 清除非瘤组织, 剪切成1 mm×1 mm×1 mm瘤组织块, 供移植用.
1.2.2 原位移植与传代[3]: 裸鼠静脉注射0.5 g/L戊巴比妥钠(30 mg/kg)麻醉, 取腹正中线切口, 辨认直肠, 在直肠的浆膜面向肠壁内做3 mm切口深达黏膜层, 以10-0无损伤缝合线, 经切口分别将2粒原发灶、肝转移灶1 mm×1 mm×1 mm瘤小块固定于直肠壁黏膜层, 7-0丝线缝合腹膜, 5-0丝线缝皮. 术后继续饲养, 观察期为60-90 d. 当荷瘤裸鼠处于濒死状态时, 取其中1只荷瘤裸鼠用颈椎脱位术处死, 系统解剖, 取出移植瘤. 一部分瘤组织以原代移植方法行鼠间连续传代, 每次传代裸鼠5-10只不等; 另一部分瘤组织液氮冻存备用, 进行相关指标检测. 其他荷瘤裸鼠饲养至濒死状态或自然死亡, 观察其肿瘤的生长、侵袭和转移.
1.2.3 解剖学和组织学检查: 全部荷瘤裸鼠均经详细解剖学检查, 测量肿瘤体积观察侵袭周围脏器情况; 观察直肠上动脉, 肠系膜下动脉, 腹主动脉周围淋巴结、肝、脾等各脏器有无肿瘤的转移. 移植瘤组织, 区域淋巴结和各脏器组织经40 g/L甲醛固定, 石蜡切片, HE染色, 光镜观察.
1.2.4 免疫组织化学染色[3]: 采用LSAB法, 对全部裸鼠直肠肿瘤或有器官转移的切片应用CD3, CD7, CD19, CD20, CD22, CD45抗体进行染色, 所用试剂均购自DaKo公司.
1.2.5 电镜观察: 2.5%戊二醛和1%锇酸双固定移植瘤, Epon-812包埋, 制作超薄切片, 铀-铅染色, PHILIPS-CM10透射电镜观察.
1.2.6 流式细胞含量分析[4]: 采用美国FACS-420型流式细胞仪, 对正常直肠黏膜细胞、移植瘤细胞进行DNA含量测定.
1.2.7 染色体检查: 采用短期培养, 不加有丝分裂刺激方法, 收获细胞常规制片, GTG法染色, 显微镜下观察[3].
1.2.8 恶性淋巴瘤组织学分类标准: 采用2001年新的WHO分类方法[5].
统计学处理 差异显著性采用t检验, 显著性水准P<0.01. 数据以mean±SD表示, 在SPSS10.0统计软件上完成.
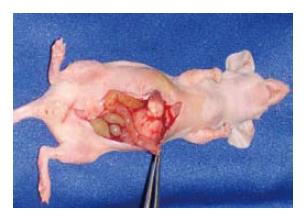
2.1.1 HRBL-0305原位移植模型: 取自人原发性直肠恶性淋巴瘤原发灶和肝转移灶新鲜组织块, 首代各移植裸鼠5只, 均获得移植成功. 目前已传至37代, 共移植裸鼠187只, 平均潜伏期为6.4 d, 传代间期26.7 d. 传代肿瘤成瘤率和液氮冻存复苏成活率均为100.0%. 尸解发现: 肿瘤弥漫侵袭直肠壁全层, 整个肠壁浸润肥厚, 可见许多圆形或不规则形的斑块状浸润病灶, 黏膜皱襞完全消失. 表面见数个圆形、卵圆形或不规则多发性溃疡, 大小(0.7 mm×0.5mm)至(0.4 mm×0.3 mm)不等. 边缘隆起, 底部不平, 切面, 整个肠壁显著增厚, 呈灰白色或灰黄色, 均质状. 病理切片检查: 187只裸鼠直肠均见淋巴瘤细胞弥漫侵袭生长, 85只(45.4%)发生肝转移(图1), 72只(38.0%)发生直肠上动脉, 肠系膜和腹主动脉周围淋巴结转移伴有广泛腹腔播散种植性转移和肠梗阻.
2.1.2 HRBL-0305移植瘤生长特点: 尸解发现, 人直肠恶性淋巴瘤在裸鼠的直肠黏膜、黏膜下层和肌层自主侵袭性生长, 致使整个肠壁浸润肥厚, 可见许多圆形或不规则形状的浸润病灶, 黏膜皱壁消失, 表面有溃疡形成. 有的则可见累及数厘米长肠管的环形病灶. 切面观察发现, 整个肠壁增厚, 呈灰白色或灰黄色, 均质状.
2.2.1 淋巴结转移: 局限于腹腔, 直肠上动脉, 肠系膜下动脉, 腹主动脉周围淋巴结, 少数动物有肝门淋巴结转移. 依受累程度, 淋巴结转移分为3期: (1)早期: 只在输入淋巴管和边缘窦内出现瘤细胞团; (2)中期: 瘤细胞进一步向副皮质和髓质内侵袭性生长; (3)晚期: 除在边缘部分残存少量淋巴结组织外, 整个淋巴结几乎为瘤细胞侵占.
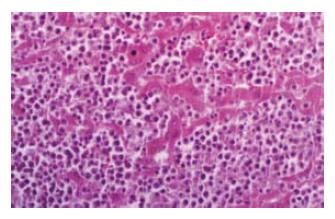
2.2.2 肝转移: 原位移植第3周末出现, 多数呈弥漫型, 瘤灶可散布在肝左、右叶乃至全肝, 大小不一, 数目不等, 呈圆形或椭圆形灰白色的瘤结节. 少数荷瘤裸鼠多局限在肝右叶, 呈结节巨块形, 周围有散在小瘤块, 瘤灶位于肝实质内. 转移灶小至血管内瘤栓; 大至肉眼可见直径为(0.3 mm×0.4 mm)/(0.7 mm×0.9 mm). 最大直径为1.3 cm×2.0 cm, 镜下见转移瘤细胞呈侵袭性生长(图2). 严重时肝组织由瘤结节替代.
2.2.3 腹腔种植转移: 见于腹腔脏层、壁层腹膜及网膜、胃壁、肠壁、肠系膜种植的灰白色瘤结节. 有的荷瘤裸鼠可见广泛腹腔种植的全腹腔癌病和肠梗阻.
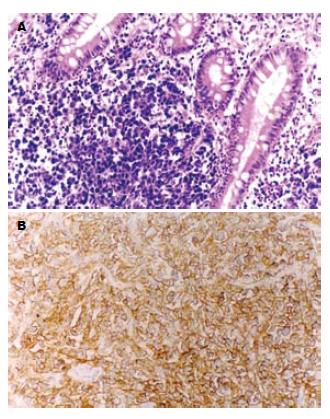
2.3.1 HRBL-0305: 光镜下瘤细胞弥漫侵袭肠壁全层及黏膜表面, 细胞大, 圆形、卵圆或肾形, 胞质少, 可见多核瘤巨细胞, 核大, 呈圆形或不规则形, 核染色质不均匀, 可见核仁, 病理核分裂相多见(图3A). 电镜下瘤细胞核大. 核多形性, 有的核有1-2条不规则深沟及不对称分叶, 呈多叶核. 少数核呈圆形或卵圆形, 异染色质沿核膜聚集, 核仁大小不一. 多数瘤细胞胞质内细胞器少, 主要为肿胀线粒体及扩张粗面内质网.
HRBL- 0305模型移植瘤细胞CD19, CD20, CD22, CD45均呈阳性表达(图3B), CD3, CD7均呈阴性表达.
HRBL-0305模型原位移植瘤和瘤源人直肠恶性淋巴瘤的FCM检测均示异倍体, 结果见表1.
HRBL-0305原位移植瘤的染色体数目为56-69条, 介于2倍体和3倍体之间, 均为非整倍体.
人原发性直肠恶性淋巴瘤裸鼠原位移植模型的建立, 是研究直肠恶性淋巴瘤生物学和实验治疗的重要工具. 人直肠恶性淋巴瘤原位移植裸鼠后, 能否始终保持原有的生物学特征是模型建成的关键. 本研究所建立的HRBL-0305模型, 经过长达3 a鼠间连续传代, 已传至31代, 这种象直肠恶性淋巴瘤患者样的原位移植模型, 不仅组织病理学、免疫组织化学表型、超微结构、DNA倍体水平和染色体核型的特点与人源直肠恶性淋巴瘤相一致, 而且肿瘤的移植生长率和液氮冻存复苏成活率均为100.0%, 说明该模型系统的生物学特性是稳定的. 本模型为系统开展直肠恶性淋巴瘤的诊断、手术、放疗、化疗、靶向基因治疗和抗肿瘤新药的筛选等前瞻性试验治疗创建了有利条件. 同时, 也为直肠恶性淋巴瘤的基础理论的研究提供了同一人体来源, 稳定传代, 容易重复的新鲜瘤组织标本和动物模型.
本研究发现HRBL-0305模型展示的生物学行为与临床患者相似, 如移植瘤在裸鼠直肠广泛侵袭性原位生长, 腹部转移, 伴广泛腹腔种植的全腹腔肿瘤, 淋巴结转移, 肝转移和直肠梗阻[1]. 这些结果重现了直肠恶性淋巴瘤患者的临床自然病理过程, 且转移模式与临床患者相似. 因此, 人直肠恶性淋巴瘤裸鼠原位移植模型是迄今为止, 最接近人的直肠恶性淋巴瘤肝转移动物模型, 具有重要价值.
肿瘤转移有器官特异性, 转移细胞必须找到合适的靶器官, 才能支持其移居生长, 完成转移过程. 我们发现肝脏是HRBL-0305模型转移的特异器官. 应用肝转移灶建立的HRBL-0305模型肝转移率之高(100.0%), 转移程度之重, 宿主生存期之短, 均说明该模型恶性程度高, 也证明了转移灶移植是提高转移率建立高转移模型的有效方法. Cowan et al[6]报道人NHL肝转移率高达40.0%, 而本研究187只荷瘤裸鼠HRBL-0305模型肝转移率(45.4%)高于文献报道. Leichman et al[7]报道的因结直肠癌转移而死亡的患者有45.0%-71.0%存在肝转移相似, 提示直肠恶性淋巴瘤与直肠癌肝转移可能具有相似的发生率和转移模式. 在这种明显肝转移表型的背后必定有其内在的转移分子机制, 对肝转移灶和原发灶肿瘤细胞在体内移植进行筛选, 可有助于寻找肝转移相关基因. 为研究直肠恶性淋巴瘤肝转移机制和筛选早期诊断肝转移肿瘤标志物及治疗靶标提供了基础.
总之, 我们首次建立成功的HRBL-0305模型, 完整地重现了AnnArbor将人直肠恶性淋巴瘤病变分为4期的全部临床过程[8], 为深入研究结肠恶性淋巴瘤的生物学特性、病因病理、侵袭和转移机制及实验治疗提供了理想的实验动物模型平台.
原发性直肠恶性淋巴瘤病因学和发病机制迄今尚不清楚, 本研究采用直肠淋巴瘤新鲜组织块裸鼠直肠外科原位移植及体内筛选的技术方法, 成功建立了人原发性直肠恶性淋巴瘤裸鼠原位移植模型, 为直肠恶性淋巴瘤基础和临床研究提供了理想动物模型平台.
人原发性直肠恶性淋巴瘤裸鼠原位移植模型是研究直肠恶性淋巴瘤生物学和实验治疗的重要工具, 然而, 人直肠恶性淋巴瘤原位移植裸鼠后, 能否始终保持原有生物学特征是模型建成的关键.
人原发性直肠恶性淋巴瘤裸鼠原位移植模型的成功建立为系统开展直肠恶性淋巴瘤的诊断、手术、放疗、化疗、靶向基因治疗和抗肿瘤新药的筛选等前瞻性试验治疗创建了有利条件. 同时, 也为直肠恶性淋巴瘤的基础理论的研究提供了同一人体来源、稳定传代、容易重复的新鲜瘤组织标本和动物模型.
本研究成功建立人原发性直肠恶性淋巴瘤裸鼠原位移植模型(HRBL-0305), 完整重现了将人直肠恶性淋巴瘤病变分为4期的全部临床过程, 为深入研究直肠恶性淋巴瘤的生物学特性、病因病理、侵袭和转移机制、实验治疗提供了理想的实验动物模型平台.
电编: 张敏 编辑:何燕
| 1. | Navarra G, Adani GL, Bardella E, Ascanelli S, Turini A, Pozza E. Primary rectal lymphoma as a cause of bowel obstruction. Report of a case. Tumori. 2003;89:88-90. [PubMed] |
| 2. | Kohno S, Ohshima K, Yoneda S, Kodama T, Shirakusa T, Kikuchi M. Clinicopathological analysis of 143 primary malignant lymphomas in the small and large intestines based on the new WHO classification. Histopathology. 2003;43:135-143. [PubMed] [DOI] |
| 4. | Krugmann J, Gschwendtner A, Mairinger T, Fend F. DNA ploidy in gastrointestinal B-cell lymphomas. An image analysis study of 43 cases. Anal Quant Cytol Histol. 2003;25:31-38. [PubMed] |
| 5. | Baschinsky DY, Weidner N, Baker PB, Frankel WL. Primary hepatic anaplastic large-cell lymphoma of T-cell phenotype in acquired immunodeficiency syndrome: a report of an autopsy case and review of the literature. Am J Gastroenterol. 2001;96:227-232. [PubMed] [DOI] |
| 6. | Cowan RA, Jones M, Harris M, Steward WP, Rad-ford JA, Wagstaff J, Deakin DP, Crowther D. Prog-nostic factors in high and intermediate grade non-Hodgkin's lymphoma. Br J Cancer. 1989;59:276-282. [PubMed] [DOI] |
| 7. | Leichman CG, Jacobson JR, Modiano M, Daniels JR, Zalupski MM, Doroshow JH, Fletcher WS, Macdonald JS. Hepatic chemoembolization combined with systemic infusion of 5-fluorouracil and bolus leucovorin for patients with metastatic colorectal carcinoma: A Southwest Oncology Group pilot trial. Cancer. 1999;86:775-781. [PubMed] [DOI] |
| 8. | Kelly PA, Bachelot A, Kedzia C, Hennighausen L, Ormandy CJ, Kopchick JJ, Binart N. The role of prolactin and growth hormone in mammary gland development. Mol Cell Endocrinol. 2002;197:127-131. [PubMed] [DOI] |