修回日期: 2007-02-04
接受日期: 2007-03-06
在线出版日期: 2007-05-08
目的: 构建人可溶性肿瘤坏死因子受体1基因的原核表达质粒, 诱导sTNFR1-MBP融合蛋白表达, 观察表达产物的生物学活性.
方法: 以HeLa细胞的总RNA为模板, 用RT-PCR方法扩增sTNFR1全编码区基因片段, 构建含有目的片段的T载体克隆及原核表达载体pMAL-c2x重组质粒亚克隆, 经异丙基-β-D半乳糖苷酶(IPTG)诱导重组质粒菌表达sTNFR1, 以淀粉树脂亲和层析法纯化重组蛋白, 并对重组蛋白进行序列分析和Western blot鉴定. MTT法测定重组蛋白的生物学活性的测定.
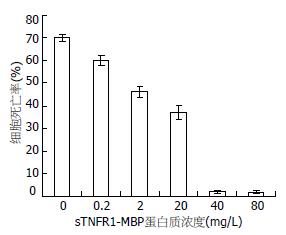
结果: 经DNA序列分析和Western blot鉴定, 成功构建了人sTNFR1重组质粒基因工程菌; 在IPTG的诱导下, 重组质粒菌能表达sTNFR1-MBP融合蛋白, SDS-PAGE显示在66 kDa处有一特异性表达条带; 纯化的sTNFR1-MBP融合蛋白经Western blot证实具有生物学活性; 生物活性实验(MTT法)显示可有效地封闭TNF-α对QSG7701的细胞毒性作用, 随着重组蛋白浓度的增高(0.2, 2, 20, 40, 80 mg/L), 对TNF-α细胞毒效应的抑制作用增强, 细胞死亡率依次为69.98%±1.52%, 60.05%±2.18%, 46.27%±2.48%, 37.02%±3.17%, 1.83%±0.59%, 1.71%±0.61%.
结论: 成功获得了具有生物学活性的人sTNFR1-MBP融合蛋白, 为进一步研究奠定了基础.
引文著录: 傅蕾, 彭仕芳, 谭德明, 刘洪波. 人可溶性肿瘤坏死因子受体1基因原核表达及活性鉴定. 世界华人消化杂志 2007; 15(13): 1494-1499
Revised: February 4, 2007
Accepted: March 6, 2007
Published online: May 8, 2007
AIM: To construct a prokaryotic expression plasmid of human soluble tumor necrosis factor receptor 1 (sTNFR1) gene, induce the expression of sTNFR1-maltose binding protein (MBP) fusion protein and investigate the bioactivity of expression products.
METHODS: The total RNA was extracted from HeLa cells and used as a template to amplify human sTNFR1 gene by reverse transcription-polymerase chain reaction (RT-PCR). The PCR products were cloned into T vector and sub-cloned into plasmid pMAL-c2x, a prokaryotic expression plasmid. The recombinant plasmid was transferred into Escherichia Coli JM109 and induced by isopropyl-β-D-thiogalactopyranoside (IPTG) to express fusion protein sTNFR1-MBP. sTNFR1-MBP was purified by amylose resin affinity chromatography and identified by sequencing and Western blot analysis. The bioactivity of sTNFR1-MBP was estimated by MTT assay.
RESULTS: A 558-bp fragment of human sTNFR1 gene had been amplified by RT-PCR and successfully cloned into vector pMAL-c2x as recombinant vector pMAL-c2x-sTNFR1, which was confirmed by DNA sequencing. sTNFR1-MBP was produced in Escherichia Coli with pMAL-c2x-sTNFR1 after IPTG inducement, and SDS-PAGE showed an extra protein band which was 66 kDa in size. The bioactivity of sTNFR1 was identified by Western blot. MTT assay revealed that sTNFR1 effectively blocked the TNF-α-mediated cytotoxicity on QSG7701 cells. The cytotoxicity was strengthened with the increase of sTNFR1 recombinant protein concentration (0.2, 2, 20, 40, 80 mg/L), and the rates of cell death were 69.98% ± 1.52%, 60.05% ± 2.18%, 46.27% ± 2.48%, 37.02% ± 3.17%, 1.83% ± 0.59% and 1.71% ± 0.61%.
CONCLUSION: The fusion protein sTNFR1-MBP with high bioactivity is obtained successfully, which lays a foundation for further study.
- Citation: Fu L, Peng SF, Tan DM, Liu HB. Cloning, prokaryotic expression and activity identification of human soluble tumor necrosis factor receptor 1 gene in Escherichia Coli JM109. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1494-1499
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1494.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1494
肿瘤坏死因子α(tumor necrosis factor α, TNF-α)是体内重要的免疫调节因子和炎症介质, 他的生物学作用通过受体介导. 体内TNF-α的过度表达在肝功能衰竭的发生发展的病理过程中发挥着重要作用[1-4], 而TNF-α的可溶性受体1(sTNFR1)可中和TNF的毒性作用[5]. 为有效减低或拮抗TNF-α的毒性作用从而治疗肝功能衰竭, 本文拟构建sTNFR1的原核表达载体, 并在大肠杆菌中表达, 研究其蛋白产物的生物学活性, 为临床上治疗肝功能衰竭奠定基础.
QSG7701人非致瘤性肝细胞株由中南大学湘雅医学院病理教研室所赠, JM109由我室保存, pGEM-T载体购自Promega公司, 表达载体pMAL-c2x购自NEB公司. TaqDNA聚合酶、T4DNA连接酶、SalⅠ, EcoRⅠ购自TaKaRa公司, MMLV逆转录酶和IPTG购自Promega公司, DNA凝胶纯化试剂盒购自QIAGEN公司, 淀粉树脂购自NEB公司, 麦芽糖、二甲基亚砜(DMSO)、噻唑蓝(MTT)购自Sigma公司, TNF-α、兔抗人sTNFR1多克隆抗体购自PEPROTECH公司, Western blot检测试剂盒购自博士德公司, TRIzol Reagent RNA分离液、DMEM(高糖)、新生牛血清购自美国Gibco BRL公司产品, 放线菌素-D购自北京夏斯生物公司.
1.2.1 RT-PCR扩增sTNFR1目的片段: PCR引物参照人sTNFR1 cDNA全序列[6]设计, 由上海博亚公司合成. 上游引物: 5'-GAATCCATGGATAGTGTGTGTCCCC-3'; 下游引物: 5'-GTCGACGGATCCTCAAATGATCAGGGGCAAC-3'. 自HeLa细胞中提取总RNA作为逆转录模板, 采用RT-PCR方法扩增sTNFR1基因. 逆转录反应条件参照MMLV逆转酶说明书进行, 逆转录产生的cDNA经PCR扩增获得558 bp大小的目的片段. PCR反应体系为: cDNA 2 μL, TaqDNA聚合酶0.5 U, 10×Buffer(Mg2+)5 μL, 10 mmol/L dNTP3 4 μL, 引物各25 pmol, 加双蒸水至总体积50 μL. PCR条件: 95 ℃ 5 min预变性, 94 ℃ 40 s变性, 55 ℃ 40 s退火, 72 ℃ 1 min延伸, 32个循环后, 72 ℃延伸15 min.
1.2.2 构建原核表达质粒: PCR产物纯化后, 首先应用T载体克隆, 然后从重组的"T"质粒DNA中, 应用SalⅠ, EcoRⅠ双酶切出sTNFR1基因片段, 与用相同酶切后的pMAL-c2x质粒DNA连接重组, 转入感受态细菌JM109, 挑取阳性克隆, 接种于含有100 mg/L氨苄青霉素的LB培养过夜生长, 提取质粒, SalⅠ和EcoRⅠ双酶切分析, 双酶切鉴定的阳性克隆送上海博亚公司进行测序证实.
1.2.3 重组蛋白的诱导表达及条件优化: 挑选经测序验证的阳性克隆菌放入含有100 mg/L氨苄青霉素的LB培养基中振荡培养. 用异丙基β-D-半乳糖苷酶(IPTG)诱导重组蛋白的表达, 参照文献[5]找出重组蛋白最佳的表达条件: 26 ℃, 0.06 mmol/L IPTG, 200 r/min. 将转化菌在含有100 mg/L氨苄青霉素的LB中过夜生长, 次日以1:100接种于含100 mg/L氨苄青霉素的LB 37 ℃振荡生长至吸光度值A600 = 0.5, 加IPTG至0.06 mmol/L. 26 ℃继续振荡6 h, 离心收集诱导后的菌体, 超声裂解细菌, 经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析表达的重组蛋白.
1.2.4 重组蛋白的纯化: 取200-500 mL含有100 mg/L氨苄青霉素的LB培养基增菌后, 在最佳表达条件下诱导表达, 收集菌体超声破碎细菌, 5000 gs离心30 min, 收集上清. 将上清以1:4比例稀释上淀粉树脂层析柱, 并用10 mmol/L麦芽糖洗脱融合蛋白. 将所得纯化蛋白SDS-PAGE分析.
1.2.5 Western blot检测重组蛋白: 全菌体裂解液经SDS-PAGE分离后, 转移到PVDF膜上(同时有空菌和空质粒作为对照), 4 ℃转移电泳70 min, 100 V恒压. 转膜完毕经丽春红染色可见有目的蛋白条带, TBS洗涤2次, 用含50 g/L脱脂奶粉的TBST 37 ℃封闭1 h, PVDF膜与兔抗人sTNFR1多克隆抗体(浓度0.1 mg/L)温育2 h, TBST洗涤5 min×3后, 与HRP标记的羊抗兔IgG(1:3000)室温孵育1 h, TBS洗涤10 min×3, 0.1 mL/cm2量加ECL发光试剂, 暗室内曝光X光胶片, 常规方法显影、定影.
1.2.6 重组蛋白的生物学活性的测定(MTT法): 以QSG7701为靶细胞, 检测sTNFR1对TNF-α细胞毒效应的抑制作用. 调整细胞浓度为1×108/L, 取96孔板每孔加入100 µL细胞悬液, 置37 ℃, 50 mL/L CO2及饱和湿度条件的培养箱孵育过夜; 第2天预先将不同浓度的重组蛋白sTNFR1-MBP(0.2, 2, 20, 40, 80 mg/L)与10 µg/L的TNF-α于4 ℃作用2 h, 待细胞贴壁后吸出培养上清, 加入100 µL不同浓度的sTNFR1-MBP与TNF-α的混合物, 每组设6个复孔, 并设QSG7701细胞对照组(QSG7701细胞加放线菌素D和TNF-α)和空白孔(只加DMEM); 每孔加入终浓度为1 mg/L放线菌素D; 将培养板放入CO2培养箱, 在37 ℃, 50 mL/L CO2及饱和湿度条件下, 培养24 h; 每孔加入MTT溶液(5 g/L)20 μL, 继续培养4 h; 终止培养, 小心吸弃孔内培养上清液, 每孔加入150 μL DMSO, 振荡10 min; 在酶标仪上选择595 nm波长, 以空白孔调零, 测定各孔吸光值(A值). STNFR1抑制TNF-α对QSG7701细胞毒性的百分率按下列公式计算: STNFR1(%) = [(实验组A值-对照组A值)/对照组A值]×100%.
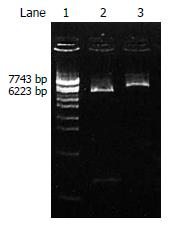
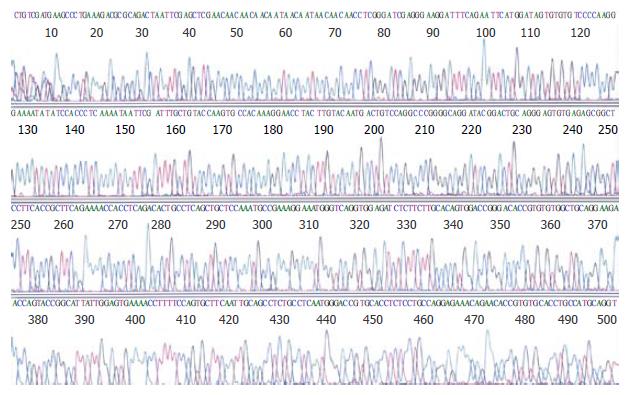
从HeLa细胞的mRNA中通过RT-PCR成功地扩增了558 bp大小的基因片段, 通过基因重组技术得到阳性克隆, 并经酶切分析和DNA测序(98-123为上游引物5'-GAATCCATGGATAGTGTGTGTCCCC-3'; 626-656为下游引物: 5'-GTCGACGGATCCTCAAATGATCAGGGGCAAC-3')证实获得了含有sTNFR1基因片段的人重组pMAL-c2x-sTNFR1克隆(图1-2).
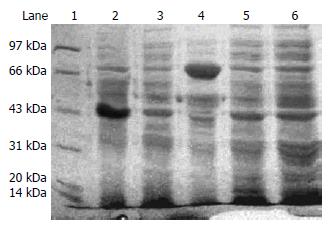
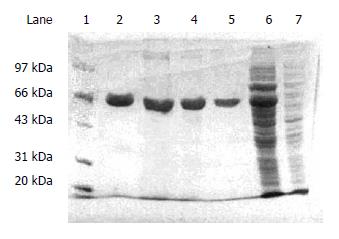
将重组基因工程菌经IPTG诱导后对全菌裂解液进行SDS-PAGE分析, 在相对分子量的为66 kDa处出现对照菌没有的一条粗蛋白带, 与sTNFR-1融合蛋白分子量一致(图3). 经IPTG诱导的重组基因工程菌, 超声波裂解后用淀粉树脂亲和层析法分离纯化, 得到了高纯度的重组融合蛋白(图4).
将转移到PVDF膜上的sTNFR1重组蛋白与兔抗人sTNFR1多克隆抗体反应后, 与酶标记的羊抗兔IgG反应后, ECL显色, 曝光. 胶片上可见一条带, 而对照菌JM109及pMAL-c2x/JM109均未见显色反应(图5).
结果表明随着重组蛋白浓度的增高(0.2, 2, 20, 40, 80 mg/L), 对TNF-α细胞毒效应的抑制作用增强(细胞死亡率依次为69.98%±1.52%, 60.05%±2.18%, 46.27%±2.48%, 37.02%±3.17%, 1.83%±0.59%, 1.71%±0.61%), 当浓度为40 mg/L几乎可完全阻断TNF-α的细胞毒性作用(图6).
大量研究表明, TNF-α在肝功能衰竭的发生发展的病理过程中发挥着重要作用[1-4]. 目前认为, 肝功能衰竭的机制主要包括原发性损伤和继发性损伤, 即"二次打击学说"[7-9]. TNF-α生物学功能是通过与细胞表面膜受体(TNFR1和TNFR2)的结合来实现的, 可溶性TNFR(sTNFR)为膜受体胞外区在酶的作用下从细胞膜上解离下来, 游离在血液中, 仍可与TNF-α结合, 但无法介导TNF-α的信号传导, 从而拮抗TNF-α的生理作用[5]. 有研究发现在暴发性肝衰竭(FHF)中, TNF-α诱导的肝细胞坏死主要是通过TNFR1介导的[10-11]. 从慢性轻度肝炎至肝功能衰竭, 血浆sTNFR1水平随TNF-α水平升高而升高, 但sTNFR1水平相对于TNF-α水平不足, 从而使更多的TNF-α能够与肝细胞mTNFR1结合而促进肝损伤[12]. 尽管sTNFR1属内源性物质, 但从体液中直接提取sTNFR1的量有限, 难以满足临床治疗的需要, 利用基因工程的方法生产sTNFR1有深远的研究和应用价值.
TNF-α受体广泛于正常细胞膜表面, 也存在于多种肿瘤细胞膜表面, 如HeLa细胞等[6]. 本研究从人HeLa细胞提取总RNA, 根据人sTNFR1的全编码区基因cDNA序列自行设计并合成sTNFR1两条引物, 通过RT-PCR获得了的558 bp大小的目的片段sTNFR1全编码的基因, 构建了重组质粒pMAL-c2x-sTNFR1亚克隆, 经酶切及和核苷酸测序, 证实获得pMAL-c2x-sTNFR1重组基因工程菌, 将测序因子与Loetscher et al[6]报告的序列比较, 结果完全一致, 无移码突变, 且sTNFR1序列正确地插入到了MBP序列之后保证了sTNFR1蛋白部分的正确表达.
本实验采取的pMAL-c2x是在大肠杆菌中克隆的融合蛋白表达载体. 其含有大肠杆菌malE基因, 编码麦芽糖蛋白(MBP). 在malE和LaZα之间含有多克隆位点. 克隆的基因插入malE下游, 通过强启动分子tac和malE翻译的起始信号产生克隆基因的高效表达. 由于其核蛋白与上游的原核蛋白MBP融合, 起到了有效的保护作用, 且可通过淀粉树脂亲和层析法纯化MBP融合蛋白. 经IPTG诱导, 目的基因在大肠杆菌JM109中表达, 经SDS-PAGE蛋白电泳检测诱导情况, 发现诱导的含pMAL-c2x空载体的JM109菌在43 kDa位置有一蛋白带. 这是空载体产生的MBP蛋白带[13]. 诱导的含重组质粒的JM109在66 kDa处出现一蛋白带, 而JM109宿主菌、未诱导pMAL-c2x质粒载体转化的JM109和未诱导的重组质粒转化JM109菌均无此带. 证明此蛋白的出现是由带有sTNFR1基因片段的重组表达质粒表达的融合蛋白质, 该蛋白的分子量大小与目的融合蛋白预计的分子量一致. 经Western blot鉴定, 该蛋白能与sTNFR1特异性抗体起反应, 而空菌和空质粒都无反应, 证实该蛋白具有sTNFR1的免疫活性. 因此证明本研究已成功的通过基因工程技术表达了MBP-sTNFR1融合蛋白. 经淀粉树脂亲和层析法纯化, 进一步得到了高纯度的sTNFR1-MBP.
表达产物生物学活性的测定主要是根据sTNFR1在体外与TNF-α结合后, 可阻断TNF-α的生物学活性如抑制TNF-α的细胞毒性作用而设计的. 实验选用了非致瘤性人肝细胞QSG7701细胞系. TNF-α对QSG7701细胞毒性作用的最终结果是靶细胞的死亡, 所以可以用检测细胞毒力的方法进行, 如MTT法、3H-TdR掺入法、三磷酸腺苷发光法等. 目前MTT比色法已广泛用于检测细胞的增殖或某些细胞毒性试剂所介导的细胞死亡, 具有操作简便, 快速、结果可靠、重复性好、灵敏度高, 无放射性污染等特点, 可用于少于3000个细胞的研究[14]. 本研究MTT法用TNF-α敏感的QSG7701细胞进行细胞学活性测定表明, 随着重组蛋白浓度的增高, 对TNF-α细胞毒效应的抑制作用增强 , 当浓度为40 µg/mL几乎可完全阻断TNFα的细胞毒性作用. 此结果与文献报道的一致[15-16]. 这为sTNFR1下一步的实验研究打下了基础.
TNF-α是体内重要的免疫调节因子和炎症介质, 其过度表达在肝功能衰竭的发生发展的病理过程中发挥着重要作用. TNF-α的可溶性受体1(sTNFR1)可中和TNF的毒性作用. 本研究以此为目标, 希望对肝功能衰竭的治疗做出贡献.
1 原发性损伤: 指机体在致病因子对肝细胞造成的直接病理损伤, 肝脏出现大量单核巨噬细胞浸润, 肝内枯否细胞活跃, 局部TNF-α产生过量.
2 继发性损伤: 指在原发性病理损伤基础上, 由于肝脏屏障功能受损, 肠道来源的内毒素容易通过肝脏形成肠源性内毒素血症, 刺激机体单核-吞噬细胞系统分泌大量的TNF-α, 形成第二次打击, 造成肝细胞大面积坏死.
本研究通过基因工程技术获得了人sTNFR1-MBP融合蛋白, 并验证了其活性, 为肝衰竭防治的基础性研究, 结果有一定科学理论价值及临床应用前景, 同时反映了我国在该领域的基础研究进展,有一定可读性和创新性.
电编: 郭海丽 编辑:张焕兰
| 1. | Ding WX, Yin XM. Dissection of the multiple mechanisms of TNF-alpha-induced apoptosis in liver injury. J Cell Mol Med. 2004;8:445-454. [PubMed] [DOI] |
| 3. | Yang BS, Ma YJ, Wang Y, Chen LY, Bi MR, Yan BZ, Bai L, Zhou H, Wang FX. Protective effect and mechanism of stronger neo-minophagen C against fulminant hepatic failure. World J Gastroenterol. 2007;13:462-466. [PubMed] [DOI] |
| 4. | Song HL, Lu S, Liu P. Tumor necrosis factor-alpha induces apoptosis of enterocytes in mice with fulminant hepatic failure. World J Gastroenterol. 2005;11:3701-3709. [PubMed] [DOI] |
| 5. | Shalaby MR, Pennica D, Palladino MA Jr. An overview of the history and biologic properties of tumor necrosis factors. Springer Semin Immunopathol. 1986;9:33-37. [PubMed] [DOI] |
| 6. | Loetscher H, Pan YC, Lahm HW, Gentz R, Brockhaus M, Tabuchi H, Lesslauer W. Molecular cloning and expression of the human 55 kd tumor necrosis factor receptor. Cell. 1990;61:351-359. [PubMed] [DOI] |
| 8. | 顾 长海, 王 宇明. 肝功能衰竭. 北京: 人民卫生出版社 2002; 151-191. |
| 9. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 10. | Ishida Y, Kondo T, Tsuneyama K, Lu P, Takayasu T, Mukaida N. The pathogenic roles of tumor necrosis factor receptor p55 in acetaminophen-induced liver injury in mice. J Leukoc Biol. 2004;75:59-67. [PubMed] [DOI] |
| 11. | Lozano JM, Collado JA, Medina T, Muntane J. Protection against liver injury by PGE1 or anti-TNF-alpha is associated with a reduction of TNF-R1 expression in hepatocytes. Scand J Gastroenterol. 2003;38:1169-1175. [PubMed] [DOI] |
| 12. | Streetz K, Leifeld L, Grundmann D, Ramakers J, Eckert K, Spengler U, Brenner D, Manns M, Trautwein C. Tumor necrosis factor alpha in the pathogenesis of human and murine fulminant hepatic failure. Gastroenterology. 2000;119:446-460. [PubMed] [DOI] |
| 13. | Maina CV, Riggs PD, Grandea AG 3rd, Slatko BE, Moran LS, Tagliamonte JA, McReynolds LA, Guan CD. An Escherichia coli vector to express and purify foreign proteins by fusion to and separation from maltose-binding protein. Gene. 1988;74:365-373. [PubMed] [DOI] |
| 14. | Hussain RF, Nouri AM, Oliver RT. A new approach for measurement of cytotoxicity using colorimetric assay. J Immunol Methods. 1993;160:89-96. [PubMed] [DOI] |