修回日期: 2007-02-04
接受日期: 2007-03-17
在线出版日期: 2007-05-08
目的: 构建L02/HBx转基因细胞模型并研究HBx对肝细胞周期的影响.
方法: 运用脂质体转染和G418筛选获得L02/HBx阳性克隆, 并分别用RT-PCR和Western blot鉴定HBx mRNA与蛋白的表达. 进一步用四唑蓝(MTT)比色试验、流式细胞仪检测L02/HBx的增殖、凋亡和细胞周期.
结果: RT-PCR和Western blot分别检测到L02/HBx细胞中HBx mRNA和蛋白的表达. MTT比色试验显示L02/HBx生长速度加快, 流式细胞仪检测发现L02/HBx凋亡率低(0.09%±0.13% vs 3.74%±1.29%, P<0.05), G1期细胞比例减少(61.35%±0.82% vs 67.80±6.84%, P<0.05), S期细胞比例相应增加(36.59%±2.54% vs 22.37%±2.17%, P<0.05). 经阿霉素(ADM)培养后, L02/HBx的凋亡率显著增加(34.91%±5.85% vs 0.09%±0.13%, P<0.05), G1期细胞比例明显增加但低于对照组(82.81%±6.48% vs 61.35%±0.82%, P<0.05; 82.81%±6.48% vs 87.19%±1.92%, P<0.05), S期细胞比例降低但较对照组高(13.84%±6.16% vs 36.59%±2.54%, P<0.05; 13.84%±6.16% vs 2.22%±1.26%, P<0.05).
结论: L02/HBx构建成功, HBx能促进细胞周期进程, 加快细胞的生长并抑制细胞的凋亡; 转染HBx基因的肝细胞凋亡更易受凋亡因子所触发, 表明HBx可能会增加正常肝细胞对诱导凋亡因素的敏感性.
引文著录: 程斌, 林松挺, 杨玉珍, 黎培员. 转基因细胞模型L02/HBx的构建及HBx对细胞周期的影响. 世界华人消化杂志 2007; 15(13): 1488-1493
Revised: February 4, 2007
Accepted: March 17, 2007
Published online: May 8, 2007
AIM: To establish gene-transfected cell strain L02/HBx and study its cell cycle changes.
METHODS: Effectene transfection and G418 selection were used to obtain the positive clones of L02/HBx cells. Then HBx mRNA and protein expression were detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot analysis, respectively. Finally, MTT assay and flow cytometry were adopted to measure the proliferation, apoptosis and cell cycles of L02/HBx cells.
RESULTS: RT-PCR and Western blot analysis showed that the positive clones had HBx expression at mRNA and protein level. MTT assay demonstrated that the proliferation of L02/HBx cells had been accelerated. Flow cytometry found that the apoptosis rates of L02/HBx cells were at a lower level (0.09% ± 0.13% vs 3.74% ± 1.29%, P < 0.05), and the proportion of L02/HBx cells fell G1 phase (61.35% ± 0.82% vs 67.80% ± 6.84%, P < 0.05) but rose in S phase (36.59% ± 2.54% vs 22.37% ± 2.17%, P < 0.05). After co-culture with adriamycin, L02/HBx cells manifested a higher apoptosis rate (34.91% ± 5.85% vs 0.09% ± 0.13%, P < 0.05), and the proportion of G1-phase cells was significantly increased (82.81% ± 6.48% vs 61.35% ± 0.82%, P < 0.05), but still lower than that in the non-transfected group (82.81% ± 6.48% vs 87.19% ± 1.92%, P < 0.05). However, the percentage of S-phase cells was markedly decreased (13.84% ± 6.16% vs 36.59% ± 2.54%, P < 0.05), but still higher than that in the non-transfected group (13.84% ± 6.16% vs 2.22% ± 1.26%, P < 0.05).
CONCLUSION: L02/HBx cell strain stably expressing HBx is established successfully. HBx can accelerate the cell cycles and improve the growth instead of facilitating the apoptosis. L02/HBx cells can be easily affected by the apoptotic factors, indicating that HBx may increase the susceptibility of normal liver cells to the apoptosis-inducing factors.
- Citation: Cheng B, Lin ST, Yang YZ, Li PY. Establishment of gene-transfected cell strain L02/HBx and effect of HBx on the cell cycles. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1488-1493
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1488
HBx蛋白具有广泛的反式激活作用, 可通过许多复杂的途径参与细胞凋亡、参与DNA修复调控、促进细胞周期进程, 与肝细胞癌(HCC)的发生、发展具有密切的关系[1-2]. 体内与体外的一些实验研究已为HBx参与HCC发生机制提供了依据[3-7]. 为此, 我们通过脂质体转染将HBx基因导入L02细胞中, 采用G418筛选获取稳定表达HBx的转基因细胞模型L02/HBx, 观察HBx对肝细胞周期、增殖及凋亡的影响, 研究阿霉素与HBx在细胞凋亡中的协同作用, 旨在探索HBx致肝细胞恶性转化与HCC发生的分子机制.
Effectene转染试剂盒(Invitrogen); G418(Promega); 各种限制性核酸内切酶、聚合酶等(TaKaRa); 鼠抗HBx mAb(ABCam). 重组质粒pcDNA3.1(+)/v5-hisB-HBx由上海第二军医大学遗传研究所何晓文教授惠赠; DH5α由西班牙Navarra大学癌症基因研究所钱程教授提供; L02细胞由中国科学院上海生命科学研究院生物化学与细胞生物学研究所刘新垣院士惠赠. 扩增HBx基因片断上游引物为: 5'-CGGAATTCCGATGGCTGCTAGGCTGTG-3', 下游引物为: 5'-CCCTCGAGGGGTTGCATGGTGCTGGT-3', PCR引物合成及测序由上海英骏生物技术有限公司完成.
1.2.1 L02细胞的转染与筛选: 重组质粒pcDNA3.1(+)/v5-hisB-HBx经酶切、PCR及测序鉴定后按Effectene说明书进行转染操作, 48 h后用含500 mg/L G418的选择培养基筛选阳性克隆. 筛选至对照组细胞全部死亡后实验组存活的细胞即为阳性克隆, 挑取克隆扩大培养并将G418浓度减至250 mg/L维持筛选, 以获得稳定表达HBx的转基因细胞株(L02/HBx). 实验设空白对照组(L02细胞)与空载体对照组(转染pcDNA3.1的L02细胞, L02/ pcDNA3.1).
1.2.2 转基因细胞株L02/HBx的鉴定: RT-PCR检测HBx mRNA的表达: TRIzol一步法提取各组细胞总RNA(按试剂盒说明书操作), 经逆转录生成cDNA, 取2 μL cDNA作模板, 以上述引物扩增HBx基因片段, 条件如下: 94 ℃预变性10 min, 94 ℃变性45 s, 52 ℃退火1 min, 72 ℃延伸1 min, 扩增30个循环, 20 g/L琼脂糖凝胶电泳后成像观察.
Western blot检测HBx蛋白的表达: 各组细胞培养48 h后以细胞裂解液充分裂解, 100 ℃加热5 min, 4 ℃ 3600 g离心2 min, 吸上清上样后行SDS-PAGE电泳, 半干转印于NC膜上, 室温封闭1 h, 加入鼠抗HBx第一抗体, 4 ℃孵育过夜, 以TBST振摇洗涤3次, 加入羊抗鼠的第二抗体, 室温孵育1 h, 振摇洗涤4次, 采用Odyssey双色红外激光成像系统检测.
1.2.3 MTT法检测细胞的增殖: 各组细胞消化后配成单细胞悬液, 以1×104细胞/孔接种于96孔板, 共4板, 各设4复孔, 另设一PBS对照孔. 培养24 h后, 取出1板每孔加MTT溶液(0.5 g/L)100 μL, 置培养箱继续培养4 h, 吸弃孔内上清液, 每孔加入150 μL的DMSO, 振摇15 min溶解结晶, 酶联免疫检测仪于595 nm波长处分别测定各孔光吸收值(A值), 取其均数作为本次A值计数值. 培养48, 72, 96 h后再重复上述步骤检测, 以时间为横轴, A值为纵轴绘制各组细胞生长曲线图.
1.2.4 测定ADM诱导细胞凋亡的最佳浓度: 各组细胞均以1×104细胞/孔接种于96孔板, 各4板, 每板接种6排同组细胞, 均设4复孔, 另设一PBS对照孔, 分别加入4, 2, 1, 0.5, 0.25 mg/L不同浓度的ADM诱导L02/HBx、L02/pcDNA3.1和L02细胞凋亡, 并设一阴性对照(只接种细胞, 不加ADM). MTT检测方法同4, 在酶联免疫检测仪上595 nm波长处检测各孔A值, 并计算细胞生长抑制率, 确定ADM诱导各组凋亡的最佳浓度.
1.2.5 流式细胞术检测各组细胞周期及凋亡状况: 将各组细胞收获后, 用PBS洗涤1次, -20 ℃ 750 mL/L乙醇固定过夜, 取出离心收集细胞, PBS洗涤2次, 加入10 g/L Rnase37 ℃孵育15 min, 再加入碘化丙锭(PI)染色30 min, 300目尼龙网过滤, 采用FAC SAricaTM流式细胞仪检测细胞周期及凋亡状况. 各组细胞再加入诱导凋亡最佳浓度的ADM培养48 h后用上述相同方法处理, 上机检测细胞凋亡及细胞周期的变化.
统计学处理 结果用mean±SD表示, 对流式细胞仪检测的凋亡率及细胞周期的结果, 采用χ2检验. 对MTT检测细胞增殖和ADM诱导的凋亡, 采用方差分析, 运用SPSS13.0软件来完成, 以P<0.05为差异有统计学意义.
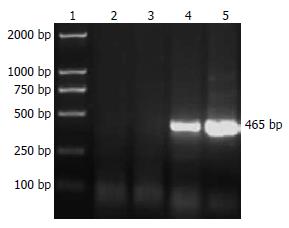
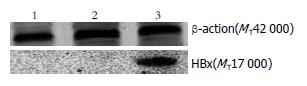
RT-PCR显示, 实验组L02/HBx可见465 bp的HBx条带, 而空白对照组L02细胞与转染空载体对照组L02/pcDNA3.1均未见HBx条带(图1), 表明L02/HBx在转录水平上有HBx mRNA的表达; Western blot显示实验组可见HBx蛋白表达条带, 而空白对照组与空载体对照组则未见HBx蛋白表达条带(图2). 表明稳定表达HBx的转基因细胞株L02/HBx构建成功.
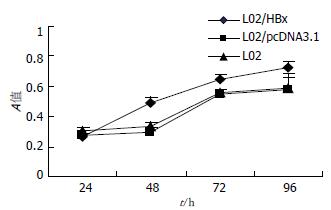
MTT法检测各组细胞A值发现, L02与L02/pcDNA3.1细胞生长速度基本一致(P>0.05), 而L02/HBx细胞在48, 72, 96 h各时间点的A值均明显高于对照组L02细胞和L02/pcDNA3.1(P<0.05), 表明L02/HBx细胞生长速度明显加快(图3), 显示HBx对L02细胞具有促增殖作用.
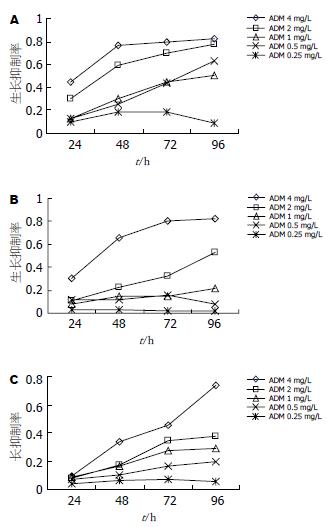
各组细胞经ADM处理后MTT检测结果显示(图4), 2 mg/L ADM导致L02/HBx生长抑制率与对照组相比, 差异显著(P<0.05); 其余浓度ADM导致L02/HBx生长抑制率与对照组相比, 抑制作用无明显区别(P>0.05), 确定ADM诱导凋亡的最佳浓度为2 mg/L.
乙型肝炎病毒(HBV)的慢性感染是世界范围内原发性肝癌的主要发病原因之一, 对其研究是目前的热点, 研究证实, HBV基因共有4个阅读框, 其中HBx基因存在于第4个阅读框, 位于第1374-1838位核苷酸, 长约465 bp, 在HBV中高度保守, 其编码的HBx蛋白分子量约为MT17 000, 具有强大的生物学功能, 可能在HCC的发生过程中起着十分关键的作用. 研究人员在HBV感染的慢性乙肝患者的肝组织, 肝硬化的肝组织及原发性肝癌组织中均能检测到HBx的存在[5,8]. Su et al[5]报道在HCC患者的癌组织中利用HBx的多种单克隆和多克隆抗体, 58.8%的患者可以检测到HBX野生型片段和变异型片段. 体外实验发现, 将HBx导入人小鼠的肝细胞中, 可以引起细胞的恶性转化[6], 将HBX基因转入小鼠体内, 可以诱发转基因小鼠肝癌形成[4]. 可见HBx与HCC具有一定相关性, 因此, 研究HBX引发肝细胞癌的复杂机制对于肝细胞癌新的诊断与防治策略具有重要的意义.
近来研究发现, HBx在HCC发生发展的过程中, 不是主要的致病因素而是作为辅助因子, 在转基因小鼠中, 表达低水平的HBx并不引起大面积的肝损害, 也不进展为HCC, 但能增加机体在致癌物质诱导下对肝癌具有易感性, 这与先前报道的HBV与化学致癌物的协调作用相一致[9-10], 对此, 科研工作者对HBX增加个体对HCC的易感性进行研究, 发现其可能机制为干扰细胞DNA的修复, 细胞周期和细胞凋亡的调控[11], 这说明HBx调控细胞周期和凋亡的机制极其复杂, 况且HBx对DNA修复的调控方面亦存在诸多的机制, 可能有: (1)灭活P53[12-13]; (2)与XAP-1结合[14]; (3)与TFIIH转录修复因子的XPB和XPD亚单位相互作用[15-16]; (4)与损伤DNA直接结合, 因此增加了修复蛋白与损伤处结合的难度[17]; (5)抑制DNA修复所必须通过的细胞周期检查点[18]; (6)胞质内HBx可能减弱了参与细胞对DNA损伤调节的细胞信号传导通路[18-19]. 这些调控网络如何发挥作用及在肝细胞癌发生过程中起到何种作用, 需要进一步研究, 因此, 研究HBx对正常肝细胞周期的影响以及与凋亡的关系可为探索HBx致HCC新机制奠定基础.
本实验通过脂质体介导的转染将X基因导入L02细胞中, 通过G418筛选获取稳定表达HBx的转基因细胞模型L02/HBx, 在此基础上用MTT检测了L02/HBx, L02/pcDNA3.1和 L02细胞的增殖情况, 结果发现L02/HBx的生长速度远远高于其他两组细胞, 这些说明HBx具有促进细胞增殖的作用, 我们进一步通过流式细胞仪分别检测L02/HBx, L02/pcDNA3.1和 L02细胞周期特点和凋亡情况, 同时运用ADM培养后观察细胞凋亡及细胞周期的变化, 结果发现, 在未用ADM培养时, L02/HBx细胞凋亡率较低, 只有(0.09±0.13)%, 几乎是没有凋亡, 而其他两组对照组细胞L02/pcDNA3.1和L02的凋亡率较高, 分别达到(3.74±1.29)%和(4.31±2.35)% , 细胞周期中L02/HBx在G1期比例下降, S期所占的比例增高, 这说明HBx在没有诱导凋亡因素存在时可能为加速细胞周期进程、促进细胞生长和抑制细胞凋亡的作用, 而使用ADM培养后三组细胞G1期所占比例显著增高, 表明细胞周期均被ADM阻滞于G1期, L02/HBx凋亡率大大增加, 达(34.91±5.85)%, 远远高于其他两组, 同时细胞周期中S期所占比例比其他两组高, 且G1期的比例比另外两组低, 这可能与HBx使损伤的DNA通过G1期而受阻于S期, 而损伤的DNA并没有得到及时修复, 故而触发细胞的凋亡机制而促进细胞凋亡, 可以推断, HBx在诱导凋亡因素作用下可能为促进细胞凋亡的作用, 与文献报道一致[20]. 但HBx与细胞凋亡的关系极其复杂, 现有研究报道, HBx与凋亡呈双向调节机制即HBx既可以促进肝细胞凋亡也可以抑制肝细胞凋亡[21-29], 因此, HBx是促进凋亡还是抑制凋亡可能与其所处的环境具有很大的关系[30]. 因而, 可以通过研究HBx在不同肝细胞中的表达情况及与凋亡的关系, 通过流式细胞仪检测细胞周期的不同特点, 从而揭示HBx对肝细胞的影响, 下一步我们将研究HBx与DNA修复酶的关系来研究其在肝细胞癌发生过程中的作用, 并通过建立动物模型观察HBx的恶性转化实验, 以研究和揭示HBx在肝细胞癌发生过程中新的发病机制.
感谢中国科学院上海生命科学研究院生物化学与细胞生物学研究所刘新垣院士惠赠L02细胞!感谢西班牙Navarra大学癌症基因研究所钱程教授提供DH5α及在实验关键技术上的建议和帮助!
乙型肝炎病毒(HBV)慢性感染是我国肝细胞肝癌发生的主要原因之一. HBx基因是HBV DNA中最小的读码框, 其编码的HBx具有广泛的生物学功能, 包括反式激活病毒基因组和宿主细胞基因的转录、增强转录因子DNA结合特性、抑制P53蛋白活性、抑制细胞DNA的修复、参与细胞信号传导途径和细胞凋亡的调节等. 一些体内外研究发现, HBx可诱导肝细胞的恶性转化及癌变, 其如何参与乙肝相关性肝癌发生机制是目前研究的热点. 近来研究发现HBx与肝细胞凋亡的关系极其复杂, 既可促进细胞凋亡, 也可能抑制细胞凋亡.
本研究通过建立稳定表达HBx的转基因细胞模型L02/HBx, 观察HBx对肝细胞周期、增殖及凋亡的调控作用, 在此基础上着重观察阿霉素干预下HBx对肝细胞凋亡的影响, 探讨凋亡因子与HBx在肝细胞凋亡中的协同作用, 进一步探索HBx致肝细胞恶性转化与HCC发生的分子机制.
作者通过构建L02/HBx, 发现HBx能促进细胞周期进程, 加快细胞的生长并抑制细胞的凋亡; 进一步研究显示, 转染HBx基因的肝细胞凋亡更易受凋亡因子所触发, 表明HBx可能会增加正常肝细胞对诱导凋亡因素的敏感性. 研究具有一定的创新性, 论述比较清晰, 数据比较有说服力.
电编: 郭海丽 编辑:张焕兰
| 1. | Wang XZ, Jiang XR, Chen XC, Chen ZX, Li D, Lin JY, Tao QM. Seek protein which can interact with hepatitis B virus X protein from human liver cDNA library by yeast two-hybrid system. World J Gastroenterol. 2002;8:95-98. [PubMed] [DOI] |
| 2. | Arbuthnot P, Kew M. Hepatitis B virus and hepatocellular carcinoma. Int J Exp Pathol. 2001;82:77-100. [PubMed] [DOI] |
| 3. | Hohne M, Schaefer S, Seifer M, Feitelson MA, Paul D, Gerlich WH. Malignant transformation of immortalized transgenic hepatocytes after transfection with hepatitis B virus DNA. EMBO J. 1990;9:1137-1145. [PubMed] |
| 4. | Koike K, Moriya K, Iino S, Yotsuyanagi H, Endo Y, Miyamura T, Kurokawa K. High-level expression of hepatitis B virus HBx gene and hepatocarcinogenesis in transgenic mice. Hepatology. 1994;19:810-819. [PubMed] [DOI] |
| 5. | Su Q, Schroder CH, Hofmann WJ, Otto G, Pichlmayr R, Bannasch P. Expression of hepatitis B virus X protein in HBV-infected human livers and hepatocellular carcinomas. Hepatology. 1998;27:1109-1120. [PubMed] [DOI] |
| 6. | Qadri I, Ferrari ME, Siddiqui A. The hepatitis B virus transactivator protein, HBx, interacts with single-stranded DNA (ssDNA). Biochemical characterizations of the HBx-ssDNA interactions. J Biol Chem. 1996;271:15443-15450. [PubMed] [DOI] |
| 7. | Hoare J, Henkler F, Dowling JJ, Errington W, Goldin RD, Fish D, McGarvey MJ. Subcellular localisation of the X protein in HBV infected hepatocytes. J Med Virol. 2001;64:419-426. [PubMed] [DOI] |
| 8. | Wang WL, London WT, Feitelson MA. Hepatitis B x antigen in hepatitis B virus carrier patients with liver cancer. Cancer Res. 1991;51:4971-4977. [PubMed] |
| 9. | Bannasch P, Khoshkhou NI, Hacker HJ, Radaeva S, Mrozek M, Zillmann U, Kopp-Schneider A, Haberkorn U, Elgas M, Tolle T. Synergistic hepatocarcinogenic effect of hepadnaviral infection and dietary aflatoxin B1 in woodchucks. Cancer Res. 1995;55:3318-3330. [PubMed] |
| 10. | Ghebranious N, Sell S. Hepatitis B injury, male gender, aflatoxin, and p53 expression each contribute to hepatocarcinogenesis in transgenic mice. Hepatology. 1998;27:383-391. [PubMed] [DOI] |
| 11. | BSohn S, Jaitovitch-Groisman I, Benlimame N, Galipeau J, Batist G, Alaoui-Jamali MA. Retroviral expression of the hepatitis B virus x gene promotes liver cell susceptibility to carcinogen-induced site specific mutagenesis. Mutat Res. 2000;460:17-28. [PubMed] [DOI] |
| 12. | Prost S, Ford JM, Taylor C, Doig J, Harrison DJ. Hepatitis B x protein inhibits p53-dependent DNA repair in primary mouse hepatocytes. J Biol Chem. 1998;273:33327-33332. [PubMed] [DOI] |
| 13. | Wang XW, Yeh H, Schaeffer L, Roy R, Moncollin V, Egly JM, Wang Z, Freidberg EC, Evans MK, Taffe BG. p53 modulation of TFIIH-associated nucleotide excision repair activity. Nat Genet. 1995;10:188-195. [PubMed] [DOI] |
| 14. | Lee TH, Elledge SJ, Butel JS. Hepatitis B virus X protein interacts with a probable cellular DNA repair protein. J Virol. 1995;69:1107-1114. [PubMed] |
| 15. | Wang XW, Forrester K, Yeh H, Feitelson MA, Gu JR, Harris CC. Hepatitis B virus X protein inhibits p53 sequence-specific DNA binding, transcriptional activity, and association with transcription factor ERCC3. Proc Natl Acad Sci USA. 1994;91:2230-2234. [PubMed] [DOI] |
| 16. | Qadri I, Conaway JW, Conaway RC, Schaack J, Siddiqui A. Hepatitis B virus transactivator protein, HBx, associates with the components of TFIIH and stimulates the DNA helicase activity of TFIIH. Proc Natl Acad Sci USA. 1996;93:10578-10583. [PubMed] [DOI] |
| 17. | Capovilla A, Carmona S, Arbuthnot P. Hepatitis B virus X-protein binds damaged DNA and sensitizes liver cells to ultraviolet irradiation. Biochem Biophys Res Commun. 1997;232:255-260. [PubMed] [DOI] |
| 18. | Benn J, Schneider RJ. Hepatitis B virus HBx protein deregulates cell cycle checkpoint controls. Proc Natl Acad Sci USA. 1995;92:11215-11219. [PubMed] [DOI] |
| 19. | Potapova O, Haghighi A, Bost F, Liu C, Birrer MJ, Gjerset R, Mercola D. The Jun kinase/stress-activated protein kinase pathway functions to regulate DNA repair and inhibition of the pathway sensitizes tumor cells to cisplatin. J Biol Chem. 1997;272:14041-14044. [PubMed] [DOI] |
| 21. | Elmore LW, Hancock AR, Chang SF, Wang XW, Chang S, Callahan CP, Geller DA, Will H, Harris CC. Hepatitis B virus X protein and p53 tumor suppressor interactions in the modulation of apoptosis. Proc Natl Acad Sci USA. 1997;94:14707-14712. [PubMed] [DOI] |
| 22. | Chang SF, Netter HJ, Hildt E, Schuster R, Schaefer S, Hsu YC, Rang A, Will H. Duck hepatitis B virus expresses a regulatory HBx-like protein from a hidden open reading frame. J Virol. 2001;75:161-170. [PubMed] [DOI] |
| 23. | Diao J, Khine AA, Sarangi F, Hsu E, Iorio C, Tibbles LA, Woodgett JR, Penninger J, Richardson CD. X protein of hepatitis B virus inhibits Fas-mediated apoptosis and is associated with up-regulation of the SAPK/JNK pathway. J Biol Chem. 2001;276:8328-8340. [PubMed] [DOI] |
| 24. | Huo TI, Wang XW, Forgues M, Wu CG, Spillare EA, Giannini C, Brechot C, Harris CC. Hepatitis B virus X mutants derived from human hepatocellular carcinoma retain the ability to abrogate p53-induced apoptosis. Oncogene. 2001;20:3620-3628. [PubMed] [DOI] |
| 25. | Terradillos O, de La Coste A, Pollicino T, Neuveut C, Sitterlin D, Lecoeur H, Gougeon ML, Kahn A, Buendia MA. The hepatitis B virus X protein abrogates Bcl-2-mediated protection against Fas apoptosis in the liver. Oncogene. 2002;21:377-386. [PubMed] [DOI] |
| 26. | Chami M, Ferrari D, Nicotera P, Paterlini-Brechot P, Rizzuto R. Caspase-dependent alterations of Ca2+ signaling in the induction of apoptosis by hepatitis B virus X protein. J Biol Chem. 2003;278:31745-31755. [PubMed] [DOI] |
| 27. | Chen HY, Tang NH, Li XJ, Zhang SJ, Chen ZX, Wang XZ. Transfection and expression of hepatitis B virus x gene and its effect on apoptosis in HL-7702 cells. World J Gastroenterol. 2004;10:959-964. [PubMed] |
| 28. | Tanaka Y, Kanai F, Kawakami T, Tateishi K, Ijichi H, Kawabe T, Arakawa Y, Kawakami T, Nishimura T, Shirakata Y. Interaction of the hepatitis B virus X protein (HBx) with heat shock protein 60 enhances HBx-mediated apoptosis. Biochem Biophys Res Commun. 2004;318:461-469. [PubMed] [DOI] |
| 29. | Kalra N, Kumar V. c-Fos is a mediator of the c-myc-induced apoptotic signaling in serum-deprived hepatoma cells via the p38 mitogen-activated protein kinase pathway. J Biol Chem. 2004;279:25313-25319. [PubMed] [DOI] |