修回日期: 2007-02-04
接受日期: 2007-02-22
在线出版日期: 2007-05-08
目的: 对不同转移潜能肝癌细胞株MHCC97- H(高转移)和MHCC97-L(低转移)差异表达的蛋白质进行二维液相色谱分离和MALDI-TOF质谱鉴定.
方法: 将肝癌细胞株MHCC97-H和MHCC97- L细胞裂解样品按蛋白质PI进行一维的色谱聚焦分离, 然后每个PI组分再按疏水性经二维反相无孔硅胶HPLC分离, 利用ProteoVue软件将UV光吸收图谱转换成PI对疏水性的胶图, 再利用DeltaVue软件比较升高或降低的差异蛋白. 收集差异蛋白峰进行胰酶酶解, 然后进行MALDI-TOF质谱鉴定.
结果: 2D图谱显示共有72个差异蛋白条带, 共鉴定出了9个差异蛋白, 分别为M2型丙酮酸激酶、ATP合成酶α亚单位、热休克蛋白60、Toll样受体9、含黄素单加氧酶、钙网硬蛋白前体、锰超氧化物岐化酶、nm23-H1、G-蛋白偶连受体激酶5; 其中4个蛋白在高转移细胞株MHCC97-H中表达升高, 5个蛋白在低转移细胞株MHCC97-L表达升高.
结论: 这些差异蛋白可能在肝癌的转移中起关键作用.
引文著录: 彭艳, 张霞, 王葵, 蒋平, 焦炳华, 倪健. 不同转移潜能肝癌细胞株的差异蛋白质组的二维液相色谱分析. 世界华人消化杂志 2007; 15(13): 1482-1487
Revised: February 4, 2007
Accepted: February 22, 2007
Published online: May 8, 2007
AIM: To analyze the proteome of hepatocellular carcinoma cell lines, MHCC97-H (high metastasis) and MHCC97-L (low metastasis), with different metastasis potentials by two-dimentional liquid phase chromatographic fractionation followed by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF/MS).
METHODS: Cell lysates of MHCC97-H and MHCC97-L were fractionated according to PI using chromatofocusing with analytical columns in the first dimension, followed by separation of the proteins in each PI fraction using nonporous reversed-phase high performance liquid chromatography (HPLC). A two-dimensional map of the protein content for each cell line based upon pI versus hydrophobicity as detected by UV absorption was generated and a differential display map indicating the presence of up- or down-regulated proteins was exhibited using ProteoVue and DltaVue software. The different proteins were digested by trypsin and MALDI-TOF/MS was performed.
RESULTS: Image analysis of two-dimensional map revealed 72 differentially expressed proteins between MHCC97-H and MHCC97-L cells, and 9 protein peaks (including M2 pyruvate kinase, α-subunit of ATP synthase, heat shock protein 60, Toll-like receptor 9, flavoprotein oxygenase, pro-calreticulin, manganese superoxide dismutase, nm23-H1, and G-protein-coupled receptor kinase 5) were further identified by tryptic digestion, peptide mass fingerprinting and mass spectrometry. Four proteins were up-regulated while 5 were down-regulated in MHCC97-H cells.
CONCLUSION: The identified differentially expressed proteins may play important roles in the metastasis of hepatocellular carcinoma.
- Citation: Peng Y, Zhang X, Wang K, Jiang P, Jiao BH, Ni J. Proteome analysis of hepatocellular carcinoma cell lines with different metastasis potentials by two-dimensional liquid chromatography. Shijie Huaren Xiaohua Zazhi 2007; 15(13): 1482-1487
- URL: https://www.wjgnet.com/1009-3079/full/v15/i13/1482.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i13.1482
肝细胞癌(hepatocellular carcinomar, HCC)是世界上最常见的恶性肿瘤之一, 占全部恶性肿瘤的6%[1], 5 a死亡率超过90%[2]. 中国是世界上肝癌死亡率最高的国家, 占世界上肝癌总死亡人数的53%. 肝癌患者的预后极差, 术后的复发与转移是影响肝癌远期疗效的重要因素[3], 所以进行肝癌转移相关蛋白的研究尤为重要.
蛋白组学技术是寻找肿瘤相关性蛋白的行之有效的方法. 2D-PAGE和质谱方法的联合应用是目前筛选肿瘤特异性标志物应用最为广泛的方法[4], 最近二维液相色谱分离法(two-dimentional liquid phase chromatographic fractionation, 2D-LC)结合各种质谱联用的多维色谱分离技术的应用也越来越多[5].
复旦大学肝癌研究所建立了人的高、低转移肝癌细胞株MHCC97-H和MHCC97-L[6]. 高转移肝癌细胞株MHCC97-H表现出100%的肺转移能力, 而低转移肝癌细胞株MHCC97-L仅发生40%的肺转移[6-7]. 该模型为研究肝癌的转移奠定了良好的基础. 我们利用2D-LC和基质辅助激光解吸电离-飞行时间质谱(matrix-assisted laser desorption/ ionization-time of flight mass spectrometry, MALDI-TOF/MS)对高、低转移肝癌细胞株进行了差异蛋白质组的分离和鉴定.
二维液相色谱仪Proteme Lab TM PF2D和及其配套试剂盒Proteme Lab TM PF2D试剂盒均为贝克曼(Beckman)公司产品, 试剂盒包括HPCF 1D色谱柱(2.1 mm×250 mm)、HPRP 2D无孔硅胶C18反相色谱柱(4.6 mm×33 mm)、起始缓冲液(start buffer, SB)、洗脱缓冲液(eluent buffer, EB)和PD10 G-25脱盐柱(Sephadex TM G-25, Amersham Pharmacia Biotech). 正辛基β-D-吡喃葡萄糖苷(n-octyl-β-D-glucopyranoside, OG)、Tris-(carboxyethyl) phosphine hydrochloride (TCEP)、蛋白酶抑制剂混合物(protease inhibitor cocktail)、亚氨基二乙酸(iminodiacetic)均购于Sigma公司, 乙腈、三氟乙酸(TFA)、甲醇等均为色谱纯(上海申越公司), 所用的水均为Milli-Q水. BCA法蛋白浓度检测试剂盒购于碧云天公司.
1.2.1 细胞培养和样品制备: 高、低转移肝癌细胞株MHCC97-H和MHCC97-L培养于含100 mL/L胎牛血清的高糖DMEM培养基(Gibco公司)中, 置于37 ℃、50 mL/L CO2、饱和湿度培养箱内. 细胞长到对数生长期, 胰酶消化, 分别收集约108个细胞, 用预冷的PBS洗3次, 2000 g离心10 min, 在细胞沉淀中加入0.4 mL的50 mmol/L的Tris碱(pH值7.8-8.2), 混匀后加入1.6 mL的细胞裂解缓冲液(7.5 mol/L尿素, 2.5 mol/L硫脲, 125 mL/L甘油, 50 mmol/L Tris碱, 25 g/L OG, 6.25 mmol/L TCEP, 1.25 mmol/L蛋白酶抑制剂混合物), 充分振荡, 于4 ℃、20 000 g离心60 min, 吸取上清弃沉淀, 加SB至最后体积为2.5 mL, 然后加入到已用25 mL SB平衡的PD-10柱, 弃掉洗脱液, 再用SB洗脱并收集前3.5 mL. BCA法测定蛋白浓度.
1.2.2 二维液相色谱分离: 参照文献[8]方法, 简述如下: 以30 CV(柱体积)的SB平衡柱子(约130 min), 分别加入经SB置换的MHCC97-H和MHCC97-L细胞裂解样品2.5 mg, 以SB冲洗20 min, 收集洗脱出来的pI>8.5的蛋白组分和4.0<pI<8.5之间的每间隔0.3个pH单元收集的蛋白组分(组分10-25), 分别进行二维分析, ProteoVue软件将每个样品的原始的UV光密度值转换成胶图, 再利用DeltaVue软件进行两组资料的对比, 峰面积相差2倍以上定为差异峰. 收集表达差异的峰, 于-20 ℃冻存以进行质谱鉴定.
1.2.3 样品的酶解和MALDI-TOF质谱鉴定: 将收集的样品加入适量胰酶, 37 ℃放置4 h或4 ℃过夜. 酶解产物经浓缩后, 样品用高通量的MALDI-TOF/MS质谱仪检测. 激光源为337 nm波长的氮气激光器, 激光能量85 µJ, 激光脉冲频率20 Hz. 数据采集采用MCA(multiple cycle accumulation)模式, 累积的时间人工控制, 以能得到良好的信噪比为准, 通常在2 min之内. 先对样品进行MS检测, 部分蛋白选取合适的肽段峰进行串级质谱分析. 碰撞气体为氩气, 碰撞能量通常为65-100 eV, 采集时根据串级图谱碎片情况调整. 串级图谱母离子误差范围50 ppm, 碎片离子0.15 Da. 其他搜索参数设置: 数据库为NCBInr, 酶为胰蛋白酶, 允许漏切位点为2.
1.2.4 数据库检索: 质谱数据用MSFit软件进行检索. MS图谱用肽质量指纹法(PMF)搜索, 采用两己知质量的峰1020.5035和2163.0569进行两点内标质量校正. 质量误差范围50 ppm. 串级图谱母离子误差范围50 ppm, 碎片离子0.15 Da. 其他搜索参数设置: 数据库为NCBInr. 酶为胰蛋白酶, 允许漏切位点为2.
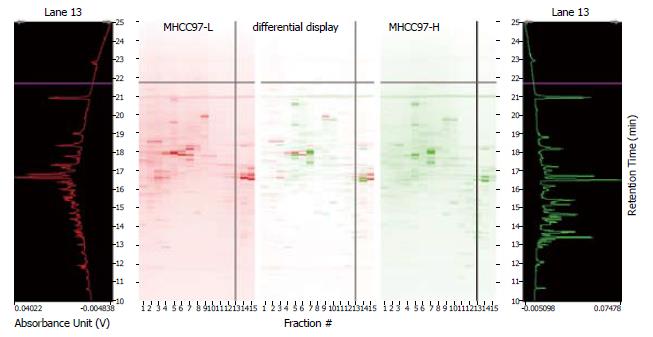
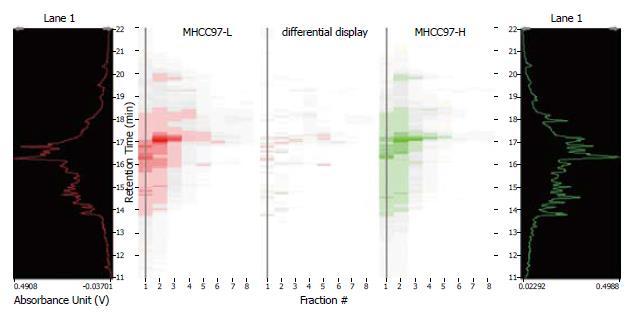
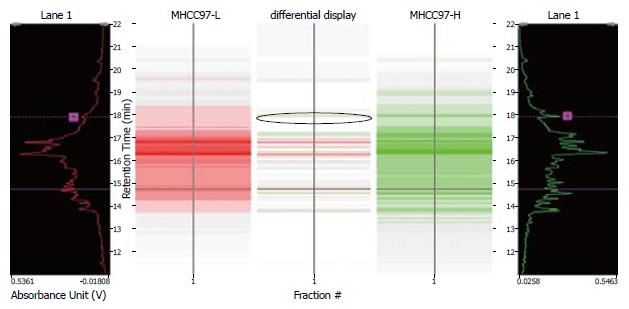
将高、低转移肝癌细胞株MHCC97-H和MHCC97-L进行了二维液相色谱分析, 分别比较了4.0<pI<8.5的第11-25蛋白组分(每间隔0.3个pH单元收集的样品)和pI>8.5的第2-9蛋白组分. 利用DeltaVue软件将两组资料进行了对比, 图1显示了MHCC97-H和MHCC97-L的第11-25组分的差异蛋白质, 图2显示了MHCC97-H和MHCC97-L的第2-9组分的差异蛋白质的比较. 图3为组分2中差异蛋白的比较. 收集表达差异的峰, 并进行了质谱鉴定.
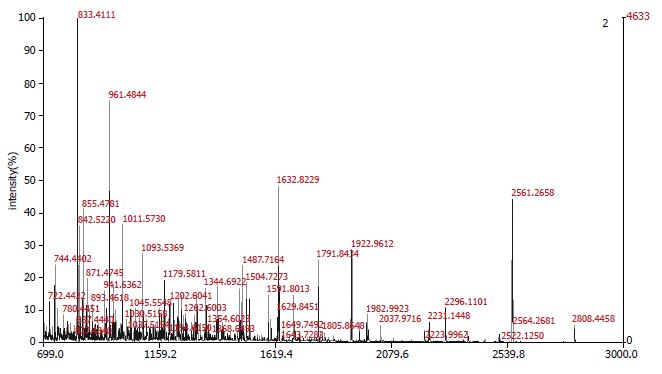
收集样品经胰酶酶解、质谱检测, MS图谱用肽质量指纹法(PMF)及MSFit软件搜索NCBInr非冗余蛋白质数据库, 搜索结果同时满足以下三个条件时才认为是正确匹配: (1)PMF法在50 ppm误差范围内至少有5个匹配肽段, 而且得分与排名第二的蛋白要有明显差距; (2)匹配蛋白的等电点与实测值相近; (3)蛋白质覆盖率为20%以上. 共鉴定出9种差异表达蛋白(表1), 图4为差异蛋白之一热休克蛋白60 (HSP60)的质谱图.
| 蛋白质 | 理论值(分子量/等电点) | 匹配肽段 | 覆盖率 | 表达水平(在MHCC97-H中) |
| M2型丙酮酸激酶 | 58.45/7.58 | 8 | 28% | ↑ |
| ATP合成酶α亚单位 | 59.75/9.20 | 10 | 67% | ↑ |
| 热休克蛋白60 | 61.05/5.70 | 14 | 26% | ↑ |
| Toll样受体9 | 11.59/8.7 | 5 | 28% | ↓ |
| 含黄素单加氧酶 | 53.64/6.8 | 5 | 77% | ↓ |
| 钙网硬蛋白前体 | 48.10/4.29 | 6 | 36% | ↓ |
| 锰超氧化物岐化酶 | 22.30/6.86 | 5 | 26% | ↓ |
| nm 23-H1 | 17.15/5.83 | 6 | 31% | ↓ |
| G-蛋白偶连受体激酶5 | 67.79/8.39 | 5 | 33% | ↑ |
蛋白质组学作为一种新兴的技术, 已经为揭示疾病发病机制、寻找新的检测指标蛋白和治疗靶点以及新药研发提供了强有力的工具. 目前2D-PAGE和质谱连用是应用最广泛的一种技术路线, 但其分离能力有一定限度, 难以检测到低丰度和难溶水的蛋白, 且重复性较差[4]. 因此以2D-LC结合各种质谱联用为主的技术平台越来越受到重视, 我们应用的2D-LC包括液相状态下的色谱聚焦(利用蛋白的等电点进行分离)及无孔硅胶反向HPLC分离(利用蛋白的疏水性分离). 目前在肿瘤的蛋白质组研究中, 2D-LC已经应用于人肠腺癌细胞的药物处理前后的差异蛋白的比较[9]、人正常卵巢组织细胞与癌细胞蛋白表达图谱的比较研究[10]以及应用于筛选前列腺癌相关的血清标记物的蛋白质芯片的研究中[11]等. 与2D-PAGE相比, 2D-LC具有几个重要的优点如上样量大(2-5 mg)、灵敏度高, 有利于低丰度蛋白质的检测; 分辨率高, 无孔硅胶柱的无孔键合相更有利于蛋白质的快速、高分辨的分离, 可获得蛋白质表达谱比较的更精细信息; 有利于碱性蛋白的检测, 本文将pH大于8.5的蛋白组分也进行了收集、比较和鉴定, 得到等电点为9.20的ATP合成酶α亚单位; 重复性好. 因此应用2D-LC研究蛋白质组差异将成为寻找癌症等疾病分子标记和药物靶标最有效的方法之一.
目前对肝癌的蛋白质组研究和其他肿瘤一样, 主要是在细胞系上的蛋白图谱比较和鉴定. 最初的工作是Wirth et al[12]完成的, 他们比较了肝癌细胞系HepG2, Huh-7, SK-Hep1和正常肝细胞系Chang和WRL68的蛋白表达情况, 由于蛋白鉴定使用的是N-末端测序和免疫印记, 所能鉴定的蛋白有限. 文献报道中对肝癌细胞系的蛋白质组研究比较深入的是新加坡Seow et al[13]对HCCM的研究, 应用MALDI-TOF-MS技术他们鉴定了约400个蛋白. 用2D-PAGE蛋白质组学的方法对肝癌转移相关蛋白的研究已有一些文献报道, 其中包括各种肝癌细胞系[14-16]和组织[17], 相关的双向电泳数据库正在完善之中. 但是用二维液相蛋白质组学技术研究肝癌转移相关蛋白未见报道, 本次实验我们鉴定出9种肝癌转移相关蛋白, 其中4个蛋白在高转移细胞株MHCC97-H中表达升高, 5个蛋白在低转移细胞株MHCC97-L表达升高, 为深入研究肝癌转移机制提供了一些关键蛋白分子.
蛋白质组学作为一种新兴的技术, 已经为揭示疾病发病机制、寻找新的检测指标蛋白和治疗靶点以及新药研发提供了强有力的工具. 二维液相色谱分离(2D-LC)结合各种质谱联用为主的技术平台越来越受到重视.
目前在肿瘤的蛋白质组研究中, 2D-LC已经应用于人肠腺癌细胞的药物处理前后的差异蛋白的比较、人正常卵巢组织细胞与癌细胞蛋白表达图谱的比较研究以及应用于筛选前列腺癌相关的血清标记物的蛋白质芯片的研究中等. 因此应用2D-LC研究蛋白质组差异将成为寻找癌症等疾病分子标记和药物靶标最有效的方法之一. 亟待研究的问题是蛋白的质谱鉴定.
用2D-PAGE蛋白质组学的方法对肝癌转移相关蛋白的研究已有一些文献报道, 其中包括各种肝癌细胞系和组织, 相关的双向电泳数据库正在完善之中.
本文鉴定的肝癌转移相关蛋白为深入研究肝癌转移机制提供了一些关键蛋白分子, 有可能成为肝癌等肿瘤的诊断指标和药物靶标.
本文利用二维液相色谱(2D-LC)分离技术和基质辅助激光解吸电离-飞行时间质谱对高、低转移肝癌细胞株进行了差异蛋白质组的分离和鉴定, 共观察到72个差异明显的蛋白峰, 收集了26个样品进行了质谱鉴定, 鉴定出9种蛋白. 该研究对于从蛋白组份差异方面进一步认识、了解高、低转移肝癌细胞株的不同生物学特性有一定学术价值. 设计上比较科学, 内容新颖, 重点突出, 有一定的可读性.
电编: 张敏 编辑:张焕兰
| 1. | Szklaruk J, Silverman PM, Charnsangavej C. Imaging in the diagnosis, staging, treatment, and surveillance of hepatocellular carcinoma. AJR Am J Roentgenol. 2003;180:441-454. [PubMed] [DOI] |
| 2. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 4. | Ong SE, Pandey A. An evaluation of the use of two-dimensional gel electrophoresis in proteomics. Biomol Eng. 2001;18:195-205. [PubMed] [DOI] |
| 5. | Wang H, Hanash S. Multi-dimensional liquid phase based separations in proteomics. J Chromatogr B Analyt Technol Biomed Life Sci. 2003;787:11-18. [PubMed] [DOI] |
| 6. | Li Y, Tang ZY, Ye SL, Liu YK, Chen J, Xue Q, Chen J, Gao DM, Bao WH. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol. 2001;7:630-636. [PubMed] |
| 7. | Tang ZY, Sun FX, Tian J, Ye SL, Liu YK, Liu KD, Xue Q, Chen J, Xia JL, Qin LX. Metastatic human hepatocellular carcinoma models in nude mice and cell line with metastatic potential. World J Gastroenterol. 2001;7:597-601. |
| 9. | Yan F, Subramanian B, Nakeff A, Barder TJ, Parus SJ, Lubman DM. A comparison of drug-treated and untreated HCT-116 human colon adenocarcinoma cells using a 2-D liquid separation mapping method based upon chromatofocusing PI fractionation. Anal Chem. 2003;75:2299-2308. [PubMed] [DOI] |
| 10. | Kachman MT, Wang H, Schwartz DR, Cho KR, Lubman DM. A 2-D liquid separations/mass mapping method for interlysate comparison of ovarian cancers. Anal Chem. 2002;74:1779-1791. [PubMed] [DOI] |
| 11. | Yan F, Sreekumar A, Laxman B, Chinnaiyan AM, Lubman DM, Barder TJ. Protein microarrays using liquid phase fractionation of cell lysates. Proteomics. 2003;3:1228-1235. [PubMed] [DOI] |
| 12. | Wirth PJ, Hoang TN, Benjamin T. Micropreparative immobilized pH gradient two-dimensional electrophoresis in combination with protein microsequencing for the analysis of human liver proteins. Electrophoresis. 1995;16:1946-1960. [PubMed] [DOI] |
| 13. | Seow TK, Ong SE, Liang RC, Ren EC, Chan L, Ou K, Chung MC. Two-dimensional electrophoresis map of the human hepatocellular carcinoma cell line, HCC-M, and identification of the separated proteins by mass spectrometry. Electrophoresis. 2000;21:1787-1813. [PubMed] [DOI] |
| 14. | Ding SJ, Li Y, Shao XX, Zhou H, Zeng R, Tang ZY, Xia QC. Proteome analysis of hepatocellular carcinoma cell strains, MHCC97-H and MHCC97-L, with different metastasis potentials. Proteomics. 2004;4:982-994. [PubMed] [DOI] |
| 15. | Cui JF, Liu YK, Pan BS, Song HY, Zhang Y, Sun RX, Chen J, Feng JT, Tang ZY, Yu YL. Differential proteomic analysis of human hepato-cellular carcinoma cell line metastasis-associated proteins. J Cancer Res Clin Oncol. 2004;130:615-622. [PubMed] [DOI] |
| 16. | Cui JF, Liu YK, Zhang LJ, Shen HL, Song HY, Dai Z, Yu YL, Zhang Y, Sun RX, Chen J. Identification of metastasis candidate proteins among HCC cell lines by comparative proteome and biological function analysis of S100A4 in metastasis in vitro. Proteomics. 2006;6:5953-5961. [PubMed] [DOI] |
| 17. | Shen H, Cheng G, Fan H, Zhang J, Zhang X, Lu H, Liu C, Sun F, Jin H, Xu X. Expressed proteome analysis of human hepatocellular carcinoma in nude mice (LCI-D20) with high metastasis potential. Proteomics. 2006;6:528-537. [PubMed] [DOI] |