修回日期: 2007-02-03
接受日期: 2007-02-15
在线出版日期: 2007-04-28
Toll样受体是近年来发现的跨膜信号传递受体, 他作为一种重要的模式识别受体(PRRs)在先天免疫中通过对病原体相关的分子模式(PAMPs)的识别发挥作用, 通过刺激信号的级联反应诱导炎症因子和细胞因子产生, 在抗感染中起重要作用. 基因多态性影响机体对疾病的遗传易感性, TLRs的位点多态性与炎性应答损伤和感染性疾病的遗传易感性相关. 目前多数研究表明TLR4的Asp299Gly和Thr399Ile, TLR2的Arg753Gln和Arg667Trp多态性与感染性疾病的发生相关, 其他TLRs的基因多态性也有研究. 本文就TLRs家族的功能及其基因多态性与感染性疾病的关系作一综述.
引文著录: 田地, 曾争, 陆海英, 田国保, 崔建军. Toll样受体及其基因多态性与感染性疾病关系的研究进展. 世界华人消化杂志 2007; 15(12): 1393-1399
Revised: February 3, 2007
Accepted: February 15, 2007
Published online: April 28, 2007
Toll-like receptors (TLRs) were identified as transmembrane signal transduction proteins in recent years. As a group of pattern recognition receptors (PRRs), TLRs play important roles in the innate immunity by recognizing pathogen-associated molecular patterns (PAMPs). PAMPs trigger TLR signaling cascades, leading to the release of proinflammatory cytokines, and play critical roles in infectious diseases. Genetic polymorphisms affect the susceptibility of individuals to infectious diseases, and single nucleotide polymorphisms of TLR genes are associated with the inflammatory responses and susceptibility to infectious diseases. Most studies have indicated that the Asp299Gly and Thr399Ile of TLR4 as well as the Arg753Gln and Arg667Trp of TLR2 had close correlations with the pathogenesis of infectious diseases. Other genetic polymorphisms of TLRs have also been reported. In this review, we summarized and discussed the function of TLR family and the relationship between genetic polymorphisms of TLRs and infectious diseases.
- Citation: Tian D, Zeng Z, Lu HY, Tian GB, Cui JJ. Advancement of the relationship between gene polymorphisms of Toll-like receptors and infectious diseases. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1393-1399
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1393.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1393
Toll蛋白最早在果蝇体内发现, 是参与果蝇胚胎时期腹背侧体轴形成的成分蛋白, 他介导天然免疫, 能感受入侵的病原体, 使果蝇分泌多种抗微生物感染的多肽以清除病原体. 1997年, Medzhitov et al[1]首次在人体内发现与果蝇Toll蛋白同源的蛋白, 命名为Toll样受体, 即TLRs(Toll-like receptors, TLRs). 目前已在哺乳动物发现13种不同的TLRs, TLRs1-9在人和小鼠体内都存在, TLR10只存在于人体内, 而TLRs11-13仅在小鼠体内发现. 人的TLR基因分别定位在4号染色体(TLR1, TLR2, TLR3, TLR6和TLR10)、9号染色体(TLR4)、1号染色体(TLR5)、3号染色体(TLR9)和X染色体(TLR7和TLR8). 比较分析人、果蝇、爬行动物、鸟类和其他哺乳动物的TLR基因发现, DNA序列差别不大, 进化相对保守[2].
TLR属于Ⅰ型跨膜蛋白(type Ⅰ transmembrance protein)受体, 由胞外区、跨膜区和胞内区组成. 胞外区均有19-25个富含亮氨酸的重复序列(leucine-rich repeat, LRR)XLXXLXLXX(X代表任何氨基酸, L为亮氨酸), 每个LRR由24-29个氨基酸组成, 为β折叠-环-a螺旋的结构, 整个LRR结构域形成一个马蹄型的结构, 参与各种病原体的识别; 跨膜区是富含半胱氨酸的结构域; 胞内区约有200个氨基酸与白介素-1Ⅰ型受体(Interleukin-1R, IL-1R1)和白介素-18受体(Interleukin-18R, IL-18R)有高度同源性, 称为Toll/IL-1受体同源区(Toll/IL-1 receptor homologous region, TIR), 是TLRs向下游进行信号传递的核心元件. TLRs家族成员的胞内区结构差别不大, 而胞外区之间存在较大差异, 这有助于不同配体激活不同的受体.
TLR家族成员分布在各类与免疫相关的细胞, 如中性粒细胞、巨噬细胞、树突状细胞、皮肤内皮细胞和黏膜上皮细胞等. TLR2和TLR4 也存在于B细胞和T细胞上, 参与固有免疫应答, 在肠上皮细胞的高尔基复合体内发现有TLR4, 而TLR3, TLR7和TLR9也存在于内涵体和内质网中.
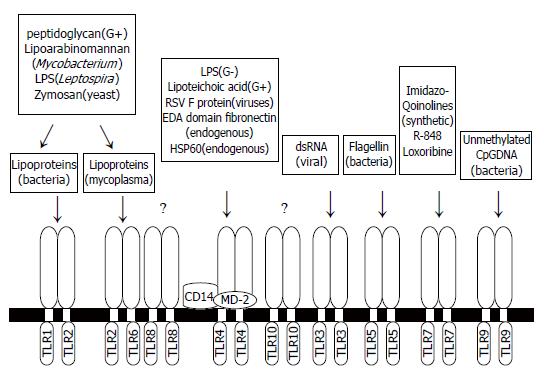
天然免疫系统由能够识别病原相关的分子模式(pathogen-associated molecule pattern, PAMPs)的模式识别受体(pattern recognition receptors, PPRs)介导. TLRs是一种主要的PPRs, 通过识别病原微生物及其细胞壁具有的类脂特殊结构来介导宿主相关细胞因子的分泌和天然免疫应答的产生. 这些PAMPs包括革兰阴性细菌脂多糖(lipopolysaccharide, LPS)中的类脂A、革兰阳性细菌的肽聚糖(peptidoglycan, PGN)、脂磷壁酸(lipoteichoic acids)、脂阿拉伯甘露糖(lipoarabinomannans)、分枝杆菌和疏密螺旋体的脂蛋白(lipoproteins)和脂肽(lipopeptides)、酵母菌和支原体的某些成分以及细菌DNA中非甲基化CpG基序(unmethylated CpG DNA motif)、细菌鞭毛蛋白(flagellin)等. 最近发现还存在TLRs的内源性配体, 如热休克蛋白(heat shock proteins, HSP)[3]、纤维结合素(fibronectin)特有的A结构域(extra domain A, EDA)[4]等. TLRs的配体见图1. 在人已发现10种TLRs, 但TLR8和TLR10的功能还不清楚, TLR1和TLR6需要与TLR2形成二聚体发挥作用, TLR4与CD14和MD-2形成复合体发挥作用. 尚未发现TLR7的天然配体, 已发现的TLR7配体均为合成的免疫调节剂. 一种TLR可以识别多种配体, 这些配体往往属于不同的病原体(如TLR4识别病毒的某些成分, 也可识别革兰阴性细菌的脂多糖), 而同一种病原体可被多种TLRs识别(如革兰阴性细菌可被TLR2和TLR4识别), TLR3, TLR5和TLR9识别的配体较单一.
TLRs信号通路在免疫调节中发挥重要作用. 髓样分化因子88(myeloid differentiation factor 88, MyD88)是TLRs信号通路中重要的衔接蛋白, MyD88有一个N端死亡结构域(death domain)和一个C端TIR结构域, TIR结构域与TLRs的TIR相结合, 而N端的死亡结构域可与白介素1受体相关激酶(IL-1R-associated kinase, IRAK)的死亡结构域相互作用, 募集IRAK到受体复合体. 多数TLRs均可通过MyD88激活IRAK和肿瘤坏死因子受体相关因子6(TNFR-associated factor 6, TRAF6), TRAF6被磷酸纤维素化后, 诱导转化生长因子β活化激酶1(transforming growth factor-β activated kinase 1, TAK1)和丝裂原活化蛋白激酶的激酶(mitogen-activated protein kinase kinase 6, MKK6)激活下游的NF-kB、JNK和丝裂原蛋白激酶P38信号通路, 诱导促炎细胞因子如IL-1, IL-6, IL-12和TNFa等基因的表达[5]. 研究发现[6], 在MyD88缺失的树突状细胞, LPS刺激仍可通过TLR4诱导一系列基因表达, 说明存在不依赖MyD88的信号通路. 随后证实另一种MyD88同源蛋白, 即含TIR结构域的衔接蛋白(TIR domain-containing adapter protein, TIRAP), 又叫MyD88转接样蛋白(MyD88-adapter-like, Mal), 在TLR4介导的MyD88非依赖信号传导途径中发挥作用[7-8]. MyD88非依赖信号传导途径可能主要调控TLR4介导的树突状细胞的成熟和获得性免疫正向调节分子如MHC、共刺激分子CD80和CD86等的表达. 最近发现一种诱导IFNβ的含TIR结构域的衔接蛋白(TIR domain-containing adapter-inducing IFNβ, TRIF, 也叫TICAM-1)[9], 参与TLR3和TLR4介导的MyD88非依赖信号传导途径, TLR3通过TRIF激活干扰素调节因子3(interferon regulatory factor 3, IRF3), 诱导IFNβ等基因表达, TLR4通过TRIF激活NF-kB, 诱导炎症因子的分泌[10]. TLR7, TLR8, TLR9还可通过MyD88-TRAF3通路激活干扰素调节因子7(interferon regulatory factor 7, IRF7)诱导Ⅰ型干扰素的分泌[11].
TLRs识别不同的PAMPs, 是机体抵抗感染的第一道屏障. TLRs识别PAMPs后, 通过一系列信号通路, 引起与免疫有关的细胞因子释放, 趋化单核/巨噬细胞、中性粒细胞、NK细胞等到达炎症部位, 消灭病原体.
LPS是G-菌细胞外膜层的主要成分, TLR4是引起对LPS应答的主要受体, 敲除了TLR4基因的小鼠对LPS的刺激无应答[12]. TLR4是TLRs家族成员中第一个被发现有抗病毒作用的受体. 呼吸道合胞病毒(respiratory syncytial virus, RSV)的F蛋白通过TLR4和CD14分子刺激机体产生抗病毒的细胞因子, TLR4缺陷的小鼠肺部NK细胞、巨噬细胞和单核细胞数量减少, IL-12分泌下降, NK细胞介导的细胞毒效应受到破坏, 清除RSV的能力降低[13]. TLR4缺陷可使鼠肺孢子虫(pneumocystis murina)引起的肺炎加重[14]. TLR4也参与鼠乳头状瘤病毒(mouse mammary tumor virus, MMTV)和柯萨奇病毒(coxsackie virus)感染, 不利于机体对病毒的清除.
麻疹病毒的血凝素(hemagglutinin, HA)蛋白可通过TLR2刺激机体产生免疫应答. TLR2缺陷的小鼠感染单纯疱疹病毒-1(herpes simplex virus-1, HSV-1)后生存率较高, 这与TLR2缺陷导致中枢神经系统炎性细胞因子分泌减少有关. 最近报道[15], 敲除了TLR2基因的小鼠, 脾脏和肝脏中鼠巨细胞病毒(murine cytomegalovirus, MCMV)复制增加, NK细胞数量减少, IL-18和IFN-α/b表达水平下降. 在e抗原阳性的慢性乙型肝炎患者中, 即使病毒的载量很低, 也能抑制外周血单个核细胞TLR2受体的表达[16]. TLR2受体缺陷同样加重肺孢子虫引起的肺炎[17].
dsRNA是很多病毒生活周期中的产物, 可通过TLR3激活NF-kB通路和IRF3, 产生促炎因子和抗病毒的细胞因子. 最近发现人子宫内膜上皮细胞上表达TLR3, TLR3在dsRNA刺激下使子宫内膜产生不同的细胞因子环境抵抗病菌感染[18]. TLR7可结合流感病毒和仙台病毒的ssRNA[19], TLR7和TLR8也可识别咪唑并喹啉和洛索立宾, 这两种合成化合物都有抗病毒作用. 细菌DNA中非甲基化CpG基序通过TLR9引起免疫应答, 病毒中也存在该基序, 如HSV. HSV-1和HSV-2均可通过TLR9刺激浆细胞样树突状细胞(plasmacytoid dendritic cells, pDCs)产生Ⅰ型干扰素, 给TLR9基因缺陷的小鼠注射HSV-2则无INFα产生[20]. 缺乏TLR9或MyD88的小鼠感染MCMV后脾脏中病毒滴度明显升高[21]. Carolina et al研究提示, 病毒可通过TLRs诱导树突状细胞的成熟[22].
Arbour et al[23]发现, 人TLR4基因的Asp299Gly和Thr399Ile多态性与吸入LPS后低应答相关, 在这些人中, 上皮细胞对LPS的刺激免疫应答能力减弱. 进一步研究发现Asp299Gly比Thr399Ile更能影响TLR4的功能. 有人研究了Asp299Gly和Thr399Ile位点多态性在G-细菌引起的中毒性休克中的作用, 发现91例患者中4人存在TLR4基因Asp299Gly的位点突变, 而没有Thr399Ile的位点突变[24]. 婴幼儿严重呼吸道合胞病毒支气管炎与这两种位点突变均显著相关[25]. 在哮喘患者中, TLR4基因的Asp299Gly和Thr399Ile多态性与疾病的发病率无相关性, 但Asp299Gly与病情的严重程度有明显的相关性(P = 0.003)[26], 而在类风湿关节炎患者中, Asp299Gly可降低发病率, 但与病情和预后无关[27]. 有时TLR4基因多态性并不影响炎症性疾病的表现程度, 一些研究中并未发现TLR4 299/399位点多态性与手术后感染和严重的急性全身反应综合征有相关性, 也未发现Asp299Gly个体与对照患者在脑膜炎奈瑟球菌感染发病中有显著性差异[28].
Mockenhaupt et al[29]研究了非洲儿童这两个位点多态性与重症疟疾的相关性, Asp299Gly在健康对照组为17.6%, 而在疾病组出现的频率较高(24.1%, P<0.05). 同样Thr399Ile在健康儿童中为2.4%, 在病例组为6.2%(P = 0.02). Asp299Gly和Thr399Ile可使发病风险分别增加1.5倍和2.6倍, 表明TLR4基因多态性与疟疾的严重程度相关. 最近发现与健康对照组相比Crohn's病患者中Asp299Gly出现频率显著升高(OR 2.31, P = 0.004), 在溃疡性结肠炎患者中也较高(OR 2.45, P = 0.027)[30]. Montes首次发现了Asp299Gly位点多态性与骨髓炎的关系, Asp299Gly在病例组中的频率显著高于健康对照组(3.8% vs 0%, P = 0.038), 提示携带一或两个G等位基因的人对血源性骨髓炎或慢性骨髓炎更易感[31]. 在牙龈炎患者中TLR4(Asp299Gly)杂合子的牙龈上皮细胞对卟啉单胞菌的反应降低[32]. TLR4参与肾同种异体移植后的排斥反应, 接受供体TLR4(Asp299Gly)和(Thr399Ile)等位基因杂合状态的受体, 移植后急性排斥反应明显减轻[33].
TLR4还存在其他位点的变异, 如在220例脑膜炎奈瑟球菌脑炎患者中14例检测到非同义SNPs, 而对照组283例仅检测到2例, 两组中Asp299Gly和Thr399Ile无显著性差异. 在前列腺癌患者, TLR4SNPs(11, 381位点)的检出频率较高, 这些稀有位点的变异与感染性疾病或肿瘤易感性相关.
Lorzenz et al[34]报道了人TLR2羧基端的保守序列存在Arg753Gln位点多态性[35], 表达该基因的HEK293细胞体外识别配体的能力减弱. Arg753Gln在结核患者中的频率较高, 但与金黄色葡萄球菌感染的关系不大. 携带Arg753Gln的过敏性皮炎患者症状一般较重. 最近有报道, Arg753Gln位点多态性与儿童急性风湿热相关. TLR2羧基端还存在Arg667Trp位点多态性, 在45例瘤型麻风患者中有10例检测到, 而在结核型麻风患者中未检出, 健康对照中也未发现[36]. 进一步研究发现, 表达该基因的HECK293细胞活性减低, Arg667Trp位点突变的人群产生IL-12的能力下降. 后来在突尼斯人中发现, Arg667Trp 多态性与结核的易感性相关[37]. 由非分支杆菌引起的肺部疾病(notuberculous mycobacterial lung diseases, NTM)在并无吸烟史的中老年女性中发病率极高, 但研究发现Arg667Trp与NTM的易感性无关[38]. 类风湿关节炎和SLE患者Arg753Gln和Arg667Trp与健康对照也无明显差别[39]. Smirnova et al[40]在脑膜炎患者中发现了TLR2基因的Pro631His多态性, TLR2启动子区基因多态性与儿童哮喘相关[26], 在一个大样本研究中发现, TLR2/-16934在哮喘儿童中存在多态性[41].
TLR5识别细菌的鞭毛蛋白, Hawn et al[42]推测, 鞭毛蛋白可能参与系统性红斑狼疮(SLE)的自身免疫反应, 研究证实TLR5(C1174T)多态性与SLE病情进展有关, 其突变在SLE中对机体是有利因素. TLR6基因编码796个氨基酸组成的多肽, Hoffjan et al[43]分别研究了TLR6基因的Ser249Pro多态性在成年人哮喘、儿童期哮喘、过敏性皮炎(AD)和慢性阻塞性肺病(COPD)中的情况, 发现Ser249Pro位点多态性与儿童期哮喘有微弱的相关性, 而与成年人哮喘、AD和COPD无关. TLR10与TLR6高度同源, 虽然TLR10的功能还不清楚, 但其功能可能与TLR6相似, 有报道TLR10基因多态性与哮喘有一定关系[44]. 最近发现, TLR6-TLR1-TLR10基因簇多态性是前列腺癌发病的危险因素[45]. 在鼠试验性结肠炎模型中, TLR9识别的信号通路与抗生素的抗炎效应相关[46], TLR9基因启动子的多态性与Crohn's病有关[47], 该区的SNPs(-1237)与哮喘的发病相关(P = 0.042).
参与调节TLRs信号通路的分子基因多态性与疾病的遗传易感性也有关系. TLR4和TLR2活化IRAK和TRAF6, 诱导炎症因子的产生, 而白介素1受体相关激酶-M(IL-1R-associated kinase -M, IRAK-M)可抑制TLRs信号通路, 调节TLRs信号传导和天然免疫的动态平衡[48]. IRAK-M基因位于12q14.2, 该基因区域被认为与哮喘有关. 白介素1受体相关的单个免疫球蛋白的分子(single immunoglobulin IL-1R-related molecule, SIGIRR)也是TLR信号通路的负性调节分子, 在上皮细胞高表达, 对调节长期暴露在微生物环境细胞的免疫应答有重要作用, 如肺上皮细胞[49]. Nakashima et al[50]认为, IRAK-M和SIGIRR基因多态性可能与哮喘有关, 但结果显示, 日本人IRAK-M基因的Val147Ile和SIGIRR基因的Pro147Arg多态性与哮喘发病并无相关性, 其多态性在感染性疾病中的作用需要更多的研究.
总之, Toll样受体作为一种重要的PRRs可识别多种PAMPs, 通过刺激信号的级联反应诱导炎症因子和细胞因子的产生, 在抗感染中起重要作用. TLRs参与多种感染性疾病, TLRs基因多态性影响疾病的发病和病情的进展. 但目前常见的感染性疾病与TLRs的关系还不是很清楚. TLR4Asp299Gly和Thr399Ile, TLR2 Arg753Gln和Arg667Trp的研究最为广泛, 已经发现疟疾、败血症休克、骨髓炎、哮喘等多种疾病与TLRs基因多态性相关. TLRs在感染性疾病中的作用提示以TLRs信号受体作为靶向对预防和防治某些疾病将由广阔的前景.
此课题全部或部分由美国国家卫生研究院国家癌症研究所资助, 资助编号为N01-CO-12400. 本文内容既不涉及公共健康与社会福利部的方针政策, 也不涉及美国政府资助提到的商家、商业产品或组织机构.
Toll样受体作为一种模式识别受体(PRRs)在先天免疫中通过对病原体相关的分子模式(PAMPs)的识别诱导炎症因子和细胞因子产生, 在抗感染中起重要作用. 基因多态性影响机体对疾病的遗传易感性, Toll样受体的位点多态性与炎性应答损伤和感染性疾病的遗传易感性相关.
关于Toll样受体及其位点多态性与感染性疾病的关系一直是近年来研究的热点, 其中研究的主要位点为TLR4的Asp299Gly和Thr399Ile, TLR2的 Arg753Gln和Arg667Trp.
本文全面介绍了目前已经发现的Toll样受体家族在先天性免疫和抗感染中的作用, 总结了TLR4的Asp299Gly和Thr399Ile, TLR2的 Arg753Gln和Arg667Trp等报道较多的位点多态性与感染性疾病的相关性, 可以使读者对此有总体了解.
本文总结了近年报道的Toll样受体位点多态性与感染性疾病的相关性, 由于研究的人群不同, 其中一些位点与疾病是否相关仍有争议, 供同行们在研究中参考.
本文就TLRs家族的功能及其基因多态性与感染性疾病的关系进行了综述, 文章内容新颖, 层次分明, 语言流畅, 论述详实, 文献引用得当, 是一篇较好的综述性文章.
电编: 张敏 编辑:张焕兰
| 1. | Medzhitov R, Preston-Hurlburt P, Janeway CA Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 1997;388:394-397. [PubMed] [DOI] |
| 2. | Kimbrell DA, Beutler B. The evolution and genetics of innate immunity. Nat Rev Genet. 2001;2:256-267. [PubMed] [DOI] |
| 3. | Ohashi K, Burkart V, Flohe S, Kolb H. Cutting edge: heat shock protein 60 is a putative endogenous ligand of the toll-like receptor-4 complex. J Immunol. 2000;164:558-561. [PubMed] [DOI] |
| 4. | Okamura Y, Watari M, Jerud ES, Young DW, Ishizaka ST, Rose J, Chow JC, Strauss JF 3rd. The extra domain A of fibronectin activates Toll-like receptor 4. J Biol Chem. 2001;276:10229-10233. [PubMed] [DOI] |
| 5. | O'Neill LA. Signal transduction pathways activated by the IL-1 receptor/toll-like receptor superfamily. Curr Top Microbiol Immunol. 2002;270:47-61. [PubMed] [DOI] |
| 6. | Kaisho T, Takeuchi O, Kawai T, Hoshino K, Akira S. Endotoxin-induced maturation of MyD88-deficient dendritic cells. J Immunol. 2001;166:5688-5694. [PubMed] [DOI] |
| 7. | Horng T, Barton GM, Medzhitov R. TIRAP: an adapter molecule in the Toll signaling pathway. Nat Immunol. 2001;2:835-841. [PubMed] [DOI] |
| 8. | Fitzgerald KA, Palsson-McDermott EM, Bowie AG, Jefferies CA, Mansell AS, Brady G, Brint E, Dunne A, Gray P, Harte MT. Mal (MyD88-adapter-like) is required for Toll-like receptor-4 signal transduction. Nature. 2001;413:78-83. [PubMed] [DOI] |
| 9. | Oshiumi H, Matsumoto M, Funami K, Akazawa T, Seya T. TICAM-1, an adaptor molecule that participates in Toll-like receptor 3-mediated interferon-beta induction. Nat Immunol. 2003;4:161-167. [PubMed] [DOI] |
| 10. | Akira S. TLR signaling. Curr Top Microbiol Immunol. 2006;311:1-16. [PubMed] [DOI] |
| 11. | Hacker H, Redecke V, Blagoev B, Kratchmarova I, Hsu LC, Wang GG, Kamps MP, Raz E, Wagner H, Hacker G. Specificity in Toll-like receptor signalling through distinct effector functions of TRAF3 and TRAF6. Nature. 2006;439:204-207. [PubMed] [DOI] |
| 12. | Hoshino K, Takeuchi O, Kawai T, Sanjo H, Ogawa T, Takeda Y, Takeda K, Akira S. Cutting edge: Toll-like receptor 4 (TLR4)-deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product. J Immunol. 1999;162:3749-3752. [PubMed] |
| 13. | Kurt-Jones EA, Popova L, Kwinn L, Haynes LM, Jones LP, Tripp RA, Walsh EE, Freeman MW, Golenbock DT, Anderson LJ. Pattern recognition receptors TLR4 and CD14 mediate response to respiratory syncytial virus. Nat Immunol. 2000;1:398-401. [PubMed] [DOI] |
| 14. | Ding K, Shibui A, Wang Y, Takamoto M, Matsuguchi T, Sugane K. Impaired recognition by Toll-like receptor 4 is responsible for exacerbated murine Pneumocystis pneumonia. Microbes Infect. 2005;7:195-203. [PubMed] [DOI] |
| 15. | Szomolanyi-Tsuda E, Liang X, Welsh RM, Kurt-Jones EA, Finberg RW. Role for TLR2 in NK cell-mediated control of murine cytomegalovirus in vivo. J Virol. 2006;80:4286-4291. [PubMed] [DOI] |
| 16. | Riordan SM, Skinner N, Kurtovic J, Locarnini S, Visvanathan K. Reduced expression of Toll-like receptor 2 on peripheral monocytes in patients with chronic hepatitis B. Clin Vacc Immunol. 2006;13:972-9741. [PubMed] [DOI] |
| 17. | Zhang C, Wang SH, Lasbury ME, Tschang D, Liao CP, Durant PJ, Lee CH. Toll-like receptor 2 mediates alveolar macrophage response to Pneumocystis murina. Infect Immun. 2006;74:1857-1864. [PubMed] [DOI] |
| 18. | Jorgenson RL, Young SL, Lesmeister MJ, Lyddon TD, Misfeldt ML. Human endometrial epithelial cells cyclically express Toll-like receptor 3 (TLR3) and exhibit TLR3-dependent responses to dsRNA. Hum Immunol. 2005;66:469-482. [PubMed] [DOI] |
| 19. | Diebold SS, Kaisho T, Hemmi H, Akira S, Reis e Sousa C. Innate antiviral responses by means of TLR7-mediated recognition of single-stranded RNA. Science. 2004;303:1529-1531. [PubMed] [DOI] |
| 20. | Lund J, Sato A, Akira S, Medzhitov R, Iwasaki A. Toll-like receptor 9-mediated recognition of Herpes simplex virus-2 by plasmacytoid dendritic cells. J Exp Med. 2003;198:513-520. [PubMed] [DOI] |
| 21. | Krug A, French AR, Barchet W, Fischer JA, Dzionek A, Pingel JT, Orihuela MM, Akira S, Yokoyama WM, Colonna M. TLR9-dependent recognition of MCMV by IPC and DC generates coordinated cytokine responses that activate antiviral NK cell function. Immunity. 2004;21:107-119. [PubMed] [DOI] |
| 22. | Lopez CB, Yount JS, Moran TM. Toll-like receptor-independent triggering of dendritic cell maturation by viruses. J Virol. 2006;80:3128-3134. [PubMed] [DOI] |
| 23. | Arbour NC, Lorenz E, Schutte BC, Zabner J, Kline JN, Jones M, Frees K, Watt JL, Schwartz DA. TLR4 mutations are associated with endotoxin hyporesponsiveness in humans. Nat Genet. 2000;25:187-191. [PubMed] [DOI] |
| 24. | Lorenz E, Hallman M, Marttila R, Haataja R, Schwartz DA. Association between the Asp299Gly polymorphisms in the Toll-like receptor 4 and premature births in the Finnish population. Pediatr Res. 2002;52:373-376. [PubMed] [DOI] |
| 25. | Tal G, Mandelberg A, Dalal I, Cesar K, Somekh E, Tal A, Oron A, Itskovich S, Ballin A, Houri S. Association between common Toll-like receptor 4 mutations and severe respiratory syncytial virus disease. J Infect Dis. 2004;189:2057-2063. [PubMed] [DOI] |
| 26. | Yang IA, Barton SJ, Rorke S, Cakebread JA, Keith TP, Clough JB, Holgate ST, Holloway JW. Toll-like receptor 4 polymorphism and severity of atopy in asthmatics. Genes Immun. 2004;5:41-45. [PubMed] [DOI] |
| 27. | Radstake TR, Franke B, Hanssen S. The Toll-like receptor 4 Asp299Gly functional variant is associated with decreased rheumatoid arthritis disease susceptibility but dose not influence disease severity and/or outcome. Arthritis Rheu. 2004;50:999-1007. [PubMed] [DOI] |
| 28. | Read RC, Pullin J, Gregory S, Borrow R, Kaczmarski EB, di Giovine FS, Dower SK, Cannings C, Wilson AG. A functional polymor-phism of Toll-like receptor 4 is not associated with likelihood or severity of meningococcal disease. J Infect Dis. 2001;184:640-642. [PubMed] [DOI] |
| 29. | Mockenhaupt FP, Cramer JP, Hamann L, Stegemann MS, Eckert J, Oh NR, Otchwemah RN, Dietz E, Ehrhardt S, Schroder NW. Toll-like receptor (TLR) polymorphisms in African children: Common TLR-4 variants predispose to severe malaria. Proc Natl Acad Sci USA. 2006;103:177-182. [PubMed] [DOI] |
| 30. | Franchimont D, Vermeire S, El Housni H, Pierik M, Van Steen K, Gustot T, Quertinmont E, Abramowicz M, Van Gossum A, Deviere J. Deficient host-bacteria interactions in inflammatory bowel disease? The toll-like receptor (TLR)-4 Asp299gly polymorphism is associated with Crohn's disease and ulcerative colitis. Gut. 2004;53:987-992. [PubMed] [DOI] |
| 31. | Montes AH, Asensi V, Alvarez V, Valle E, Ocana MG, Meana A, Carton JA, Paz J, Fierer J, Celada A. The Toll-like receptor 4 (Asp299Gly) polymorphism is a risk factor for Gram-negative and haematogenous osteomyelitis. Clin Exp Immunol. 2006;143:404-413. [PubMed] [DOI] |
| 32. | Kinane DF, Shiba H, Stathopoulou PG, Zhao H, Lappin DF, Singh A, Eskan MA, Beckers S, Waigel S, Alpert B. Gingival epithelial cells heterozygous for Toll-like receptor 4 polymorphisms Asp299Gly and Thr399ile are hypo-responsive to Porphyromonas gingivalis. Genes Immun. 2006;7:190-200. [PubMed] [DOI] |
| 33. | Palmer SM, Burch LH, Mir S, Smith SR, Kuo PC, Herczyk WF, Reinsmoen NL, Schwartz DA. Donor polymorphisms in Toll-like receptor-4 influence the development of rejection after renal transplantation. Clin Transplant. 2006;20:30-36. [PubMed] [DOI] |
| 34. | Lorenz E, Mira JP, Cornish KL, Arbour NC, Schwartz DA. A novel polymorphism in the Toll-like receptor 2 gene and its potential association with staphylococcal infection. Infect Immun. 2000;68:6398-6401. |
| 35. | Berdeli A, Celik HA, Ozyurek R, Dogrusoz B, Aydin HH. TLR-2 gene Arg753Gln polymorphism is strongly associated with acute rheumatic fever in children. J Mol Med. 2005;83:535-541. [PubMed] [DOI] |
| 36. | Kang TJ, Chae GT. Detection of Toll-like receptor 2 (TLR2) mutation in the lepromatous leprosy patients. FEMS Immunol Med Microbiol. 2001;31:53-58. [PubMed] [DOI] |
| 37. | Ben-Ali M, Barbouche MR, Bousnina S, Chabbou A, Dellagi K. Toll-like receptor 2 Arg677Trp polymorphism is associated with susceptibility to tuberculosis in Tunisian patients. Clin Diagn Lab Immunol. 2004;11:625-626. |
| 38. | Ryu YJ, Kim EJ, Koh WJ, Kim H, Kwon OJ, Chang JH. Toll-like receptor 2 polymorphisms and nontuberculous mycobacterial lung diseases. Clin Vaccine Immunol. 2006;13:818-819. [PubMed] [DOI] |
| 39. | Sanchez E, Orozco G, Lopez-Nevot MA, Jimenez-Alonso J, Martin J. Polymorphisms of toll-like receptor 2 and 4 genes in rheumatoid arthritis and systemic lupus erythematosus. Tissue Antigens. 2004;63:54-57. [PubMed] [DOI] |
| 40. | Smirnova I, Mann N, Dols A, Derkx HH, Hibberd ML, Levin M, Beutler B. Assay of locus-specific genetic load implicates rare Toll-like receptor 4 mutations in meningococcal susceptibility. Proc Natl Acad Sci USA. 2003;100:6075-6080. [PubMed] [DOI] |
| 41. | Eder W, Klimecki W, Yu L, von Mutius E, Riedler J, Braun-Fahrlander C, Nowak D, Martinez FD. Toll-like receptor 2 as a major gene for asthma in children of European farmers. J Allergy Clin Immunol. 2004;113:482-488. [PubMed] [DOI] |
| 42. | Hawn TR, Wu H, Grossman JM, Hahn BH, Tsao BP, Aderem A. A stop codon polymorphism of Toll-like receptor 5 is associated with resistance to systemic lupus erythematosus. Proc Natl Acad Sci USA. 2005;102:10593-10597. [PubMed] [DOI] |
| 43. | Hoffjan S, Stemmler S, Parwez Q, Petrasch-Parwez E, Arinir U, Rohde G, Reinitz-Rademacher K, Schultze-Werninghaus G, Bufe A, Epplen JT. Evaluation of the toll-like receptor 6 Ser249Pro polymorphism in patients with asthma, atopic dermatitis and chronic obstructive pulmonary disease. BMC Med Genet. 2005;6:34. [PubMed] [DOI] |
| 44. | Lazarus R, Raby BA, Lange C, Silverman EK, Kwiatkowski DJ, Vercelli D, Klimecki WJ, Martinez FD, Weiss ST. TOLL-like receptor 10 genetic variation is associated with asthma in two independent samples. Am J Respir Crit Care Med. 2004;170:594-600. [PubMed] [DOI] |
| 45. | Sun J, Wiklund F, Zheng SL, Chang B, Balter K, Li L, Johansson JE, Li G, Adami HO, Liu W. Sequence variants in Toll-like receptor gene cluster (TLR6-TLR1-TLR10) and prostate cancer risk. J Natl Cancer Inst. 2005;97:525-532. [PubMed] [DOI] |
| 46. | Rachmilewitz D, Katakura K, Karmeli F, Hayashi T, Reinus C, Rudensky B, Akira S, Takeda K, Lee J, Takabayashi K. Toll-like receptor 9 signaling mediates the anti-inflammatory effects of probiotics in murine experimental colitis. Gastroenterology. 2004;126:520-528. [PubMed] [DOI] |
| 47. | Torok HP, Glas J, Tonenchi L, Bruennler G, Folwaczny M, Folwaczny C. Crohn's disease is associated with a toll-like receptor-9 polymorphism. Gastroenterology. 2004;127:365-366. [PubMed] [DOI] |
| 48. | Kobayashi K, Hernandez LD, Galan JE, Janeway CA Jr, Medzhitov R, Flavell RA. IRAK-M is a negative regulator of Toll-like receptor signaling. Cell. 2002;110:191-202. [PubMed] [DOI] |
| 49. | Wald D, Qin J, Zhao Z, Qian Y, Naramura M, Tian L, Towne J, Sims JE, Stark GR, Li X. SIGIRR, a negative regulator of Toll-like receptor-interleukin 1 receptor signaling. Nat Immunol. 2003;4:920-927. [PubMed] [DOI] |
| 50. | Nakashima K, Hirota T, Obara K, Shimizu M, Jodo A, Kameda M, Doi S, Fujita K, Shirakawa T, Enomoto T. An association study of asthma and related phenotypes with polymorphisms in negative regulator molecules of the TLR signaling pathway. J Hum Genet. 2006;51:284-291. [PubMed] [DOI] |