修回日期: 2007-03-23
接受日期: 2007-04-13
在线出版日期: 2007-04-28
目的: 探索Survivin、P16、RB表达与原发性胆囊癌发生和发展的关系.
方法: 选用46例原发性胆囊癌, 22例癌旁黏膜, 19例胆囊良性病变组织, 采用免疫组化SP法定位观察Survivin、P16、RB基因蛋白表达.
结果: Survivin、P16、RB在原发性胆囊癌中表达阳性率分别为69.6%(32/46), 47.8%(22/46), 71.7%(33/46), 与胆囊良性病变(0%, 73.7%, 94.7%)和癌旁黏膜(0%, 95.4%, 95.4%)相比有显著性差异(P<0.05或P<0.01). Survivin与P16表达呈显著的负相关(r = -0.691, P<0.01). P16与RB表达也呈显著的负相关(r = -0.6556, P<0.01). P16/RB失活组Survivin阳性率为93.8%, 显著高于P16+/RB+组(χ2 = 9.228, P<0.01). Survivin与胆囊癌的分化程度(P = 0.003)、浸润(P = 0.003)和转移(P = 10-6)密切相关, P16表达缺失患者更易发生淋巴结转移和周围脏器的浸润(P = 0.04或P = 0.001).
结论: Survivin高表达, P16、RB表达缺失在原发性胆囊癌发生中起重要的调节作用. P16/RB通路失活, 结合Survivin高表达可能是胆囊细胞癌变的重要通路之一. Survivin高表达和P16表达缺失与胆囊癌的转移和浸润可能有密切关系.
引文著录: 许元鸿, 欧阳兵, 于国志, 郭克建. Survivin、P16及RB表达与原发性胆囊癌发生和发展的关系. 世界华人消化杂志 2007; 15(12): 1389-1392
Revised: March 23, 2007
Accepted: April 13, 2007
Published online: April 28, 2007
AIM: To investigate the roles of Survivin, P16 and Retinoblastoma (RB) protein expression in the occurrence and progression of primary gallbladder carcinoma (PGC).
METHODS: Immunohistochemistry was used to detect the expression of Survivin, P16 and RB in 46 cases of PGC tissues, 22 cases of cancer-adjacent tissues and 19 cases of benign lesions.
RESULTS: The positive rates of Survivin, P16 and RB expression in PGC tissues were 69.6% (32/46), 47.8% (22/46) and 71.7% (33/46), respectively, significantly different from those in the benign (0%, 73.7%, 94.7%) and cancer-adjacent (0%, 95.4%, 95.4%) tissues (P < 0.05 or P < 0.01). P16 expression was negatively correlated with Survivin and RB expression (r = -0.691, P < 0.01; r = -0.6556, P < 0.01). The positive rate of Survivin expression in P16/RB-deleted cases was 93.8%, significantly higher than that in P16/RB-positive ones (χ2 = 9.228, P < 0.01). Survivin expression was also correlated closely with the differentiation degree (P = 0.003), invasion depth (P = 0.003) and lymph node metastasis (P = 10-6), while loss expression of P16 was correlated closely with the tumor invasion depth (P = 0.04) and lymph node metastasis (P = 0.001).
CONCLUSION: P16/RB deletion in combination with high Survivin expression might be one of the critical pathways in PGC carcinogenesis, and high expression of Survivin and loss expression of P16 are correlated closely with tumor invasion and metastasis.
- Citation: Xu YH, Ou-Yang B, Yu GZ, Guo KJ. Correlations of Survivin, P16 and Retinoblastoma expression with the occurrence and progression of primary gallbladder carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1389-1392
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1389.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1389
Survivin是凋亡抑制蛋白家族中的一个重要成员, 在正常组织中不表达, 而在多种恶性肿瘤中呈阳性表达[1], 且与肿瘤病理分级与预后有明显的关系. P16、RB (Retinoblastoma)基因是调控肿瘤细胞永生化和癌变的重要基因, 与肿瘤细胞增殖失控、转移和浸润关系密切[2-3]. 我们应用免疫组化技术对原发性胆囊癌的Survivin、P16、RB进行检测, 探讨三者在原发性胆囊癌的发生、转移和浸润中的作用及相互关系.
收集中国医科大学附属第一医院2001/2005手术切除并经病理证实的原发性胆囊癌标本46例. 其中男19例、女27例, 发病年龄45-77(平均55)岁. 病理学分级按照WHO分级标准: 高分化20例, 中分化10例、低分化(包括未分化癌)16例. 浸润深度按照UICC和AJCC公布TNM分期标准: T1、T2期18例, T3、T4期28例. 淋巴结转移阴性组24例、阳性组22例. 22例胆囊癌旁黏膜, 19例胆囊良性病变(14例胆囊腺瘤、5例胆囊腺肌样增生症), 标本经40 g/L甲醛固定, 石蜡包埋, 4 μm连续切片, 其中一片常规HE染色, 以复查病理诊断. 兔抗人Survivin单克隆抗体(为即用型抗体)购自福州迈新生物技术有限公司, P16、RB多克隆抗体、生物素标记的二抗购自北京中山生物技术有限公司, SP试剂盒为ZYMED公司产品.
采用免疫组化SP法染色 具体步骤按说明书进行. 每批染色过程均设已知阳性明确的乳癌组织作对照及PBS代替一抗的阴性对照. Survivin阳性物质定位于胞质或胞膜, P16定位于细胞核, RB定位于细胞核; 棕色至深棕色颗粒且其染色强度高于背景非特异染色为阳性细胞. 实验组与对照组在10×20倍显微镜下由两位富有经验的病理科医生在相同条件下观察左上、右上、左下、右下、中央5个视野计数, 共数500个肿瘤细胞中的阳性细胞数, 以百分率计算. Survivin: 无阳性反应细胞, 阳性反应细胞表达率<10%为(-); 阳性细胞表达率大于或等于10%者为(+). P16、RB: 阳性细胞占肿瘤细胞≥25%为阳性, <25%为阴性.
统计学处理 采用χ2检验、Fisher's确切概率法和Spearman等级相关检验.
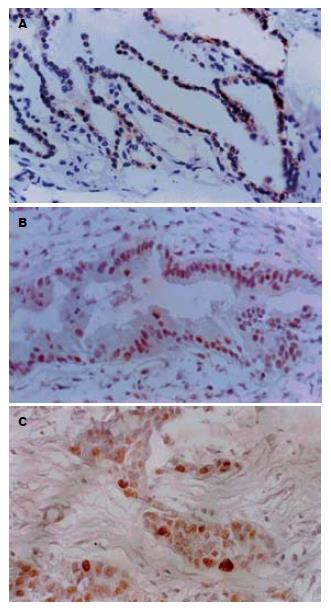
Survivin在原发性胆囊癌中表达阳性率为69.6%(图1A), 显著高于胆囊良性病变和癌旁黏膜(P<0.01). P16、RB表达的阳性率显著低于胆囊良性病变和癌旁黏膜(P<0.01, P<0.05, 表1, 图1B-C).
| 分组 | n | Survivin | P16 | RB | |||
| 阳性 | 阳性率(%) | 阳性 | 阳性率(%) | 阳性 | 阳性率(%) | ||
| 原发性胆囊癌 | 46 | 32 | 69.6 | 22 | 47.8 | 33 | 71.7 |
| 胆囊良性病变 | 19 | 0 | 0 | 14 | 73.7 | 18 | 94.7 |
| 癌旁黏膜 | 22 | 0 | 0 | 21 | 95.4 | 20 | 95.4 |
| χ2 (P) | 45.116 | (0.000) | 15.661 | (0.000) | 6.435 | (0.04) | |
| 分组 | n | Survivin | P16 | RB | ||||||
| 阳性 | 阳性率(%) | χ2 (P) | 阳性 | 阳性率(%) | χ2 (P) | 阳性 | 阳性率(%) | χ2 (P) | ||
| 分化程度 | ||||||||||
| 高中分化 | 30 | 16 | 53.3 | - (0.003) | 15 | 50.0 | 0.163 (0.686) | 21 | 70.0 | 0.000 (0.998) |
| 低未分化 | 16 | 16 | 100 | 7 | 43.8 | 12 | 75.0 | |||
| 浸润深度1 | ||||||||||
| T1、T2 | 18 | 8 | 44.4 | 8.814 (0.003) | 12 | 66.6 | 4.207 (0.04) | 11 | 61.1 | 1.648 (0.199) |
| T3、T4 | 28 | 24 | 85.7 | 10 | 35.8 | 22 | 78.6 | |||
| 淋巴转移 | ||||||||||
| 阴性 | 24 | 10 | 41.7 | - (10-6) | 17 | 70.8 | 10.645(0.001) | 19 | 79.2 | 1.336 (0.243) |
| 阳性 | 22 | 22 | 100 | 5 | 22.7 | 14 | 63.6 | |||
Survivin表达与原发性胆囊癌的分化程度、浸润深度和淋巴结转移显著相关(P<0.01), P16表达与浸润深度和淋巴结转移显著相关(P<0.05或P<0.01), RB表达与分化程度、浸润深度和淋巴结转移无显著相关(P>0.05).
Survivin+/P16+者8例, Survivin+/P16-者24例, Survivin-/P16+者14例, Survivin-/P16-者0例, Survivin, P16的表达呈显著负相关(rs = -0.691, P<0.01). Survivin+/RB+者25例, Survivin+/RB-者7例, Survivin-/RB+者8例, Survivin-/RB-者6例, Survivin和RB的表达无相关(rs = -0.214, P = 0.152). P16+/RB+者9例, P16+/RB-者13例, P16-/RB+者24例, P16-/RB-者0例. P16和RB表达呈显著负相关(rs = -0.6556, P<0.01). P16/RB失活组(P16、RB表达其中之一为阴性或均为阴性)共计37例, 30例Survivin阳性, 占93.8%; P16+/RB+组共计9例, 2例Survivin阳性, 占22.2%, 二者差异有显著性(χ2 = 9.228, P<0.01).
在Survivin是迄今发现的最强的细胞凋亡抑制因子, 可抑制多种凋亡刺激因子(如Caspase)引起的细胞凋亡. Caspase可被级联式激活并使蛋白质溶解, 是细胞凋亡的核心机制. Survivin以周期调节的方式表达于细胞周期的G2/M期, 在G2/M期, Survivin能对抗异常因素诱导的细胞凋亡. 而在肿瘤细胞中Survivin的过度表达, 则可能使细胞克服这个凋亡的调控点而利于完成异常的有丝分裂[1]. 研究表明, Survivin选择性表达于常见的恶性肿瘤如神经母细胞瘤、淋巴瘤、结肠癌和肝癌等肿瘤组织中, 并与肿瘤的发生和发展、组织分化程度密切相关, 是许多肿瘤的预后影响因子之一, 而在癌旁正常组织和成人分化组织并不表达[4-6]. 我们发现, Survivin在原发性胆囊癌中有阳性表达, 阳性表达率为69.6%, 而在胆囊良性病变和癌旁黏膜中无表达, 与Survivin在其他恶性肿瘤中的表达情况一致, Survivin表达上调与胆囊癌分化程度、转移和浸润密切相关, 提示Survivin表达的增高与胆囊癌的发生、发展有关, 随着胆囊癌恶性程度的增加, Survivin抑制肿瘤细胞凋亡, 呈现明显的生长优势. 因此, Survivin抗原的检测, 对临床评估病情、判断预后、选择合适的治疗方法有一定的指导意义.
P16蛋白是一种负性细胞周期的调控蛋白, 抑制细胞增殖, 使细胞停滞于G1期, 其于cyclin D1竞争结合CDK4.6, 使CDK4.6失活, 从而阻止RB蛋白的磷酸化, 去磷酸化的RB以活性形式结合E2F及ATF2等转录因子, 遏制细胞周期的进程. 从而阻止细胞从G1期进入S期, 抑制细胞增殖; 相反P16的失活将导致细胞的过度增殖, 使细胞呈失控性生长而形成肿瘤[2-3]. 有研究表明他不但与多种恶性肿瘤的发生密切相关, 而且可能与肿瘤的某些生物学行为及预后有关. 本研究显示, P16、RB基因表达蛋白阳性率显著低于胆囊良性病变和癌旁黏膜, 提示P16、RB表达蛋白的缺失, 在胆囊癌的发生中起重要作用, 是良好的肿瘤标记物; 且P16蛋白的失活与胆囊癌的转移和浸润密切相关, 提示P16可作为判断胆囊癌恶性程度的辅助指标; 相关分析证实P16与RB表达间存在显著负相关性. 这一结果证实P16、RB基因表达蛋白调控胆囊细胞癌变的机制是一个负反馈环路, 在此反馈环内, P16、RB表达蛋白任何之一表达缺失, 都将导致调节环路的中断, 造成细胞的异常增殖, 最终导致胆囊癌发生.
在细胞周期转换过程中, 细胞周期蛋白依赖性激酶4(CDK4)起着重要作用. 研究证实Survivin过度表达会导致细胞加快向S期转换, 抑制G1期静止, 从而促进细胞增殖. 其机制可能是细胞生长信号诱导Survivin表达, Survivin竞争性地与CDK4/P16ink4a复合物结合, 把P16ink4a从复合体中游离出来, 形成Survivin/CDK4复合物, 从而直接或间接地激活CDK2/CyclinE复合物, 导致RB蛋白磷酸化, 以启动细胞有丝分裂[7]. Survivin、P16和RB作为细胞周期的调控因子, 在肿瘤发生发展的过程中其相互作用的机制研究, 目前尚不十分清楚. 本研究显示, Survivin和P16蛋白表达呈显著的负相关, 提示Survivin和抑癌基因P16表达可能是负反馈调节. 在本组研究中还发现, P16/RB失活组37例, 30例Survivin表达阳性(93.8%); 而P16+/RB+组9例, 仅有2例Survivin表达阳性(22.2%). 说明P16/RB通路失活和Survivin表达上调是原发性胆囊癌发生中的重要分子事件, P16/RB通路失活和Survivin表达上调密切相关, 可能是胆囊细胞癌变的重要通路之一, 其机制尚待进一步研究.
Survivin、P16和RB作为细胞周期的调控因子, 在肿瘤发生、发展的过程中其相互作用的机制研究, 目前尚不十分清楚. 本研究通过免疫组化的方法, 探讨Survivin、P16、RB在原发性胆囊癌中的表达, 来探讨三者在原发性胆囊癌的发生、转移和浸润中的作用及相互关系.
本文应用免疫组织化学方法检测原发性胆囊、癌旁黏膜及胆囊良性病变组织中Survivin、P16、RB基因表达. 结果发现Survivin、P16、RB在原发性胆囊癌中表达与胆囊良性病变和癌旁黏膜相比有差异, Survivin与胆囊癌的分化程度、浸润和转移密切相关, P16表达缺失患者更容易发生淋巴结转移和周围脏器的侵润, 认为Survivin高表达, P16、RB表达缺失在原发性胆囊癌发生中起重要作用, Survivin高表达和P16表达缺失与胆囊癌的转移和侵润可能有密切关系. 本研究依据尚充分研究方法及实验结果准确, 有一定学术水平.
电编: 郭海丽 编辑:王晓瑜
| 1. | Kren L, Brazdil J, Hermanova M, Goncharuk VN, Kallakury BV, Kaur P, Ross JS. Prognostic significance of anti-apoptosis proteins survivin and bcl-2 in non-small cell lung carcinomas: a clinicopathologic study of 102 cases. Appl Immunohistochem Mol Morphol. 2004;12:44-49. [PubMed] [DOI] |
| 2. | Baffa R, Letko J, McClung C, LeNoir J, Vecchione A, Gomella LG. Molecular genetics of bladder cancer: targets for diagnosis and therapy. J Exp Clin Cancer Res. 2006;25:145-160. [PubMed] |
| 3. | Li W, Sanki A, Karim RZ, Thompson JF, Soon Lee C, Zhuang L, McCarthy SW, Scolyer RA. The role of cell cycle regulatory proteins in the pathogenesis of melanoma. Pathology. 2006;38:287-301. [PubMed] [DOI] |
| 4. | Pennati M, Folini M, Zaffaroni N. TARGETING SURVIVIN IN CANCER THERAPY: FULFILLED PROMISES AND OPEN QUESTIONS. Carcinogenesis. 2007;. [PubMed] [DOI] |
| 5. | Osaka E, Suzuki T, Osaka S, Yoshida Y, Sugita H, Asami S, Tabata K, Hemmi A, Sugitani M, Nemoto N. Survivin as a prognostic factor for osteosarcoma patients. Acta Histochem Cytochem. 2006;39:95-100. [PubMed] [DOI] |