修回日期: 2007-02-18
接受日期: 2007-03-06
在线出版日期: 2007-04-28
目的: 探讨牛磺酸在大鼠胰腺移植中对移植胰腺缺血再灌注损伤的保护作用及其机制.
方法: 采用大鼠胰十二指肠移植模型. Wistar大鼠30只随机分为三组(n = 10): (1)对照组: CMU-1液保存6 h再移植; (2)实验组A: CMU-1液+牛磺酸(5 mmol/L)保存6 h再移植; (3)实验组B: CMU-1液+牛磺酸(10 mmol/L)保存6 h再移植(CMU-1液是本实验室配制的多器官保存液). 于移植术后6 h取静脉血作胰腺外分泌功能即血清淀粉酶测定, 取胰腺组织作病理检查. 通过免疫组化染色观察炎性细胞因子TNF-α及IL-1β表达情况. 应用计算机图像分析系统测定其积分光密度值(IOD).
结果: 移植胰腺在通血后6 h血清淀粉酶均升高, 与对照组相比较, 加入牛磺酸后淀粉酶升高较对照组降低(911.2±9.9, 959.9±12.5 U/L vs 1239.5±68.3 U/L, P<0.05). 随着牛磺酸浓度的增大其作用也显著. 免疫组化结果显示, 移植后6 h胰腺组织TNF-α (12 346.4±4933.69, 16 016.33±4592.06 vs 22 039.71±4782.62, P<0.05及IL-1β (12 417.4±2222.9, 15 047.68±4484.4 vs 19 284.46±3178.19, P<0.05)在各组均表达, 但加入牛磺酸后能明显下调TNF-α及IL-1β的表达, 各组内的差异具有显著性(P<0.05). 光镜检查可见试验组的移植胰腺炎性改变明显减轻.
结论: 牛磺酸作为一种细胞保护剂能够抑制TNF-α和IL-1β的产生、抗细胞水肿, 减轻胰腺缺血再灌注损伤, 减轻胰腺炎症.
引文著录: 张克忠, 刘永锋, 程颖, 刘树荣, 王凤山, 石蕊, 赵宁. 牛磺酸对大鼠移植胰腺缺血再灌注损伤的保护作用. 世界华人消化杂志 2007; 15(12): 1358-1363
Revised: February 18, 2007
Accepted: March 6, 2007
Published online: April 28, 2007
AIM: To investigate the protective effect of taurine (TAU) on the ischemia and reperfusion injury during pancreas transplantation and its mechanism in rats.
METHODS: Rat models of pancreatic-duodenal transplantation were used in this study. Thirty Wistar rats were randomly allocated into 3 groups (n = 10), including control group (CMU-1 preservation solution), experiment group A (CMU-1 + TAU 5 mmol/L) and experiment group B (CMU-1 + TAU 10 mmol/L) (The liquid CMU-1 is multi-organ preservation solution produced in our laboratory). Blood samples were collected 6 hours after reperfusion for examination of serum amylase level. Pancreatic tissues were collect for pathologic observation. The expression of tumor necrosis factor-α (TNF-α) and interleukin-1b (IL-1β) were determined by immunohistochemistry using integrated optical density (IOD).
RESULTS: In comparison with that in control group, the level of serum amylase was increased 6 hours after reperfusion in experiment group A and B (911.2 ± 9.9, 959.9 ± 12.5 U/L vs 1239.5 ± 68.3 U/L, both P < 0.05). The effect of TAU was enhanced with the increased of concentrations. Immunohistochemistry showed that both TNF-α and IL-1β were expressed in pancreatic tissues 6 hours after transplantation, and TAU significantly inhibited TNF-α (12 346.4 ± 4933.69, 16 016.33 ± 4592.06 vs 22 039.71 ± 4782.62, both P < 0.05) and IL-1β (12 417.4 ± 2222.9, 15 047.68 ± 4484.4 vs 19 284.46 ± 3178.19, both P < 0.05) expression in experiment group A and B. Taurine treatment markedly ameliorated the inflammatory reaction of pancreatic tissues.
CONCLUSION: As a kind of cell-protection agent, TAU can inhibit the production of TNF-α and IL-1β, resist cell edema and alleviate ischemia/reperfusion-induced injury and pancreatitis.
- Citation: Zhang KZ, Liu YF, Cheng Y, Liu SR, Wang FS, Shi R, Zhao N. Protective effect of taurine against ischemia and reperfusion injury of transplanted pancreas in rats. Shijie Huaren Xiaohua Zazhi 2007; 15(12): 1358-1363
- URL: https://www.wjgnet.com/1009-3079/full/v15/i12/1358.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i12.1358
缺血再灌注损伤是造成胰腺移植后各种并发症的主要原因之一, 如移植术后早期胰腺炎[1]、移植胰腺的原发无功能、移植术后胰岛细胞功能不良等, 这些都大大降低胰腺移植的效果. 目前, 对缺血再灌注损伤的具体机制尚未完全阐明, 在这个过程中有多种因素参与, 如微循环灌注不良、细胞内酸中毒、钙超载、氧自由基的释放、中性粒细胞激活并释放炎性细胞因子等. 其中炎症性细胞因子如TNF-α[2]、IL-1β起关键作用, 炎性细胞因子大量释放可造成胰腺血管痉挛和损伤, 使毛细血管的内皮遭到破坏、大分子物质外渗和毛细血管床的减少, 进一步加重微循环障碍. 微循环障碍反过来又诱发了炎症介质的释放. 在保存液中加入各种细胞保护剂以减轻缺血再灌注损伤是器官移植研究的目标之一. 牛磺酸(taurine, TAU)是一种含硫氨基酸, 即2-氨基乙磺酸H2N-CH2-CH2-SO3H (C2H7NO3S = 111.1343). 几乎全部以游离形式存在, 细胞内外浓度比为100-50 000:1, 属于β-氨基酸, 是一种细胞保护剂, 具有重要生物学作用: 清除氧自由基, 抗脂质过氧化损伤, 抑制细胞凋亡和直接的膜保护作用, 能够调节细胞钙稳态, 对线粒体结构和功能起稳定作用, 维持细胞内外渗透压平衡, 抑制细胞因子的产生[3-5]. 我们通过大鼠胰十二指肠移植造成胰腺缺血再灌注损伤模型, 观察胰腺移植术后胰腺组织病理学变化、血清淀粉酶和细胞因子TNF-α、IL-1β的变化, 探讨牛磺酸在大鼠胰腺移植中对移植胰腺缺血再灌注损伤的保护作用及其机制.
取Wistar大鼠(体质量200-250 g, 购于中国医科大学实验动物部)30只随机分为3组(n = 10): (1)对照组: CMU-1液保存6 h再移植; (2)实验组A: CMU-1液+牛磺酸5 mmol/L保存6 h再移植(牛磺酸购自北京奥博星生物技术责任有限公司); (3)实验组B: CMU-1液+牛磺酸10 mmol/L保存6 h再移植(CMU-1液是本实验室配制的多器官保存液)(表1).
| 成分 | 成分 | ||
| Na+ | 125 mmol/L | 棉子糖 | 25 g/L |
| K+ | 25 mmol/L | 右旋糖苷-40 | 50 g/L |
| H2PO4- | 25 mmol/L | 组氨酸 | 60 mmol/L |
| 乳糖醛酸 | 100 mmol/L | 黏滞度 | 5.2 mpas |
| 渗透压 | 340 mosm/L | pH值 | 7.4±0.2 |
建立大鼠胰十二指肠移植模型, 于大鼠胰腺移植后6 h处死采静脉血检测血清淀粉酶, 取胰腺组织做病理学及免疫组化染色检测.
1.2.1 建立大鼠胰十二指肠移植模型: 供体手术: 术前12 h禁食不禁水, 乙醚持续吸入麻醉, 腹正中切口开腹, 提起十二指肠并切断Treitz韧带, 由横结肠系膜上锐性剥离胰腺, 结扎切断结肠动静脉. 向右推开小肠, 提起胃, 结扎并切断胃左动脉和脾动脉. 于脾门部将脾动静脉一并结扎成束, 由大网膜剥离胰腺实质. 结扎切断胃网膜右动静脉和胃右动静脉. 于近端在胃幽门轮处结扎切断十二指肠, 远端于Treitz韧带处切断十二指肠. 游离胆管和肝动脉, 于近肝门处一并结扎切断. 将腹腔干及肠系膜上动脉分支处的腹主动脉周围的组织剔除, 游离腹主动脉, 并将包括腰动脉在内的分支全部结扎切断. 靠近胰腺将肠系膜上静脉结扎切断, 用直角钳在腹腔干分支处上1 cm阻断腹主动脉血流, 于肠系膜上动脉分支处下方穿刺腹主动脉灌洗胰腺, 灌洗高度60 cm, 灌注液约4 mL, 同时于肝门部门静脉分支处切断门静脉, 胰腺颜色变白后, 将胰腺取出. 放入相应保存液中保存6 h后移植. 受体手术: 麻醉后用50 U/L的肝素生理盐水2 mL从尾静脉注射以肝素化, 取腹正中切口开腹. 钝性游离腹主动脉和下腔静脉的前面, 用血管夹同时阻断腹主动脉和下腔静脉血流, 用8-0丝线将供体胰腺复主动脉与受体腹主动脉作端侧吻合, 门静脉与受体下腔静脉作端侧吻合. 供通血前切除脾脏以减少血液丢失, 用7-0丝线将供体十二指肠断端与受体空肠作端侧吻合, 逐层关腹. 胰腺移植术后6 h取腔静脉血并处死大鼠, 取移植胰腺组织作病理及免疫组化.
1.2.2 胰腺外分泌功能检查: 血清淀粉酶: 采用碘淀粉酶比色法测定, 100 mL血清中的淀粉酶在37 ℃条件下, 15 min水解5 mg淀粉为一个单位.
1.2.3 组织病理学检查: 取材-固定, 经过脱水, 二甲苯标本透明, 石蜡包埋, 切片, 苏木素-伊红染色. 光镜下检查.
1.2.4 TNF-α及IL-1β免疫组化染色: TNF-α一抗BA0131购自武汉博士德生物工程有限公司, 即用型非生物素免疫组化检测试剂盒KIT-9901, 购自迈新生物技术有限公司. IL-1β一抗BA0962购自武汉博士德生物工程有限公司, 免疫组化操作步骤按试剂盒说明书进行. 免疫组化结果采用计算机图像灰度分析, 以积分光密度值(IOD)作计量分析, 每张片选4个视野.
统计学处理 所有数据均以mean±SD表示, 采用SPSS10.0软件方差分析, P<0.05为有统计学意义.
胰腺移植通血6 h后血清淀粉酶对照组为1239.5±68.3 U/L, 加入牛磺酸后淀粉酶较对照组降低, 实验组A为959.9±12.5 U/L; 实验组B为911.2±9.9 U/L, 各组间差异具有显著性(P<0.05). 实验结果表明大鼠胰腺移植时在保存液中加入牛磺酸后能抑制血清淀粉酶升高, 且随着牛磺酸浓度的增大其作用也显著.
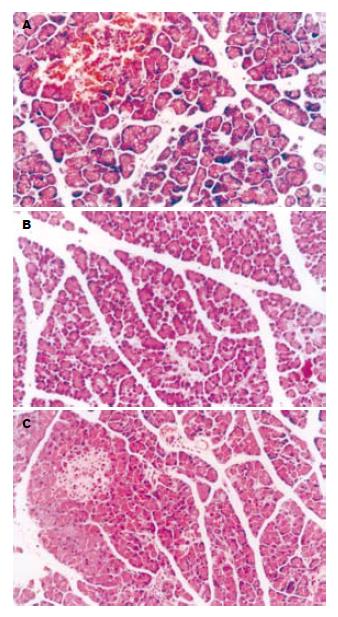
对照组移植后6 h可见胰腺间质充血水肿, 血管周围有炎性细胞浸润, 并且伴有出血, 间隙增宽, 腺泡受压萎缩, 胰腺腺泡细胞内有空泡形成, 并可见腺泡细胞死亡(图1A). 实验组A间质轻度水肿, 腺泡轻度肿胀, 无明显受压, 无出血, 在血管周围有少量炎症细胞浸润, 腺泡细胞内无空泡形成, 在相同时限内胰腺炎症明显减轻(图1B). 实验组B在光镜下与实验组A无明显差别(图1C).
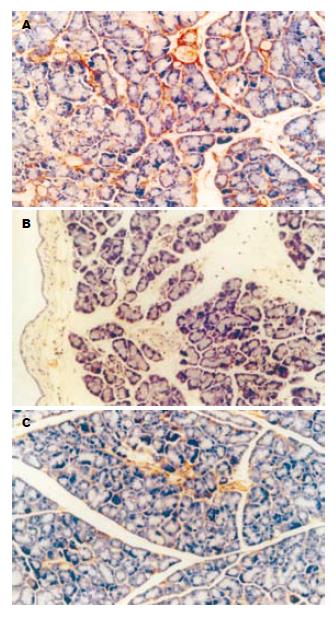
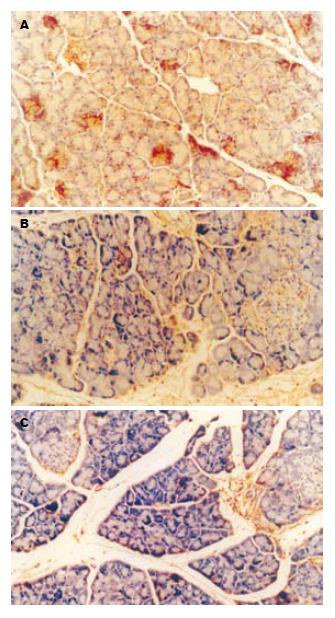
移植胰腺组织内TNF-α及IL-1β的表达, 移植后6 h胰腺组织的TNF-α及IL-1β在各组间的表达均增多, 其表达部位多位于细胞的胞质内, 而且胰腺腺泡细胞、血管内皮细胞、胰岛细胞内均有表达(图2A, 图3A), 并且随着牛磺酸浓度的增加, TNF-α及IL-1β的表达也逐渐减弱, 表明加入牛磺酸后能明显抑制TNF-α及IL-1β的表达且呈剂量依从关系(图2B-C, 图3B-C), 3组间的差异具有显著性(P<0.05, 表2).
胰腺小叶为胰腺微循环形态与机能的基本单位, 胰腺微循环的流向是由内分泌部流向外分泌部, 胰岛-腺泡-门脉循环是胰腺微循环的基本特征. 胰腺小叶多由独支的小叶内动脉供血, 相邻小叶内动脉及其分支间无吻合存在, 属于终动脉. 由于胰腺的微循环结构特点, 对缺血缺氧特别敏感, 缺血再灌注损伤是胰腺移植后胰腺炎的主要因素, 在这个过程中氧自由基、巨噬细胞、中性粒细胞激活、细胞内酸中毒、微循环灌注不良、细胞内环境稳态破坏是缺血再灌注损伤的主要机制[6]. 中性粒细胞激活后, 一方面游走黏附至静脉壁的血管内皮细胞形成血栓阻塞微血管减少血流, 造成微循环障碍, 导致胰腺水肿并进一步加重胰腺缺血[7-8], 我们发现大鼠胰腺移植后胰腺明显的肿胀, 对照组大鼠胰腺通血后呈现暗红色, 术后6 h供体胰腺仍稍显暗红色. 实验组的大鼠胰腺在通血后呈现淡红色, 在术后6 h供体胰腺为淡红色. 3组大鼠在移植后血清淀粉酶均升高, 但实验组淀粉酶升高较对照组明显降低, 另外, 从移植胰腺的病理改变来看, 对照组大鼠在移植术后胰腺腺泡肿胀明显, 间隙增宽, 腺泡受压萎缩, 胰腺腺泡细胞内有空泡形成, 说明胰腺移植术后存在胰腺炎症改变. 加入牛磺酸后胰腺水肿明显减轻. 表明牛磺酸确实具有抗细胞水肿作用, 其机制可能与牛磺酸的跨细胞膜转运特性有关. 牛磺酸作为有机溶质分子, 是一种渗透调节物质. 高渗时, 牛磺酸跨膜转运至细胞内增加[9-11]; 但是在实验组, 增加牛磺酸的浓度后移植胰腺的病理改变不十分明显, 这可能与细胞膜表面的牛磺酸转运体数量饱和有关. 通过本实验也可以推测, 由于器官切取时存在热缺血和冷缺血, 细胞能量代谢降低, 必然导致细胞渗透压改变及细胞肿胀, 在保存液中加入牛磺酸, 由于细胞内外浓度差以及细胞内外渗透压差的关系使牛磺酸跨细胞膜转运至细胞内增多, 从而在再灌注后发挥其细胞保护效应. 移植胰腺的缺血再灌注损伤与细胞因子的过度表达有关, 中性粒细胞和巨噬细胞被激活后可释放前炎症性细胞因子如TNF-α及IL-1β. 二者均是导致组织损伤的重要炎症介质[12-13], 并且具有趋化性, 能够促进中性粒细胞的释放, 诱导单核细胞和多型核粒细胞浸润到炎症局部, 进一步促进TNF-α及IL-1β的释放形成一种恶性循环, 进一步加重组织水肿、渗出和坏死等病理改变[14-17]. TNF-α可以同死亡受体TNFR1结合诱导胰岛凋亡[18-19]. IL-1β可以同胰岛表面的受体IL-1βR结合诱导NO合成增加, 并且通过诱导DNA条状断裂导致细胞死亡或者导致细胞凋亡[20]. 因此, 抑制TNF-α及IL-1β的释放对减轻胰腺移植后的非特异性炎症反应及排斥反应均具有重要意义. 我们在实验中发现, 胰腺经冷保存再移植后TNF-α及IL-1β表达明显增多, 胰腺腺泡细胞、血管内皮细胞及胰岛细胞均能产生TNF-α及IL-1β且存在于胞质内. 表明胰腺移植术后早期胰腺炎与这两种细胞因子的表达增多相关. 在保存液中加入牛磺酸后能明显抑制移植胰腺TNF-α及IL-1β的表达, 且有剂量依从关系. 可见牛磺酸通过抑制细胞因子的产生减轻胰腺炎症改变. 其抑制细胞因子产生的机制可能是牛磺酸能够阻止IkB-a降解, 从而阻止NF-kB从细胞质向细胞核易位从而降低其活性, 减弱IL-1β, TNF-α mRNA的转录, 减少细胞因子的表达[21-22]. 结合本实验结果表明牛磺酸作为胰腺移植的一种细胞保护成分是可行的. Mochizuki et al[23]和Tappaz[24]证明TNF-α和IL-1β能够增加牛磺酸的摄取活性200%和160%. 且随着时间的延长其摄取量也增加, 刺激24 h其摄取量达到高峰平台期, 且随着TNF-α浓度的增加, 其摄取量也增加. 可见TNF-α不仅是移植后胰腺炎的始动因子, 另一方面也可以通过牛磺酸的转运增加, 发挥牛磺酸的生物学效应, 减轻移植胰腺的再灌注损伤. 另外在中性粒细胞内牛磺酸通过髓过氧化物酶-卤化物系统和次卤酸反应生成的氯牛磺酸也具有细胞保护效应, 其机制主要是通过阻止IkB的磷酸化减弱NF-kB的活性从而够阻止iNOS和TNF-α mRNA的合成, 抑制NO及TNF-α的产生从而发挥抗氧自由基损伤[25-27]. 可见牛磺酸的生物学作用不仅通过其自身而且还通过其代谢产物来发挥的. 此外牛磺酸还可以通过抑制氧化应激及抑制细胞凋亡减轻缺血再灌注损伤[28-30]. Oriyanhan et al[31]在心脏停跳液中加入牛磺酸能促进移植后心脏功能的恢复. 可见牛磺酸通过多种机制减轻胰腺移植后的缺血再灌注损伤, 其机制是通过抑制DNA的氧化损伤和心肌细胞凋亡来实现的.
总之, TNF-α和IL-1β在胰腺缺血再灌注损伤过程中起重要作用. 牛磺酸作为一种细胞保护剂能够抑制TNF-α和IL-1β的产生、抗细胞水肿, 减轻胰腺缺血再灌注损伤, 减轻胰腺炎症. 本实验为在保存液中加入各种细胞保护剂以期减少移植术后并发症提高移植效果提供了一种实验依据.
缺血再灌注损伤是胰腺移植术后常见的病理生理过程, 是造成移植术后早期胰腺炎、移植胰腺的原发无功能、移植术后胰岛细胞功能不良等各种并发症的主要原因之一, 但其具体机制尚未完全阐明. 目前认为胰腺缺血再灌注损伤是多种因素参与并相互作用的结果, 因此探讨其发生机制及防治措施具有重要的临床意义.
冷保存再灌注损伤及防治一直是胰腺移植领域的研究难点. 牛磺酸具有清除氧自由基, 抑制细胞凋亡, 调节细胞钙稳态, 维持细胞内外渗透压平衡, 抑制细胞因子的产生等药理学作用, 在移植领域的应用正日益受到人们的关注.
本文首次证明了在保存液中加入牛磺酸后能明显抑制移植胰腺TNF-α及IL-1β的表达, 减轻移植胰腺的再灌注损伤,减轻胰腺炎症.
牛磺酸作为药物的单体成分, 其化学结构、药代动力学、药效学及药理作用机制明确, 副作用很小,目前已用于临床.
NF-κB: 是促炎性细胞因子转录调节过程中重要的核转录因子. 在静息细胞, IκB与NF-κB结合后组成p50-p65-IκB三聚体复合物, 可阻止NF-κB由胞质进入胞核, 使其以失活状态存在于细胞质中, TNF-α及IL-1β可诱导IκB蛋白被磷酸化, 使p50-p65-IκB三聚体复合物解聚而激活NF-κB, 使之快速易位进入核内, 与相应靶基因的启动子或增强子κB位点结合, 迅速诱导靶基因的转录.
本文研究了牛磺酸对大鼠移植胰腺缺血再灌注损伤的保护作用, 立题新颖, 材料方法科学性强, 结果结论可信, 有较高的实用价值.
电编: 张敏 编辑:王晓瑜
| 1. | Sakorafas GH, Tsiotos GG, Sarr MG. Ischemia/Reperfusion-Induced pancreatitis. Dig Surg. 2000;17:3-14. [PubMed] [DOI] |
| 2. | Morard M, Rocco P, Lima L, Miranda A, Madi K, Boasquevisque C. Therapeutic potential of a new TNF-alpha modulator and phosphodiesterases inhibitor on pulmonary ischemia-reperfusion injury. Rev Port Pneumol. 2006;12:27-28. [PubMed] |
| 3. | Takatani T, Takahashi K, Uozumi Y, Shikata E, Yamamoto Y, Ito T, Matsuda T, Schaffer SW, Fujio Y, Azuma J. Taurine inhibits apoptosis by preventing formation of the Apaf-1/caspase-9 apoptosome. Am J Physiol Cell Physiol. 2004;287:C949-953. [PubMed] [DOI] |
| 4. | Ahn BO, Kim KH, Lee G, Lee HS, Kim CD, Kim YS, Son MW, Kim WB, Oh TY, Hyun JH. Effects of taurine on cerulein-induced acute pancreatitis in the rat. Pharmacology. 2001;63:1-7. [PubMed] [DOI] |
| 5. | Hashiguchi Y, Fukushima R, Saito H, Naka S, Inaba T, Lin MT, Muto T. Interleukin-1 and tumor necrosis factor alter plasma concentration and interorgan fluxes of taurine in dogs. Shock. 1997;7:147-153. [PubMed] [DOI] |
| 6. | Obermaier R, Benz S, Kortmann B, Benthues A, Ansorge N, Hopt UT. Ischemia/reperfusion-induced pancreatitis in rats: a new model of complete normothermic in situ ischemia of a pancreatic tail-segment. Clin Exp Med. 2001;1:51-59. [PubMed] [DOI] |
| 7. | Menger MD, Bonkhoff H, Vollmar B. Ischemia-reperfusion-induced pancreatic microvascular injury. An intravital fluorescence microscopic study in rats. Dig Dis Sci. 1996;41:823-830. [PubMed] [DOI] |
| 8. | Puhl G, Schaser KD, Pust D, Kohler K, Vollmar B, Menger MD, Neuhaus P, Settmacher U. Initial hepatic microcirculation correlates with early graft function in human orthotopic liver transplantation. Liver Transpl. 2005;11:555-563. [PubMed] [DOI] |
| 9. | Deleuze C, Duvoid A, Moos FC, Hussy N. Tyrosine phosphorylation modulates the osmosensitivity of volume-dependent taurine efflux from glial cells in the rat supraoptic nucleus. J Physiol. 2000;523 Pt 2:291-299. [PubMed] [DOI] |
| 10. | Warskulat U, Zhang F, Haussinger D. Taurine is an osmolyte in rat liver macrophages (Kupffer cells). J Hepatol. 1997;26:1340-1347. [PubMed] [DOI] |
| 11. | Wettstein M, Haussinger D. Cytoprotection by the osmolytes betaine and taurine in ischemia-reoxygenation injury in the perfused rat liver. Hepatology. 1997;26:1560-1566. [PubMed] [DOI] |
| 12. | Izuishi K, Tsung A, Hossain MA, Fujiwara M, Wakabayashi H, Masaki T, Billiar TR, Maeta H. Ischemic preconditioning of the murine liver protects through the Akt kinase pathway. Hepatology. 2006;44:573-580. [PubMed] [DOI] |
| 13. | Bernik TR, Friedman SG, Ochani M, DiRaimo R, Susarla S, Czura CJ, Tracey KJ. Cholinergic antiinflammatory pathway inhibition of tumor necrosis factor during ischemia reperfusion. J Vasc Surg. 2002;36:1231-1236. [PubMed] [DOI] |
| 14. | Bhatia M, Wong FL, Cao Y, Lau HY, Huang J, Puneet P, Chevali L. Pathophysiology of acute pancreatitis. Pancreatology. 2005;5:132-144. [PubMed] [DOI] |
| 15. | Denham W, Norman J. The potential role of therapeutic cytokine manipulation in acute pancreatitis. Surg Clin North Am. 1999;79:767-781. [PubMed] [DOI] |
| 16. | Makhija R, Kingsnorth AN. Cytokine storm in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2002;9:401-410. [PubMed] [DOI] |
| 17. | Rother KI, Harlan DM. Challenges facing islet transplantation for the treatment of type 1 diabetes mellitus. J Clin Invest. 2004;114:877-883. [PubMed] [DOI] |
| 18. | Ehrnfelt C, Kumagai-Braesch M, Uzunel M, Holgersson J. Adult porcine islets produce MCP-1 and recruit human monocytes in vitro. Xenotransplantation. 2004;11:184-194. [PubMed] [DOI] |
| 19. | Thomas HE, Darwiche R, Corbett JA, Kay TW. Interleukin-1 plus gamma-interferon-induced pancreatic beta-cell dysfunction is mediated by beta-cell nitric oxide production. Diabetes. 2002;51:311-316. [PubMed] [DOI] |
| 20. | Wachlin G, Augstein P, Schroder D, Kuttler B, Kloting I, Heinke P, Schmidt S. IL-1βeta, IFN-gamma and TNF-alpha increase vulnerability of pancreatic beta cells to autoimmune destruction. J Autoimmun. 2003;20:303-312. [PubMed] [DOI] |
| 21. | Gurujeyalakshmi G, Wang Y, Giri SN. Taurine and niacin block lung injury and fibrosis by down-regulating bleomycin-induced activation of transcription nuclear factor-kappaB in mice. J Pharmacol Exp Ther. 2000;293:82-90. [PubMed] |
| 22. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammatory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-1208. [PubMed] |
| 23. | Mochizuki T, Satsu H, Shimizu M. Signaling pathways involved in tumor necrosis factor alpha-induced upregulation of the taurine transporter in Caco-2 cells. FEBS Lett. 2005;579:3069-3074. [PubMed] [DOI] |
| 24. | Tappaz ML. Taurine biosynthetic enzymes and taurine transporter: molecular identification and regulations. Neurochem Res. 2004;29:83-96. [PubMed] [DOI] |
| 25. | Liu Y, Tonna-DeMasi M, Park E, Schuller-Levis G, Quinn MR. Taurine chloramine inhibits production of nitric oxide and prostaglandin E2 in activated C6 glioma cells by suppressing inducible nitric oxide synthase and cyclooxygenase-2 expression. Brain Res Mol Brain Res. 1998;59:189-195. [PubMed] [DOI] |
| 26. | Barua M, Liu Y, Quinn MR. Taurine chloramine inhibits inducible nitric oxide synthase and TNF-alpha gene expression in activated alveolar macrophages: decreased NF-kappaB activation and IkappaB kinase activity. J Immunol. 2001;167:2275-2281. [PubMed] [DOI] |
| 27. | Theruvath TP, Zhong Z, Currin RT, Ramshesh VK, Lemasters JJ. Endothelial nitric oxide synthase protects transplanted mouse livers against storage/reperfusion injury: Role of vasodilatory and innate immunity pathways. Transplant Proc. 2006;38:3351-3357. [PubMed] [DOI] |
| 28. | Takahashi K, Ohyabu Y, Takahashi K, Solodushko V, Takatani T, Itoh T, Schaffer SW, Azuma J. Taurine renders the cell resistant to ischemia-induced injury in cultured neonatal rat cardiomyo-cytes. J Cardiovasc Pharmacol. 2003;41:726-733. [PubMed] [DOI] |
| 29. | Wu QD, Wang JH, Fennessy F, Redmond HP, Bouchier-Hayes D. Taurine prevents high-glucose-induced human vascular endothelial cell apoptosis. Am J Physiol. 1999;277:C1229-1238. [PubMed] |
| 30. | Oz E, Sivrikoz MC, Halit V, Altunkaya A, Take G. The role of taurine added to pulmonary reperfusion solutions in isolated guinea pig lungs. Amino Acids. 2002;22:391-403. [PubMed] [DOI] |
| 31. | Oriyanhan W, Yamazaki K, Miwa S, Takaba K, Ikeda T, Komeda M. Taurine prevents myocardial ischemia/reperfusion-induced oxidative stress and apoptosis in prolonged hypothermic rat heart preservation. Heart Vessels. 2005;20:278-285. [PubMed] [DOI] |